Интерхалькоген
Халькогены реагируют друг с другом с образованием интерхалькогенных соединений. [ 1 ]
Хотя ни один халькоген не является чрезвычайно электроположительным , [ примечание 1 ] и не настолько электроотрицательный , как галоген -фтор (наиболее электроотрицательный элемент), существует большая разница в электроотрицательности между верхней ( кислород = 3,44 — второй по электроотрицательности элемент после фтора) и нижней ( полоний = 2,0) группой. В сочетании с тем фактом, что существует значительная тенденция к усилению металлического поведения при движении вниз по группе (кислород — это газообразный неметалл , а полоний — серебристый постпереходный металл). [ примечание 2 ] ), это заставляет интерхалькогены проявлять множество различных типов связей: ковалентную , ионную , металлическую и полуметаллическую . [ примечание 3 ] [ 1 ]
Известные бинарные интерхалькогены
[ редактировать ]| ТО | ||||||
|---|---|---|---|---|---|---|
| ТО | С
| |||||
| С | Се
| |||||
| Се | См . x S y |
Te
| ||||
| Te | Te x S y (многие неизвестны) |
Te x Se y (многие неизвестны) |
Po
| |||
| Po | (многие неизвестны) |
По х Се y (многие неизвестны) |
По х Те y (неизвестный) |
Лев
| ||
| Лев | LvO, LvO 2 (прогнозируется) |
LvS (прогнозировано) |
LqCy (прогнозировано) |
Lv x Te y (прогнозируется) |
Ув х По у (прогнозировано) |
(прогнозировано) |
Связь в бинарных интерхалькогенах
[ редактировать ]Спускаясь по приведенной выше таблице, происходит переход от ковалентной связи (с дискретными молекулами ) к ионной связи ; проходя по таблице, происходит переход от ионной связи к металлической связи . (Ковалентная связь возникает, когда оба элемента имеют одинаковую высокую электроотрицательность; ионная связь возникает, когда два элемента имеют очень разные электроотрицательности: один низкий, а другой высокий; металлическая связь возникает, когда оба элемента имеют одинаковую низкую электроотрицательность.) Например, в крайнем левом столбце таблицы (со связями с кислородом), О 2 и О 3 чисто ковалентны, SO 2 и SO 3 – полярные молекулы, SeO 2 образует цепочечные полимеры (вытягивающиеся в одном измерении), TeO 2 образует слоистые полимеры (растягивающиеся в двух измерениях), а PoO 2 ионный со структурой флюорита (пространственные полимеры, вытягивающиеся в трех измерениях); в нижней строке таблицы (с связями с полонием), PoO 2 и PoS являются ионными, По х Се y и Po x Te y являются полуметаллическими, а Po ∞ является металлическим. [ 1 ]
Краткое изложение известных бинарных интерхалькогенов
[ редактировать ]Халькогениды серы
[ редактировать ]
- Низшие оксиды серы , S x O y , где соотношение x : y больше 1:2.
- дисульфид монооксид , S2С2О
- дисульфид диоксид , S2OS2O2
- Окись серы , SO
- диоксид серы , SOSO2
- триоксид серы , SOSO3
- Высшие оксиды серы , ТАК x где x > 3
Халькогениды селена
[ редактировать ]
- диоксид селена , СеО 2
- триоксид селена , СеО 3
- Смеси селена и серы в разных концентрациях с ковалентной связью, См . x S y
- « Моносульфид селена », SeS
- « Дисульфид селена », SeS 2 фактически смесь цикло- , Se 3 S 5 и цикло- Се 2 С 6
- « Трисульфид селена », SeS 3 , фактически встречающийся в виде 8-членного циклического соединения. Se 2 S 6 (диселенациклооктасульфан), где два атома серы в молекуле циклооктасеры заменены селена. атомами
Халькогениды теллура
[ редактировать ]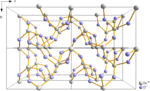
- Оксид теллура , TeO (нестабильные переходные частицы)
- диоксид теллура , TeOТеО2
- триоксид теллура , TeOТеО3
- пятиокись дителлура , Te2OТе2О5 [ 2 ]
- Многие «сплавы» теллура и серы в разных концентрациях с полуметаллической связью, Те х сы
- Многие «сплавы» теллура и селена в разных концентрациях с полуметаллической связью, Т х се й
Халькогениды полония
[ редактировать ]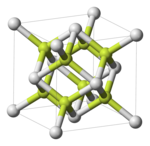
- Оксид полония , PoO
- диоксид полония , ПОО 2
- триоксид полония , ПП 3
- Сульфид полония , PoS
- Многие «сплавы» полония и селена в разных концентрациях с полуметаллической связью, По х Се y
- Многие «сплавы» полония и теллура в разных концентрациях с полуметаллической связью, По х Те y
Халькогениды ливермория
[ редактировать ]Из-за короткого периода полураспада всех известных изотопов ливермория все предложенные соединения являются теоретическими.
- Оксид ливермория(II), LvO
- оксид ливермория(IV), LvOLvO2
- Сульфид ливермория, LvS
- Селенид ливермория, LvSe
- Многие «сплавы» ливермория и теллура разной концентрации с полуметаллической связью, Lv x Te у
- Сплавы ливермория и полония различной концентрации с металлической связкой, Ув х По у
См. также
[ редактировать ]Примечания
[ редактировать ]- ^ Полинга В этой статье повсюду используется электроотрицательность .
- ^ Классификация полония как постпереходного металла или металлоида оспаривается.
- ^ Более тяжелые галогены достаточно электроотрицательны, чтобы предотвратить ионную или металлическую связь в межгалогенах , а более легкие пниктогены недостаточно электроотрицательны, чтобы обеспечить ионную или металлическую связь в интерпниктогенах .
Ссылки
[ редактировать ]- ^ Jump up to: а б с Холлеман, Арнольд Фредерик; Виберг, Эгон (2001), Виберг, Нильс (ред.), Неорганическая химия , перевод Иглсона, Мэри; Брюэр, Уильям, Сан-Диего/Берлин: Academic Press/De Gruyter, стр. 585–586, ISBN 0-12-352651-5
- ^ Линдквист, О.; Море, Дж. (1973). «Кристаллическая структура пятиокиси дителлура Te2O5» . Acta Crystallographica Раздел B: Структурная кристаллография и кристаллохимия . 29 (4): 643–650. дои : 10.1107/S0567740873003092 .