Литий-воздушная батарея
В этой статье есть несколько проблем. Пожалуйста, помогите улучшить его или обсудите эти проблемы на странице обсуждения . ( Узнайте, как и когда удалять эти шаблонные сообщения )
|
| Удельная энергия | 40,104 МДж/кг (11 140 Втч/кг) теоретический |
|---|---|
| Плотность энергии | ? Дж / м³ |
| Удельная мощность | 11 400 Вт / кг |
| Номинальное напряжение ячейки | 2.91 V |
Литий -воздушная батарея Li -air ) представляет собой металло-воздушный электрохимический элемент или химическую батарею в которой используется окисление лития ( на аноде и восстановление кислорода , на катоде для создания тока. [1]
Соединение лития и окружающего кислорода теоретически может привести к созданию электрохимических ячеек с максимально возможной удельной энергией . Действительно, теоретическая удельная энергия неводного литий-воздушного аккумулятора в заряженном состоянии с продуктом Li 2 O 2 и без учета массы кислорода составляет ~40,1 МДж/кг = 11,14 кВтч/кг лития. Это сопоставимо с теоретической удельной энергией бензина ~46,8 МДж/кг. На практике были продемонстрированы литий-воздушные аккумуляторы с удельной энергией ~6,12 МДж/кг = 1,7 кВтч/кг лития на уровне ячеек. Это примерно в 5 раз больше, чем у коммерческой литий-ионной батареи , и этого достаточно для пробега электромобиля массой 2000 кг примерно 500 км (310 миль) на одной зарядке с использованием 60 кг лития (т. е. 20,4 кВтч/100 км). ). Однако практическая мощность и срок службы литий-воздушных батарей нуждаются в значительном улучшении, прежде чем они смогут найти свою рыночную нишу.
Для разработки коммерческого внедрения необходимы значительные достижения в области электролитов. [2] Рассматриваются четыре подхода: апротонный , [3] [4] [5] водный , [6] твердотельный [7] и смешанные водно-апротонные. [8]
Основным драйвером рынка аккумуляторов является автомобильный сектор. Плотность энергии бензина составляет примерно 13 кВт·ч/кг, что соответствует 1,7 кВт·ч/кг энергии, передаваемой колесам после потерь. Теоретически литий-воздух может достигать 12 кВт·ч/кг (43,2 МДж/кг) без учета массы кислорода. Учитывая вес полного аккумуляторного блока (корпус, воздушные каналы, литиевая подложка), хотя литий сам по себе очень легкий, плотность энергии значительно ниже. [9]
История
[ редактировать ]Первоначально предложенные в 1970-х годах в качестве возможного источника питания для аккумуляторных электромобилей и гибридных электромобилей , литий-воздушные батареи вновь привлекли научный интерес в конце первого десятилетия 2000-х годов благодаря достижениям в области материаловедения .
Хотя идея литий-воздушной батареи возникла задолго до 1996 года, [10] [11] [12] [13] соотношение риска и выгоды считалось слишком высоким, чтобы его можно было использовать. Действительно, как отрицательный (металлический литий), так и положительный (воздушный или кислородный) электроды являются причинами того, что перезаряжаемые литий-металлические аккумуляторы не смогли выйти на рынок в 1970-х годах соответственно (литий-ионный аккумулятор в мобильном устройстве использует LiC 6 - соединение графита на отрицательном электроде, а не металлический литий). Тем не менее, из-за кажущегося отсутствия других альтернатив перезаряжаемым батареям с высокой удельной энергией, а также из-за некоторых изначально многообещающих результатов академических лабораторий, [10] [11] В 2006 году как количество патентов, так и бесплатных публикаций, касающихся литий-кислородных (включая литий-воздушные) батарей, начало расти в геометрической прогрессии. [14] [11] Однако технические трудности, с которыми сталкиваются такие батареи, особенно время перезарядки, чувствительность к азоту и воде, а также [15] присущая заряженным частицам Li 2 O 2 плохая проводимость является серьезной проблемой. [16]
Конструкция и эксплуатация
[ редактировать ]
Обычно ионы лития перемещаются между анодом и катодом через электролит. При разряде электроны следуют по внешней цепи, совершая электрическую работу, а ионы лития мигрируют к катоду. Во время зарядки металлические литиевые пластины помещаются на анод, освобождая O
2 на катоде. [17] Оба неводные [18] аккумуляторы (с Li 2 O 2 или LiO 2 в качестве продуктов разряда) и водные (LiOH в качестве продукта разряда) . Li-O 2 Рассмотрены [19] [20] Водная батарея требует защитного слоя на отрицательном электроде, чтобы предотвратить реакцию металлического лития с водой.
Анод
[ редактировать ]
Металлический литий является типичным выбором анода. На аноде электрохимический потенциал заставляет металлический литий выделять электроны посредством окисления (без участия катодного кислорода). Полуреакция: [21]
- Ли ⇌ Ли + + и −
Литий имеет высокую удельную емкость (3840 мАч/г) по сравнению с другими материалами металло-воздушных аккумуляторов (820 мАч/г для цинка, 2965 мАч/г для алюминия ). [22] Такие клетки затрагивают несколько проблем.Основная проблема при разработке анодов — предотвратить реакцию анода с электролитом. Альтернативы включают новые материалы электролита или изменение конструкции интерфейса между электролитом и анодом. Литиевые аноды создают риск дендритных отложений лития, снижая энергоемкость или вызывая короткое замыкание . [23] Влияние размера пор и распределения пор по размерам остается плохо изученным. [22]
При зарядке/разрядке в апротонных элементах слои солей лития осаждаются на анод, в конечном итоге покрывая его и создавая барьер между литием и электролитом. Этот барьер первоначально предотвращает коррозию, но в конечном итоге препятствует кинетике реакции между анодом и электролитом. [24] Это химическое изменение границы раздела твердое тело-электролит (SEI) приводит к изменению химического состава поверхности, что приводит к соответствующему изменению тока. Неравномерное распределение тока способствует росту ветвящихся дендритов и обычно приводит к короткому замыканию между анодом и катодом. [25]
В водных элементах проблемы SEI связаны с высокой реакционной способностью металлического лития по отношению к воде. [26]
Несколько подходов пытаются преодолеть эти проблемы:
- Формирование литий-ионного защитного слоя с использованием ди- и триблок- сополимерных электролитов. [27] По данным Seeo, Inc., [27] такие электролиты (например, полистирол с высокой литий-ионной проводимостью мягкого полимерного сегмента, такого как смесь поли(этиленоксида (ПЭО) и соли лития)) сочетают в себе механическую стабильность твердого полимерного сегмента с высокой ионной проводимостью. мягкой смеси полимер-литий-соли. Твердость предотвращает замыкание дендритов посредством механической блокировки.
- Литий-ионное проводящее стекло или стеклокерамические материалы [7] [28] [29] (как правило) легко восстанавливаются металлическим литием и, следовательно, представляют собой тонкую пленку стабильного проводящего литий материала, такого как Li
3 П или Ли
3 N , можно вставить между керамикой и металлом. Этот SEI на керамической основе препятствует образованию дендритов и защищает металлический литий от атмосферного загрязнения.
Катод
[ редактировать ]На катоде во время зарядки кислород отдает электроны литию посредством восстановления. Мезопористый углерод использован в качестве катодной подложки с металлическими катализаторами. [30] которые улучшают кинетику восстановления и увеличивают удельную емкость катода. [31] Марганец, кобальт, рутений, платина, серебро или смесь кобальта и марганца являются потенциальными металлическими катализаторами. При некоторых обстоятельствах катоды с марганцевым катализом показали лучшие результаты с удельной емкостью 3137 мА·ч/г углерода, а катоды с кобальтовым катализом показали себя вторыми с удельной емкостью 2414 мА·ч/г углерода. [32] Согласно первому моделированию литий-воздушных батарей в масштабе пор, микроструктура катода существенно влияет на емкость батареи как в режиме без блокировки пор, так и в режиме блокировки пор. [33]
Большинство ограничений литий-воздушной батареи приходится на катод, что также является источником ее потенциальных преимуществ. На катоде должен присутствовать кислород воздуха, но такие загрязнения, как водяной пар, могут его повредить. [4] неполный разряд из-за закупорки пористого угольного катода продуктами разряда, например пероксидом лития Наиболее опасен (в апротонных конструкциях).
Катализаторы показали многообещающую возможность создания преимущественного зародышеобразования Li.
22О
2 о Ли
2 O , что необратимо по отношению к литию. [34]
Производительность Li-air ограничена эффективностью реакции на катоде, поскольку большая часть падения напряжения . там происходит [22] Были оценены несколько химических веществ, различающихся электролитом. Это обсуждение сосредоточено на апротонных и водных электролитах, поскольку электрохимия твердого тела плохо изучена.
В ячейке с апротонным электролитом оксиды лития образуются путем восстановления на катоде:
- Что + + и − + О
2 + * → LiO
2 * - Что + + и − + ЛиО
2 * → Li
22О
2 *
где «*» обозначает участок поверхности на Li
22О
2 , где идет рост, который по существу представляет собой нейтральную вакансию Li в Li
22О
2 поверхность.
Оксиды лития нерастворимы в апротонных электролитах, что приводит к засорению катода. [35]
MnO
Катодный массив из 2 нанопроволок, дополненный генетически модифицированным вирусом -бактериофагом M13, обеспечивает в два-три раза большую плотность энергии, чем литий-ионные батареи 2015 года. Вирус увеличил размер массива нанопроволок, который составляет около 80 нм в поперечнике. Полученные провода имели шипованную поверхность. Шипы создают большую площадь поверхности для размещения мест реакции. Вирусный процесс создает сшитую трехмерную структуру, а не изолированные провода, стабилизируя электрод. Вирусный процесс основан на воде и протекает при комнатной температуре. [36] [37]
Электролит
[ редактировать ]Усилия по созданию литий-воздушных батарей были сосредоточены на четырех электролитах: водном кислотном, водном щелочном, неводном протонном и апротонном.
В ячейке с водным электролитом восстановление на катоде также может привести к образованию гидроксида лития:
Водный
[ редактировать ]Водный литий-воздушный аккумулятор состоит из металлического литиевого анода, водного электролита и пористого углеродного катода. Водный электролит объединяет соли лития, растворенные в воде. Это позволяет избежать проблемы засорения катода, поскольку продукты реакции растворимы в воде. [6] Водная конструкция имеет более высокий практический потенциал разряда, чем ее апротонный аналог. Однако металлический литий бурно реагирует с водой, и поэтому водная конструкция требует наличия твердого электролита на границе раздела между литием и электролитом. Обычно используется литийпроводящая керамика или стекло, но проводимость обычно низкая (порядка 10 −3 См/см при температуре окружающей среды). [26]
Кислый электролит
[ редактировать ]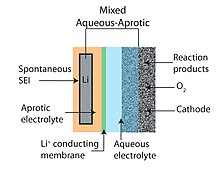
- 2Li + ½ О
2 +2Ч + → 2Ли + + Ч
22О
В реакции участвует сопряженное основание. Теоретическая максимальная удельная энергия и плотность энергии литий-воздушного элемента составляют 1400 Вт·ч/кг и 1680 Вт·ч/л соответственно. [9]
Щелочной водный электролит
[ редактировать ]- 2Li + ½ О
2 + Ч
2О → 2LiOH
Молекулы воды участвуют в окислительно-восстановительных реакциях на воздушном катоде. Теоретическая максимальная удельная энергия и плотность энергии литий-воздушного элемента составляют 1300 Вт·ч/кг и 1520 Вт·ч/л соответственно. [9]
Новые катодные материалы должны учитывать значительные количества LiO.
2 , Это
22О
2 и/или LiOH, не вызывая закупорки катодных пор, и использовать подходящие катализаторы, чтобы сделать электрохимические реакции энергетически практичными.
- Материалы с двойной системой пор предлагают наиболее многообещающую энергетическую емкость. [38]
- Первая система пор служит хранилищем продуктов окисления.
- Вторая система пор служит для транспорта кислорода.
Апротонный
[ редактировать ]
Первыми были продемонстрированы неводные литий-воздушные батареи. [10] Обычно используют смешанные этиленкарбонат + пропиленкарбонат растворители с солями LiPF 6 или биссульфонимида Li, как и в обычных литий-ионных батареях, однако с гелеобразным, а не жидким электролитом. [20] Разница напряжений при заряде и разряде постоянным током обычно составляет от 1,3 до 1,8 В (с OCP около 4,2 В) даже при таких низких токах, как 0,01–0,5 мА/см. 2 и 50–500 мА/г С на положительном электроде (см. рисунок 2), [19] [18] [39] Однако карбонатные растворители испаряются и окисляются из-за высокого перенапряжения при зарядке. [40] Были рассмотрены другие растворители, такие как глимы с концевыми группами, ДМСО, диметилацетамид и ионные жидкости. [19] [20] Углеродный катод окисляется при температуре выше +3,5 В Li во время зарядки, образуя Li 2 CO 3 , что приводит к необратимой потере емкости. [20]
Большинство усилий было связано с апротонными материалами, которые состоят из металлического литиевого анода, жидкого органического электролита и пористого углеродного катода. [3] Электролит может быть изготовлен из любой органической жидкости, способной сольватировать соли лития, например LiPF.
6 , ЛиАсФ
6 , LiN(SO
2 CF
3 )
2 и LiSO
33CF
3 , но обычно состоял из карбонатов , простых и сложных эфиров . [3] [17] Углеродный катод обычно изготавливается из углеродного материала с большой площадью поверхности с наноструктурным катализатором из оксида металла (обычно MnO
2 или Мн
33О
4 ). Основным преимуществом является самопроизвольное образование барьера между анодом и электролитом (аналогично барьеру, образующемуся между электролитом и углеродно-литиевым анодом в обычных литий-ионных батареях), который защищает металлический литий от дальнейшей реакции с электролитом. Хоть и перезаряжаемый, [9] Ли
22О
2 , образующийся на катоде, обычно нерастворим в органическом электролите, что приводит к его отложению на границе раздела катод/электролит. Это делает катоды в апротонных батареях склонными к засорению и расширению объема, что постепенно снижает проводимость и ухудшает характеристики батареи. [6] [26] [41] Другая проблема заключается в том, что органические электролиты легко воспламеняются и могут воспламениться в случае повреждения элемента. [7]
Хотя большинство исследований сходятся во мнении, что Ли
22О
2 является конечным продуктом разряда неводных Li-O 2 аккумуляторов, что является убедительным доказательством того, что его образование не протекает как прямое 2-электронное электровосстановление до пероксида O. 2−
2 (который является обычным путем восстановления O 2 в воде на углероде), а скорее через одноэлектронное восстановление до супероксида O −
2 с последующей его диспропорцией:
| 2 ЛиО 2 ⇌ Ли 22О 2 +О 2 | ( 1 ) |
Традиционно супероксид (O −
2 ) считался опасным промежуточным продуктом в апротонно-кислородных батареях из-за его высокой нуклеофильности , основности и окислительно-восстановительного потенциала. [19] [18] Однако, сообщает [42] [43] предполагают, что LiO 2 является одновременно промежуточным продуктом при разряде в пероксид ( Li
22О
2 ) и может использоваться в качестве конечного продукта разряда, потенциально с увеличенным сроком службы, хотя и с более низкой удельной энергией (немного больший вес батареи). Действительно, было показано, что при определенных условиях супероксид может быть стабилен в течение 20–70 часов при комнатной температуре. [42] Необратимая потеря емкости при диспропорции LiO 2 в заряженной батарее не рассматривалась.
Pt/C, по-видимому, является лучшим электрокатализатором для выделения O 2 O 2, , а Au/C для восстановления когда Li
22О
2 – это продукт. [44] Тем не менее, «производительность перезаряжаемых литий-воздушных батарей с неводными электролитами ограничена реакциями на кислородном электроде, особенно выделением O 2 . Обычные пористые углеродные воздушные электроды не способны обеспечить мАч/г и мАч/см. 2 мощности и скорости разряда на уровне, необходимом для аккумуляторов с действительно высокой плотностью энергии для электромобилей». [44] Емкость (в мАч/см 2 ), а срок службы неводных батарей Li-O 2 ограничен отложением нерастворимых и плохо проводящих электронику фаз LiOx при разряде. [19] ( Ли
33О
4, по прогнозам, будет иметь лучшую проводимость Li+, чем LiO 2 и Li.
22О
2 фазы). [45] Это делает практическую удельную энергию Li-O 2 аккумуляторов значительно меньшей, чем предсказывает расчет уровня реагента. Похоже, что эти параметры достигли своего предела, и дальнейшее улучшение ожидается только от альтернативных методов.
Смешанный водно-апротонный
[ редактировать ]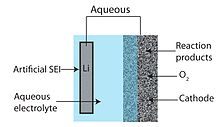
Конструкция водно-апротонной или смешанной литий-воздушной батареи пытается объединить преимущества конструкции апротонной и водной батареи. Общей чертой гибридных конструкций является двухкомпонентный (одна часть водного и одна часть апротонного) электролита, соединенного литийпроводящей мембраной . Анод примыкает к апротонной стороне, а катод контактирует с водной стороной. В качестве мембраны, соединяющей два электролита, обычно используется литийпроводящая керамика. [6] [9]
Использование твердого электролита (см. рис. 3) является одним из таких альтернативных подходов, позволяющим комбинировать металлический литий-анод с водным катодом. [46] керамические твердые электролиты (КТЭ) семейства NASICON (например, Li 1−x A x M 2−x (PO 4 ) 3 Изучены с A ∈ [Al, Sc, Y] и M ∈ [Ti, Ge]). . Совместимы с водой при щелочном pH и имеют большое электрохимическое окно (см. рис. 3,4), низкую ионную проводимость Li+ вблизи комнатной температуры (< 0,005 См/см, >85 Ом·см). 2 ) [20] делает их непригодными для автомобильных и стационарных систем хранения энергии, которые требуют низкой стоимости (т. е. плотность рабочего тока превышает 100 мА/см). 2 ). Кроме того, как Ti, так и Ge восстанавливаются металлическим Li, и требуется промежуточный слой между керамическим электродом и отрицательным электродом. Напротив, твердые полимерные электролиты (ТПЭ) могут обеспечить более высокую проводимость за счет более быстрого перехода воды и других небольших молекул, которые реагируют с металлическим литием. Среди наиболее экзотических мембран, рассматриваемых для аккумуляторов Li-O 2, — монокристаллический кремний. [40]
использовался высокопористый графен В 2015 году исследователи объявили о конструкции, в которой в качестве анода , электролит из бис (трифторметил) сульфонилимида лития / диметоксиэтана с добавлением воды и йодида лития для использования в качестве «медиатора». Электролит производит на катоде гидроксид лития (LiOH) вместо пероксида лития ( Li
22О
2 ). Результат обеспечил энергоэффективность 93 процента (разрыв напряжения 0,2) и цикличность более 2000 раз с небольшим влиянием на выходную мощность. [47] [48] Однако конструкция требовала чистого кислорода, а не окружающего воздуха. [49]
Твердотельный
[ редактировать ]
Конструкция твердотельного аккумулятора привлекательна своей безопасностью, исключающей вероятность возгорания от разрыва. [7] В современных твердотельных литий-воздушных батареях используется литиевый анод, керамический, стеклянный или стеклокерамический электролит и пористый углеродный катод. Анод и катод обычно отделены от электролита полимерно-керамическими композитами, которые усиливают перенос заряда на аноде и электрохимически связывают катод с электролитом. Полимерно-керамические композиты снижают общий импеданс. Основным недостатком конструкции твердотельного аккумулятора является низкая проводимость большинства стеклокерамических электролитов. Ионная проводимость современных литий- быстрых ионных проводников ниже, чем у альтернатив с жидким электролитом. [50]
Проблемы
[ редактировать ]По состоянию на 2013 год перед дизайнерами стояло множество задач.
Катод
[ редактировать ]Большинство ограничений литий-воздушной батареи приходится на катод, что также является источником ее потенциальных преимуществ. Наиболее заметным является неполный разряд из-за закупорки пористого углеродного катода продуктами разряда, такими как пероксид лития (в апротонных конструкциях). Было смоделировано несколько режимов выделений. [51] Параметр Da был определен для измерения изменений температуры, концентрации видов и потенциалов. [52] [53]
Влияние размера пор и распределения пор по размерам остается плохо изученным. [22]
Катализаторы показали многообещающую возможность создания преимущественного зародышеобразования Li.
22О
2 о Ли
2 O , что необратимо по отношению к литию. [34]
На катоде должен присутствовать кислород воздуха, но такие загрязнения, как водяной пар, могут его повредить. [4]
Электрохимия
[ редактировать ]заряда В конструкциях элементов 2017 года перенапряжение значительно превышает перенапряжение разряда. Значительное перенапряжение заряда указывает на наличие вторичных реакций. [54] Таким образом, электрический КПД составляет всего около 65%. [22]
Катализаторы, такие как MnO
2 , Co, Pt и Au потенциально могут снизить перенапряжения , но эффект плохо изучен. [34] Несколько катализаторов улучшают характеристики катода, особенно MnO.
2 , и механизм улучшения известен как окислительно-восстановительный процесс поверхностного кислорода, обеспечивающий обильные начальные места роста пероксида лития. [55] Сообщается также, что катализаторы могут изменить структуру оксидных отложений. [56] [57]
Еще одной проблемой является значительное падение емкости элемента при увеличении скорости разряда. Уменьшение емкости ячейки связано с кинетическими ограничениями переноса заряда. [22] Поскольку анодная реакция протекает очень быстро, считается, что пределы переноса заряда возникают на катоде.
Стабильность
[ редактировать ]Длительная работа аккумулятора требует химической стабильности всех компонентов элемента. Современные конструкции ячеек демонстрируют плохую устойчивость к окислению продуктами реакции и промежуточными соединениями. Многие водные электролиты летучи и могут со временем испаряться. [22] Стабильности обычно препятствуют паразитные химические реакции, например, с участием активного кислорода . [58] [59]
Приложения
[ редактировать ]Транспортные средства
[ редактировать ]Литий-воздушные элементы представляют интерес для электромобилей из-за их высокой теоретической удельной и объемной плотности энергии, сравнимой с бензином . Электродвигатели обеспечивают высокий КПД (95% против 35% у двигателя внутреннего сгорания ). Литий-воздушные элементы могли бы обеспечить запас хода, эквивалентный сегодняшним автомобилям с аккумуляторной батареей, составляющей одну треть размера стандартных топливных баков, при условии, что баланс установки, необходимый для поддержания батареи, будет иметь незначительную массу или объем. [ нужна ссылка ]
Резервное копирование сети
[ редактировать ]В 2014 году исследователи из Университета штата Огайо анонсировали гибридную солнечную батарею. До 20% энергии, вырабатываемой обычными солнечными элементами, теряется при передаче и зарядке аккумулятора. Гибрид сохраняет почти 100% производимой энергии. В одной из версий гибрида использовалась калий-ионная батарея, использующая калий-воздух. Он предлагал более высокую плотность энергии, чем обычные литий-ионные батареи, стоил дешевле и не содержал токсичных побочных продуктов. Последнее устройство по существу заменило калий литием. [60] [61]
В солнечном элементе использовалась сетка, сделанная из микроскопических стержней диоксида титана, пропускающая необходимый кислород. Захваченный солнечный свет производит электроны, которые разлагают перекись лития на ионы лития, тем самым заряжая батарею. Во время разряда кислород из воздуха восполнял перекись лития. [60]
См. также
[ редактировать ]- Список типов батарей
- Литий-ионный аккумулятор
- Литий-железо-фосфатный аккумулятор
- Литий-полимерный аккумулятор
- Литий-ионная проточная батарея
- Литий-серная батарея
- Металловоздушная электрохимическая ячейка
- Нанопроволочная батарея
- Нанопоровая батарея
- Соотношение мощности и веса
- Цинк-воздушная батарея
Ссылки
[ редактировать ]- ^ Бадвал, Сухвиндер П.С.; Гидди, Сарбжит С.; Маннингс, Кристофер; Бхатт, Ананд И.; Холленкамп, Энтони Ф. (24 сентября 2014 г.). «Новые технологии электрохимического преобразования и хранения энергии» . Границы в химии . 2 : 79. Бибкод : 2014FrCh....2...79B . дои : 10.3389/fchem.2014.00079 . ПМЦ 4174133 . ПМИД 25309898 .
- ^ Кристенсен, Дж.; Альбертус, П.; Санчес-Каррера, РС; Ломанн, Т.; Козинский, Б.; Лидтке, Р.; Ахмед, Дж.; Койич, А. (2012). «Критический обзор литий-воздушных батарей» . Журнал Электрохимического общества . 159 (2): Р1. дои : 10.1149/2.086202jes .
- ^ Jump up to: а б с Юнеси, Реза; Вейт, Габриэль М.; Йоханссон, Патрик; Эдстрем, Кристина ; Вегге, Тейс (2015). «Соли лития для современных литиевых батарей: Li–metal, Li–O 2 и Li–S» . Энергетическая среда. Наука . 8 (7): 1905–1922. дои : 10.1039/c5ee01215e .
- ^ Jump up to: а б с Огасавара, Т.; Дебар, Алабама; Хольцапфель, М.; Новак, П.; Брюс, PG (2006). «Перезаряжаемый Li2O2электрод для литиевых батарей». Журнал Американского химического общества . 128 (4): 1390–1393. дои : 10.1021/ja056811q . ПМИД 16433559 .
- ^ Дебарт, А; Бао, Дж; и др. (2008). «α- MnO
2 нанопровода: катализатор получения О
2 Электрод в перезаряжаемых литиевых батареях». Angew. Chem . 47 (24): 4521–4524. doi : 10.1002/anie.200705648 . PMID 18461594 . - ^ Jump up to: а б с д Он, П.; Ван, Ю.; Чжоу, Х. (2010). «Литий-воздушный топливный элемент с рециркуляцией водного электролита для повышения стабильности». Электрохимические коммуникации . 12 (12): 1686–1689. дои : 10.1016/j.elecom.2010.09.025 .
- ^ Jump up to: а б с д Кумар, Б.; Кумар, Дж.; Лиз, Р.; Феллнер, JP; Родригес, С.Дж.; Авраам, К.М. (2010). «Твердотельная перезаряжаемая литий-воздушная батарея с длительным сроком службы» . Журнал Электрохимического общества . 157 : А50. дои : 10.1149/1.3256129 . S2CID 92403112 .
- ^ Ван, Юнган (2010). «Литий-воздушная батарея, способная постоянно уменьшать содержание O2 в воздухе для производства энергии». Журнал источников энергии . 195 (1): 358–361. Бибкод : 2010JPS...195..358W . дои : 10.1016/j.jpowsour.2009.06.109 .
- ^ Jump up to: а б с д и Гиришкумар, Г.; Макклоски, Б.; Лунц, AC; Суонсон, С.; Вилке, В. (2010). «Литий-воздушная батарея: перспективы и проблемы». Журнал физической химии . 1 (14): 2193–2203. дои : 10.1021/jz1005384 .
- ^ Jump up to: а б с Авраам и Цзян, 1996 г.
- ^ Jump up to: а б с Лу и Амин 2013
- ^ Балаиш, Крайцберг и Эйн-Эли 2014 г.
- ^ Лу, Ли и др. 2014 год
- ^ Огасавара, Дебар и др. 2006 г.
- ^ Ли, Роев и др. 2015 год
- ^ Галлахер, КГ; Гебель, С; Греслер, Т; Матиас, М.; Олерих, В; Эроглу, Д. (2014). «Количественная оценка перспектив литий-воздушных батарей для электромобилей». Энергетика и экология . 7 (5): 1555–1563. дои : 10.1039/C3EE43870H .
- ^ Jump up to: а б Сюй, К. (2004). «Неводные жидкие электролиты для литиевых аккумуляторов». Химические обзоры . 104 (10): 4303–417. дои : 10.1021/cr030203g . ПМИД 15669157 .
- ^ Jump up to: а б с Макклоски и др. 2015 .
- ^ Jump up to: а б с д и Балаиш, Крайцберг и Эйн-Эли 2014 .
- ^ Jump up to: а б с д и Иманиши и др. 2014 .
- ^ Зима, М.; Бродд, Р.Дж. (2004). «Что такое батареи, топливные элементы и суперконденсаторы?» . Химические обзоры . 104 (10): 4245–4269. дои : 10.1021/cr020730k . ПМИД 15669155 .
- ^ Jump up to: а б с д и ж г Крайцберг, А.; Эйн-Эли, Ю. (2011). «Обзор литий-воздушных батарей - возможности, ограничения и перспективы». Журнал источников энергии . 196 (3): 886–893. Бибкод : 2011JPS...196..886K . дои : 10.1016/j.jpowsour.2010.09.031 .
- ^ Тикекар, Мукул Д.; Чоудхури, Снехашис; Ту, Чжэнъюань; Арчер, Линден А. (8 сентября 2016 г.). «Принципы проектирования электролитов и интерфейсов для стабильных литий-металлических батарей». Энергия природы . 1 (9): 16114. Бибкод : 2016NatEn...116114T . дои : 10.1038/nenergy.2016.114 . ISSN 2058-7546 . S2CID 138881114 .
- ^ Аурбах, Д. (2000). «Обзор избранных взаимодействий электрода и раствора, которые определяют характеристики литий-ионных и литий-ионных батарей». Журнал источников энергии . 89 (2): 206–218. Бибкод : 2000JPS....89..206A . дои : 10.1016/S0378-7753(00)00431-6 .
- ^ Уиттингем, MS (1976). «Хранение электрической энергии и химия интеркаляции». Наука . 192 (4244): 1126–1127. Бибкод : 1976Sci...192.1126W . дои : 10.1126/science.192.4244.1126 . ПМИД 17748676 . S2CID 36607505 .
- ^ Jump up to: а б с Ковальчик, И.; Рид, Дж.; Саломон, М. (2007). «Литий-воздушные батареи: классический пример ограничений из-за растворимости» . Чистая и прикладная химия . 79 (5): 851. doi : 10.1351/pac200779050851 . S2CID 98144813 .
- ^ Jump up to: а б Сингх, М.; Гур, И.; Бальсара, НП (2009). «Твердый электролитный материал, изготавливаемый методами обработки полимеров», заявка на патент США № 12271829.
- ^ Бейтс, Дж. (2000). «Тонкопленочные литиевые и литий-ионные аккумуляторы» . Ионика твердого тела (представленная рукопись). 135 (1–4): 33–37. дои : 10.1016/S0167-2738(00)00327-1 .
- ^ Виско, С.; Нимонм, Ю. (2010). «Активные металл/водные электрохимические элементы и системы», патент США № 7645543.
- ^ Новая энергия и топливо . 2011. По состоянию на 20 ноября 2011 г.
- ^ Эд. Юрген О. Безенхард, Справочник по материалам для аккумуляторов , New Your, Wiley-VCH, 1999, ISBN 3-527-29469-4 .
- ^ Авраам, К.М.; Цзян, З. (1996). «Литий-кислородная аккумуляторная батарея на основе полимерного электролита». Журнал Электрохимического общества . 143 (1): 1–5. Бибкод : 1996JElS..143....1A . дои : 10.1149/1.1836378 . S2CID 96810495 .
- ^ Андерсен, Чарльз П.; Ху, Хан; Цю, Банда; Калра, Вибха; Сунь, Ин (2015). «Модель переноса в масштабе пор, включающая катодную микроструктуру и рост пероксида в литий-воздушных батареях» . Дж. Электрохим. Соц . 162 (7): А1135–А1145. дои : 10.1149/2.0051507jes . S2CID 55640173 .
- ^ Jump up to: а б с Лу, И-Чун (2010). «Влияние катализаторов на напряжения разряда и заряда литий-кислородных аккумуляторов». Электрохимические и твердотельные буквы . 13 (6): А69. дои : 10.1149/1.3363047 . hdl : 1721.1/79694 . S2CID 16688473 .
- ^ Рид, Дж. (2002). «Характеристика литий-кислородной батареи с органическим электролитом» . Журнал Электрохимического общества . 149 (9): А1190–А1196. Бибкод : 2002JElS..149A1190R . дои : 10.1149/1.1498256 .
- ^ «Литий-воздушные батареи стали популярными благодаря большей долговечности и производительности» . gizmag.com . 15 ноября 2013 г.
- ^ О, Д.; Ци, Дж.; Лу, ЮК; Чжан, Ю.; Шао-Хорн, Ю.; Белчер, AM (2013). «Биологически усовершенствованная конструкция катода для увеличения емкости и срока службы литий-кислородных батарей» . Природные коммуникации . 4 : 2756. Бибкод : 2013NatCo...4.2756O . дои : 10.1038/ncomms3756 . ПМК 3930201 . ПМИД 24220635 .
- ^ Уиллифорд, RE; Чжан, JG (2009). «Конструкция воздушного электрода для длительной работы литий-воздушных батарей на высокой мощности» . Журнал источников энергии . 194 (2): 1164–1170. Бибкод : 2009JPS...194.1164W . дои : 10.1016/j.jpowsour.2009.06.005 .
- ^ Лю и др. 2016
- ^ Jump up to: а б Лу и Амин 2013 .
- ^ Ли, Сянлинь; Фагри, Амир (2012). «Оптимизация катодной структуры литий-воздушных аккумуляторов на основе двумерной переходной неизотермической модели». Журнал Электрохимического общества . 159 (10): А1747–А1754. дои : 10.1149/2.043210jes .
- ^ Jump up to: а б Чжай и др. 2015 .
- ^ Лу и др. 2016 .
- ^ Jump up to: а б Лу и др. 2010 .
- ^ Ши, Сюй и Чжао 2015 .
- ^ Виско и др. 2004 .
- ^ Деласи, Линда (19 ноября 2015 г.). «На пути к созданию практичной литий-воздушной батареи возникло еще больше препятствий» . www.gizmag.com . Проверено 3 декабря 2015 г.
- ^ Лю, Тао; Лескес, Михал; Ю, Ваньцзин; Мур, Эми Дж.; Чжоу, Лина; Бэйли, Пол М.; Ким, Гану; Грей, Клэр П. (30 октября 2015 г.). «Циклирование батарей Li-O2 посредством образования и разложения LiOH». Наука . 350 (6260): 530–533. arXiv : 1805.03042 . Бибкод : 2015Sci...350..530L . дои : 10.1126/science.aac7730 . ISSN 0036-8075 . ПМИД 26516278 . S2CID 8780402 .
- ^ «Новый дизайн указывает путь к «совершенной» батарее» . физ.орг . 29 октября 2015 года . Проверено 3 декабря 2015 г.
- ^ Кумар, Б.; Кумар, Дж. (2010). «Катоды для твердотельных литий-кислородных элементов: роль стеклокерамики Nasicon». Журнал Электрохимического общества . 157 (5): А611. дои : 10.1149/1.3356988 .
- ^ Ю. Ван, Моделирование образования разрядных отложений и его влияние на характеристики литий-воздушной батареи, Electrochimica Acta 75 (2012) 239–246.
- ^ Ю. Ван и С. К. Чо, Анализ характеристик воздушного катода для литий-воздушных батарей, Журнал Электрохимического общества, 160 (10) A1-A9 (2013).
- ^ Ю. Ван, З. Ван, Х. Юань и Т. Ли, Емкость хранения оксидов при разряде и потеря напряжения в литий-воздушной батарее, Electrochimica Acta, 180 (2015) 382–393
- ^ Чжан, Т.; Иманиши, Н.; Симониши, Ю.; Хирано, А.; Такеда, Ю.; Ямамото, О.; Сэммс, Н. (2010). «Новая перезаряжаемая литий-воздушная батарея высокой плотности энергии» . Химические коммуникации (представлена рукопись). 46 (10): 1661–1663. дои : 10.1039/b920012f . ПМИД 20177608 .
- ^ Чжэн, Юнпин; Сон, Кёнсе; Юнг, Чжепён; Ли, Чэньчжэ; Хо, Юн-Ук; Парк, Мин-Сик; Чо, Мэнхё; Канг, Ён-Мук; Чо, Кёнджэ (май 2015 г.). «Важный дескриптор рационального проектирования оксидных катализаторов в литий-оксидных аккумуляторах: поверхностная плотность кислорода». Химия материалов . 27 (9): 3243–3249. doi : 10.1021/acs.chemmater.5b00056 .
- ^ Даррен Квик (5 апреля 2010 г.). «Литий-воздушные батареи обеспечивают в три раза большую плотность энергии» . Проверено 5 октября 2011 г.
- ^ Симониши, Ю.; Чжан, Т.; Иманиши, Н.; Я, Д.; Ли, диджей; Хирано, А.; Такеда, Ю.; Ямамото, О.; Сэммс, Н. (2011). «Исследование литий-воздушных аккумуляторных батарей - стабильность твердого электролита, проводящего литий-ионы типа NASICON, в щелочных водных растворах». Журнал источников энергии . 196 (11): 5128–5132. Бибкод : 2011JPS...196.5128S . дои : 10.1016/j.jpowsour.2011.02.023 .
- ^ Яо, Сяхуэй; Дун, Ци; Ченг, Цинмэй; Ван, Дуньвэй (2016). «Почему выходят из строя литий-кислородные аккумуляторы: паразитные химические реакции и их синергетический эффект» . Angewandte Chemie, международное издание . 55 (38): 11344–11353. дои : 10.1002/anie.201601783 . ПМК 5113803 . ПМИД 27381169 .
- ^ Образование синглетного кислорода в процессе зарядки апротонной литий-кислородной батареи Дж. Вандт, П. Джейкс, Дж. Гранвер, Х. А. Гастайгер, Р.-А. Эйхель, Энджю. хим. Межд. Эд. 2016, 128, 7006–7009. {{doi: 10.1002/anie.201602142}}
- ^ Jump up to: а б Димберуон, Пениэль М. (28 октября 2014 г.). «Новая гибридная солнечная батарея решает проблему хранения энергии солнечной энергии» . Центр сингулярности . Проверено 17 декабря 2016 г.
- ^ Ю, М.; Рен, X.; Ма, Л.; Ву, Ю. (октябрь 2014 г.). «Интеграция сенсибилизированного красителем фотоэлектрода с окислительно-восстановительной связью в литий-кислородную батарею для фотоподзарядки» . Природные коммуникации . 5 (1): 5111. doi : 10.1038/ncomms6111 . ISSN 2041-1723 .
Цитируемые работы
[ редактировать ]- Балаиш, Моран; Крайцберг, Александр; Эйн-Эли, Яир (2014). «Критический обзор электролитов литий-воздушных аккумуляторов». Физическая химия Химическая физика . 16 (7): 2801. doi : 10.1039/C3CP54165G .
- Иманиси, Нобуюки; Мацуи, Масаки; Такеда, Ясуо; Ямамото, Осаму (2014). «Литий-ионопроводящие твердые электролиты для водных литий-воздушных батарей» . Электрохимия . 82 (11): 938–945. doi : 10.5796/электрохимия.82.938 .
- Лю, Бин; Сюй, Ву; Ян, Пэнфэй; Сунь, Сюлян; Боуден, Марк Э.; Читай, Джеффри; Цянь, Цзянфэн; Мэй, Дунхай; Ван, Чонг-Мин; Чжан, Цзи-Гуан (январь 2016 г.). «Повышение циклической стабильности перезаряжаемых Li–O 2 аккумуляторов с использованием электролитов высокой концентрации» . Передовые функциональные материалы . 26 (4): 605–613. дои : 10.1002/adfm.201503697 .
- Лу, Джун; Амин, Халил (18 ноября 2013 г.). «Последние результаты исследований неводных литий-воздушных батарей в Аргоннской национальной лаборатории» . Энергии . 6 (11): 6016–6044. дои : 10.3390/en6116016 .
- Лу, Джун; Юнг Ли, Юн; Ло, Сянъи; Чун Лау, Ка; Асади, Мохаммед; Ван, Сянь-Хау; Бромбош, Скотт; Вэнь, Цзяньго; Чжай, Дэнгюнь; Чен, Цзунхай; Миллер, Дин Дж.; Суб Чжон, Йо; Пак, Джин-Бом; Зак Фанг, Чжиган; Кумар, Биджандра; Салехи-Ходжин, Амин; Сун, Ян-Кук; Кертисс, Ларри А.; Амин, Халил (январь 2016 г.). «Литий-кислородная батарея на основе супероксида лития». Природа . 529 (7586): 377–382. дои : 10.1038/nature16484 .
- Лу, И-Чун; Сюй, Чжичуань; Гастайгер, Хуберт А.; Чен, Шуо; Хамад-Шифферли, Кимберли; Шао-Хорн, Ян (8 сентября 2010 г.). «Наночастицы платины и золота: высокоактивный бифункциональный электрокатализатор для литий-воздушных аккумуляторов». Журнал Американского химического общества . 132 (35): 12170–12171. дои : 10.1021/ja1036572 . hdl : 1721.1/65124 .
- Макклоски, Брайан Д.; Берк, Колин М.; Николс, Джессика Э.; Ренфрю, Сара Э. (2015). «Механистические идеи для разработки материалов для батарей Li–O 2: решение проблем с ограничениями проводимости Li 2 O 2 и нестабильностью электролита и катода». Химические коммуникации . 51 (64): 12701–12715. дои : 10.1039/C5CC04620C .
- Ши, Л.; Сюй, А.; Чжао, ТС (2015). «Образование наночастиц Li 3 O 4 в продуктах разряда неводных литий-кислородных аккумуляторов приводит к снижению перенапряжения заряда». Физическая химия Химическая физика . 17 (44): 29859–29866. дои : 10.1039/c5cp03886c .
- Виско, С.Дж.; Нимон, Э.; Кац, Б.; Чонхэ, ЖК; Чу, МОЙ (2004). Аннотация № 53 . Тезисы докладов 12-го Международного совещания по литиевым батареям. Нара, Япония.
- Чжай, Дэнъюн; Ван, Сянь-Хау; Миллер, Дин Дж.; Кан, Баохуа; Гао, Цзин, Эрнесто; «Межфазные эффекты на диспропорционирование супероксида лития в батареях Li-O 2». , 15 ( ): 1041–1046 2 Ларри А .; Амин, Халил (11 февраля 2015 г.) . .
Внешние ссылки
[ редактировать ]- Аргонн открывает главу в исследованиях аккумуляторов – литий-воздушный
- Передовые исследования в области аккумуляторов в Аргонне помогут заменить бензин
- Проект IBM Battery 500
- Компания по производству аккумуляторов ПолиПлюс
- Lithion, Inc. Конструкция литий-воздушной батареи
- Химики совершили прорыв на пути к созданию перезаряжаемой литий-кислородной батареи , Университет Ватерлоо
- Квазитвердотельный перезаряжаемый литий-кислородный аккумулятор на основе гелевого полимерного электролита с ионной жидкостью.
