Биохимические переключатели клеточного цикла
Ряд биохимических переключателей контролирует переходы между различными фазами клеточного цикла и внутри них . Клеточный цикл представляет собой серию сложных, упорядоченных и последовательных событий, которые контролируют деление одной клетки на две клетки, и включает в себя несколько различных фаз. Фазы включают фазы G1 и G2, репликацию ДНК или фазу S, а также сам процесс деления клеток, митоз или фазу M. [1] Во время фазы М хромосомы разделяются и происходит цитокинез.
Переключатели поддерживают упорядоченное развитие клеточного цикла и действуют как контрольные точки, гарантирующие правильное завершение каждой фазы перед переходом к следующей фазе. [1] Например, Cdk, или циклинзависимая киназа , является основным переключателем контроля клеточного цикла и позволяет клетке переходить от G1 к S или от G2 к M путем добавления фосфата к белковым субстратам. Было показано, что такие многокомпонентные (с участием нескольких взаимосвязанных белков) переключения вызывают решающие, устойчивые (и потенциально необратимые) переходы и вызывают стабильные колебания. [2] В результате они являются предметом активных исследований, направленных на то, чтобы понять, как такие сложные свойства связаны с системами биологического контроля. [3] [4] [5]
Петли обратной связи
[ редактировать ]
Многие биологические схемы производят сложные выходные данные, используя одну или несколько обратной связи петель . В последовательности биохимических событий обратная связь будет относиться к следующему элементу последовательности (B на соседнем изображении), влияющему на некоторый верхний компонент (A на соседнем изображении), чтобы повлиять на его собственное производство или активацию (выход) в будущем. Если этот элемент действует для увеличения собственной производительности, то он вызывает положительную обратную связь (синяя стрелка). Петля положительной обратной связи также известна как самоусиливающаяся петля, и возможно, что эти петли могут быть частью более крупной петли, поскольку это характерно для схем регулирования. [1]
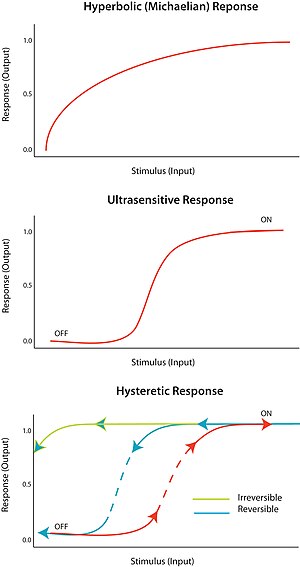
И наоборот, если этот элемент приводит к собственному торможению через вышестоящие элементы, это канонически отрицательная обратная связь (красная тупая стрелка). Петля отрицательной обратной связи также известна как балансирующая петля, и часто можно увидеть колебания, в которых задержанный сигнал отрицательной обратной связи используется для поддержания гомеостатического баланса в системе. [1]
Петли обратной связи могут использоваться для усиления (положительная) или самокоррекции (отрицательная). Правильная комбинация положительной и отрицательной обратной связи может обеспечить сверхчувствительность и бистабильность. [6] [7] что, в свою очередь, может порождать решающие переходы и колебания.
Сочетание циклов положительной и отрицательной обратной связи.
[ редактировать ]Петли положительной и отрицательной обратной связи не всегда работают четко. В механизме биохимических переключателей они работают вместе, создавая гибкую систему. Например, согласно Pfeuty & Kaneko (2009), чтобы преодолеть недостаток биохимических систем, петли регулирования с положительной обратной связью могут взаимодействовать с петлями отрицательной регуляции, чтобы облегчить выход из стабильных состояний. [8] Сосуществование двух стабильных состояний известно как бистабильность, которая часто является результатом регулирования положительной обратной связи.
Примером, показывающим взаимодействие множественных петель отрицательной и положительной обратной связи, является активация циклин-зависимых протеинкиназ, или Cdks14. Петли положительной обратной связи играют роль, переключая клетки с низкой на высокую активность Cdk. Взаимодействие между двумя типами петель проявляется в митозе. В то время как положительная обратная связь инициирует митоз, петля отрицательной обратной связи способствует инактивации циклин-зависимых киназ комплексом, способствующим анафазе. Этот пример ясно показывает совокупное влияние петель положительной и отрицательной обратной связи на регуляцию клеточного цикла.
сверхчувствительность
[ редактировать ]Реакция на раздражитель по принципу «все или ничего» называется сверхчувствительностью . Другими словами, очень небольшое изменение стимула вызывает очень большое изменение реакции, образуя сигмоидальную кривую «доза-реакция». Сверхчувствительный отклик описывается общим уравнением V = S н /(С н + K m ), известное как уравнение Хилла , когда n, коэффициент Хилла, больше 1. Крутизна сигмоидальной кривой зависит от значения n. Значение n = 1 дает гиперболический или михаэловский ответ. Сверхчувствительность достигается в различных системах; Ярким примером является кооперативное связывание фермента гемоглобина с его субстратом. Поскольку сверхчувствительная реакция является почти «цифровой», ее можно использовать для усиления реакции на стимул или для создания решительного резкого перехода (между состояниями «выключено» и «включено»).
Ультрачувствительность играет большую роль в регуляции клеточного цикла. Например, Cdk1 и Wee1 являются регуляторами митоза и способны инактивировать друг друга посредством ингибирующего фосфорилирования. Это представляет собой петлю двойной отрицательной обратной связи, в которой оба регулятора инактивируют друг друга. По данным Кима и др. (2007), должен существовать сверхчувствительный элемент для генерации бистабильного ответа. Оказывается, Wee1 имеет сверхчувствительный ответ на Cdk1, и это, вероятно, возникает из-за конкуренции субстратов между различными сайтами фосфорилирования на Wee1. [9]
Бистабильность
[ редактировать ]Бистабильность предполагает гистерезис, а гистерезис подразумевает мультистабильность. Мультистабильность указывает на наличие двух или более стабильных состояний для данного входа. Следовательно, бистабильность – это способность системы существовать в двух устойчивых состояниях. [10] Другими словами, существует диапазон значений стимула, для которого реакция может иметь два устойчивых значения. Бистабильность сопровождается гистерезисом , что означает, что система приближается к одному из двух устойчивых состояний преимущественно в зависимости от своей истории. Бистабильность требует обратной связи, а также сверхчувствительного элемента схемы.
При определенных обстоятельствах петли положительной и отрицательной обратной связи могут обеспечить условия для бистабильности; например, за счет наличия положительной обратной связи, связанной со сверхчувствительным ответным элементом схемы. Гистерезисная бистабильная система может действовать как надежный обратимый переключатель, поскольку системе труднее переходить между состояниями «включено» и «выключено» (по сравнению с эквивалентным моностабильным сверхчувствительным откликом). Система также может быть уравновешена так, что один из переходов физически недостижим; например, никакое уменьшение стимула не вернет систему в «выключенное» состояние, если она уже находится во «включенном» состоянии. Это создаст надежный необратимый переключатель. Как спроектировать простой биологический переключатель, описано в докладе конференции. [11]
Между топологией сети не существует однозначного соответствия, поскольку многие сети имеют схожие входные и выходные отношения. Топология сети не подразумевает ввод или вывод, и аналогично ввод или вывод не подразумевают топологию сети. Именно по этой причине параметризация очень важна для работы схемы. Если динамика входного сигнала сопоставима или быстрее, чем реакция системы, реакция может оказаться гистерезисной.
Ниже описаны три переключателя клеточного цикла, которые обеспечивают резкие и/или необратимые переходы за счет использования некоторых механизмов, описанных выше.
Переключатель G1/S
[ редактировать ]
Переход G1 /S , более известный как контрольная точка начала у почкующихся дрожжей (точка ограничения у других организмов), регулирует выполнение клеточного цикла. [1] В этой контрольной точке клетки либо останавливаются перед репликацией ДНК (из-за ограничения питательных веществ или сигнала феромонов), либо продлевают G1 (контроль размера), либо начинают репликацию и проходят остальную часть клеточного цикла. Регуляторная сеть G1/S или регулон у почкующихся дрожжей включает циклины G1 Cln1, Cln2 и Cln3, Cdc28 (Cdk1), факторы транскрипции SBF и MBF и ингибитор транскрипции Whi5 . [3] Cln3 взаимодействует с Cdk1, чтобы инициировать последовательность событий путем фосфорилирования большого количества мишеней, включая SBF, MBF и Whi5 . Фосфорилирование Whi5 приводит к его перемещению из ядра, не позволяя ему ингибировать SBF и MBF. Активные SBF/MBF управляют переходом G1/S, включая циклины B-типа и инициируя репликацию ДНК, образование почек и дупликацию тел веретена. Более того, SBF/MBF управляет экспрессией Cln1 и Cln2, которые также могут взаимодействовать с Cdk1, способствуя фосфорилированию его мишеней.
Первоначально считалось, что этот переключатель G1/S функционирует как линейная последовательность событий, начинающихся с Cln3 и заканчивающихся S-фазой. [12] Однако наблюдение, что любого из Clns было достаточно для активации регулона, указывает на то, что Cln1 и Cln2 могут быть способны задействовать положительную обратную связь для активации своей собственной транскрипции. Это приведет к постоянно ускоряющемуся циклу, который может действовать как необратимый бистабильный триггер. [2] Скотхайм и др. использовали измерения отдельных клеток на почкующихся дрожжах, чтобы показать, что эта положительная обратная связь действительно имеет место. [3] Небольшое количество Cln3 индуцирует экспрессию Cln1/2, а затем вступает в действие петля обратной связи, что приводит к быстрому и резкому выходу Whi5 из ядра и, следовательно, когерентной экспрессии генов регулона G1/S. В отсутствие когерентной экспрессии генов клеткам требуется больше времени для выхода из G1, а значительная часть даже останавливается перед S-фазой, что подчеркивает важность положительной обратной связи в усилении переключения G1/S.
Контрольная точка клеточного цикла G1/S контролирует переход эукариотических клеток из первой фазы разрыва, G1, в фазу синтеза ДНК, S. При этом переключении в клетках млекопитающих есть две киназы клеточного цикла, которые помогают контролировать контрольную точку: клетка циклинкиназы CDK4/6-циклин D и CDK2-циклин E. [1] Транскрипционный комплекс, включающий Rb и E2F, важен для контроля этой контрольной точки. В первой фазе разрыва репрессорный комплекс Rb-HDAC связывается с факторами транскрипции E2F-DP1, тем самым ингибируя нижестоящую транскрипцию. Фосфорилирование Rb с помощью CDK4/6 и CDK2 диссоциирует комплекс Rb-репрессор и служит переключателем включения/выключения клеточного цикла. Как только Rb фосфорилируется, транскрипционная активность E2F снимается. Это позволяет транскрипцию генов S-фазы, кодирующих белки, которые усиливают переключение фазы G1 на S-фазу.
Множество различных стимулов применяют контроль контрольных точек, включая TGFb, повреждение ДНК, контактное торможение, репликативное старение и удаление фактора роста. Первые четыре действуют, индуцируя членов семейств ингибиторов киназы клеточного цикла INK4 или Kip/Cip. TGFb ингибирует транскрипцию Cdc25A, фосфатазы, которая активирует киназы клеточного цикла, а удаление фактора роста активирует GSK3b, который фосфорилирует циклин D. Это приводит к его быстрому убиквитинированию. [13]
Переключатель G2/M
[ редактировать ]G2 начинается с помощью E2F-опосредованной транскрипции циклина А, который образует комплекс циклин А-Cdk2. Чтобы перейти к митозу, комплекс циклин B - Cdk1 фактор, способствующий М-фазе; Cdk1 также известен как Cdc2 у делящихся дрожжей и Cdc28 у почкующихся дрожжей) активируется Cdc25 , протеинфосфатазой (впервые обнаруженный как MPF или . [1] Когда начинается митоз, ядерная оболочка распадается, хромосомы конденсируются и становятся видимыми, и клетка готовится к делению. Активация циклина B-Cdk1 приводит к разрушению ядерной оболочки, что является характеристикой начала митоза. [1]
Комплекс циклин B-Cdk1 участвует в регуляторной цепи, в которой Cdk1 может фосфорилировать и активировать свой активатор Cdc25 (положительная обратная связь), а также фосфорилировать и инактивировать свой инактиватор, киназу Wee1 (двойная отрицательная обратная связь). [1] Эта схема может действовать как бистабильный триггер. [14] с одним стабильным устойчивым состоянием в G2 (Cdk1 и Cdc25 выключены, Wee1 включен) и вторым стабильным устойчивым состоянием в фазе M (Cdk1 и Cdc25 активны, Wee1 выключены). Однако сам Wee1 регулируется другими факторами, такими как Cdr2 .
Это было предложено и защищено Jin et al. [15] в серии экспериментов с клеточной линией человека HeLa в 1998 году выяснилось, что именно пространственное расположение циклина B внутри клетки инициирует митоз. Известно из предыдущих экспериментов как на клетках человека, так и на ооцитах морской звезды, Jin et al. резюмируем, что циклин B1 присутствует в цитоплазме в изобилии во время неделящихся фаз митоза, но обнаруживается в ядре в комплексе с Cdk1 непосредственно перед тем, как клетка вступает в митоз. Другие экспериментаторы показали, что клетки не будут делиться, если циклин B останется в цитоплазме. Чтобы дополнительно изучить влияние пространственного расположения циклина B на деление клеток и контроль цикла, Jin et al. пометил циклин B сигналом ядерной локализации (NLS), который удерживал бы циклин внутри ядра. Первоначально этот NLS-циклин B не вызывал ожидаемого эффекта ускоренного вступления в митоз. Этот результат обусловлен ингибированием, подробно описанным на рисунке ниже. Wee1, ингибитор комплекса циклин B-Cdk1, локализован в ядре и, вероятно, фосфорилирует циклин B NLS, что делает его неспособным действовать так, как предполагалось. Это предположение было подтверждено, когда Jin et al. использовали Cdc2AF, нефосфорилируемый мутант Cdk1, и наблюдали ускоренное вступление в деление клеток благодаря ядерной локализации циклина B. Следовательно, ядерная локализация циклина B необходима, но недостаточна для запуска деления клеток.
Исследуя регуляцию клеточного цикла, Jin et al. манипулировали клетками с целью оценить локализацию циклина B в клетках с повреждением ДНК. Благодаря сочетанию повреждения ДНК и ядерной локализации экзогенного циклина B они смогли определить, что клетки будут делиться даже при повреждении ДНК, если циклин B будет вынужден экспрессироваться в ядре. Это предполагает, что пространственная локализация циклина B может играть роль контрольной точки митоза. Если клетки в нормальных условиях не делятся, когда их генетическая информация повреждена, но вступают в митоз, если эндогенный циклин B экспрессируется в ядре, вполне вероятно, что транслокация циклина B в цитоплазму является механизмом, который предотвращает незрелый вход в митоз. Эта гипотеза была дополнительно подтверждена анализом Jin et al. клеток, остановленных в G2 из-за повреждения ДНК. В этих клетках Jin et al. наблюдали высокие уровни активности комплекса циклин B-Cdc2 в цитоплазме. Это подтверждает ранее упомянутую теорию, поскольку показывает, что Cdc2 может активировать циклин без немедленной транслокации в ядро. Кроме того, накопление комплексов циклин B-Cdk1 в цитоплазме клеток, которые не делятся из-за повреждения ДНК, подтверждает теорию о том, что именно ядерная локализация циклина B инициирует митотическое вступление.
Таким образом, пространственная локализация циклина B играет роль в вступлении в митоз. Транслокация циклина В из цитоплазмы в ядро необходима для деления клеток, но недостаточна, поскольку его ингибиторы не позволяют клетке преждевременно вступить в митоз. В дополнение к резервному ингибированию комплекса циклин B-Cdk1, преждевременное деление клеток предотвращается за счет транслокации самого циклина B. Комплекс циклин B-Cdk1 будет оставаться в цитоплазме в клетках с повреждением ДНК, а не перемещаться в ядро, не позволяя клетке вступить в митоз. Следующий вопрос, который решают исследователи в этой области, заключается в том, каким именно механизмом регулируется эта транслокация.
Сантос и др. [16] предположили, что транслокация циклина B регулируется механизмом положительной обратной связи, аналогичным тому, который регулирует активацию комплекса циклин B-Cdk1. Они полагали, что петля положительной обратной связи включает фосфорилирование циклина B и его транслокацию в ядро. Чтобы начать исследовать это, они сначала подтвердили некоторые результаты Jin et al. эксперименты с использованием иммунофлуоресценции для выявления циклина B в цитоплазме перед делением и транслокацией в ядро для инициации митоза, которые они реализовали путем сравнения с разрушением ядерной оболочки (NEB). Используя ядерный циклин, который не может быть инактивирован Wee1 или Myt1, Santos et al. наблюдали, что активный ядерный циклин привлекает больше циклина из цитоплазмы для транспортировки в ядро. Они подтвердили это наблюдение, применив лечение рапамицином iRap. iRap индуцирует транслокацию меченого циклина B из цитоплазмы в ядро. Примечательно, что Сантос и др. увидели, что немеченый циклин B мигрировал вместе с циклином B под влиянием iRap. Немеченый циклин нечувствителен к лечению и движется независимо от обработанного циклина. Это подтверждает первую часть петли положительной обратной связи, заключающуюся в том, что ядерная локализация циклина B, которая приводит к входу в митоз, способствует усилению транслокации цитоплазматического циклина B в ядро, дополнительно способствуя миграции оставшегося цитоплазматического циклина B в ядро и т. д.
Сантос и др. далее выдвинули гипотезу, что фосфорилирование циклина B является еще одним компонентом петли положительной обратной связи. Они заметили, что циклин B естественным образом попадает в ядро раньше NEB. Напротив, мутированный, нефосфорилируемый циклин B попадает в ядро во время NEB. Это неожиданно, поскольку для клеточного цикла характерно перемещение циклина в ядро до NEB, чтобы индуцировать переход клеточного цикла в митотическое деление. Таким образом, Сантос и др. пришли к выводу, что фосфорилирование циклина B способствует транслокации в ядро. Однако, кроме того, транслокация в ядро способствует фосфорилированию циклина. Авторы отмечают, что фосфорилирование циклина В в ядре в девятнадцать раз более благоприятно, чем в цитоплазме, из-за меньшего общего объема ядра, что обеспечивает более высокую скорость фосфорилирования. Повышенная транслокация из-за фосфорилирования и повышенное фосфорилирование из-за транслокации иллюстрируют петлю положительной обратной связи, которая напоминает обнаруженную ранее, которая активирует комплекс циклин B-Cdk1.
В заключение, ядерная локализация циклина B необходима для вступления клеток в митоз. Транслокация циклина из цитоплазмы в ядро, обеспечивающая клеточное деление, регулируется петлей положительной обратной связи. Активный циклин B перемещается в ядро и способствует активации и перемещению дополнительных единиц циклина, находящихся в ядре. Это явление усиливается при рассмотрении фосфорилирования. Фосфорилирование циклина B способствует транслокации в ядро, а циклин B в ядре с гораздо большей вероятностью будет фосфорилирован, поэтому ядерная локализация в свою очередь способствует фосфорилированию циклина B.
Когда клетки находятся в митозе, циклин B-Cdk1 активирует комплекс, способствующий анафазе (APC), который, в свою очередь, инактивирует циклин B-Cdk1 путем разрушения циклина B, что в конечном итоге приводит к выходу из митоза. Соединение бистабильной функции ответа Cdk1 с отрицательной обратной связью от APC может создать так называемый генератор релаксации . [4] с резкими всплесками активности Cdk1, запускающими устойчивые митотические циклы. Однако в релаксационном генераторе управляющий параметр медленно перемещается относительно динамики ответа системы, что может быть точным представлением входа в митотический процесс, но не обязательно выхода из митоза.
Для выхода из митотической стадии клеточного цикла необходимо инактивировать комплекс циклин B-Cdk1. Затем клетки могут вернуться к первой фазе промежутка G1 и подождать, пока цикл не продолжится снова.

В 2003 году Померенинг и др. предоставили убедительные доказательства этой гипотезы, продемонстрировав гистерезис и бистабильность активации Cdk1 в цитоплазматических экстрактах ооцитов Xenopus . [4] Сначала они продемонстрировали прерывистую резкую реакцию Cdk1 на изменение концентрации неразрушаемого циклина B (чтобы отделить сеть ответа Cdk1 от APC-опосредованной отрицательной обратной связи). Однако такой ответ будет соответствовать как моностабильному сверхчувствительному переходу, так и бистабильному переходу. Чтобы различить эти две возможности, они измерили стабильные уровни активного Cdk1 в ответ на изменение уровней циклина, но в двух отдельных экспериментах: один начинался с интерфазного экстракта, а другой начинался с экстракта, уже находящегося в митозе. При промежуточных концентрациях циклина они обнаружили две стационарные концентрации активного Cdk1. Какое из двух устойчивых состояний было занято, зависело от истории системы, т. е. начинались ли они с интерфазы или с митотического экстракта, эффективно демонстрируя гистерезис и бистабильность.
В том же году Ша и др. [17] независимо пришли к такому же выводу, обнаружив гистерезисную петлю также при использовании экстрактов яиц Xenopus laevis. В этой статье были проверены три предсказания модели Новака-Тайсона с целью прийти к выводу, что гистерезис является движущей силой «переходов клеточного цикла в митоз и из него». Предсказания модели Новака-Тайсона являются общими для всех бифуркаций седло-узла. Бифуркации седло-узел — чрезвычайно полезные бифуркации в несовершенном мире, поскольку они помогают описывать несовершенные биологические системы. Первое предсказание заключалось в том, что пороговая концентрация циклина для вступления в митоз выше, чем пороговая концентрация циклина для выхода из митоза, и это было подтверждено добавлением циклических экстрактов яиц неразлагаемым циклином B и измерением порога активации и инактивации после добавления. циклогексимида (ЦГХ), который является ингибитором синтеза белка. [1] Кроме того, подтвердилось и второе предсказание модели Новака-Тайсона: нереплицированная дезоксирибонуклеиновая кислота, или ДНК, увеличивает пороговую концентрацию циклина, необходимую для вступления в митоз. Чтобы прийти к такому выводу, к экстрактам, высвобождающим цитостатический фактор, добавляли CHX, APH (ингибитор ДНК-полимеразы) или и то, и другое, а также добавляли неразлагаемый циклин B. Третье и последнее предсказание, которое было проверено и подтверждено в этой статье, заключалось в том, что скорость активации Cdc2 замедляется вблизи пороговой концентрации циклина. Эти прогнозы и эксперименты демонстрируют поведение переключения, подобное переключателю, которое можно описать гистерезисом в динамической системе. [18]
Переключение метафаза-анафаза
[ редактировать ]При переходе от метафазы к анафазе решающее значение имеет правильное и одновременное разделение сестринских хроматид к противоположным концам клетки. [1] Разделение сестринских хроматид изначально сильно ингибируется, чтобы предотвратить преждевременное разделение в позднем митозе, но это ингибирование снимается за счет разрушения ингибирующих элементов комплексом, способствующим анафазе (APC), как только достигается биориентация сестринских хроматид. Одним из этих ингибирующих элементов является секурин , который предотвращает разрушение когезина , комплекса, который удерживает сестринские хроматиды вместе, путем связывания протеазы сепаразы , которая нацелена на Scc1 , субъединицу комплекса когезина, для разрушения. В этой системе фосфатаза Cdc14 может удалять ингибирующий фосфат из секурина, тем самым способствуя разрушению секурина APC, высвобождая сепаразу. Как показали Ульманн и др., во время прикрепления хромосом к митотическому веретену хроматиды остаются парными, поскольку сцепление между сестрами предотвращает разделение. [9] [19] Сплоченность устанавливается во время репликации ДНК и зависит от когезина, который представляет собой мультисубъединичный комплекс, состоящий из Scc1, Scc3, Smc2 и Smc3. У дрожжей при переходе из метафазы в анафазу Scc1 диссоциирует от хромосом и отделяются сестринские хроматиды. Это действие контролируется белком Esp1, который прочно связан с ингибитором анафазы Pds1, разрушаемым комплексом, способствующим анафазе. Чтобы проверить, что Esp1 действительно играет роль в регуляции ассоциации хромосом Scc1, клеточные штаммы арестовывали в G1 с помощью альфа-фактора. Эти клетки оставались арестованными во время разработки. Использовали мутантные клетки Esp1-1 и эксперимент повторили, и Scc1 успешно связался с хромосомами и остался ассоциированным даже после прекращения синтеза. Это имело решающее значение для демонстрации того, что с помощью Esp1 способность Scc1 быть стабильно связанной с хромосомами во время G1 ограничена, и Esp1 фактически может непосредственно удалять Scc1 из хромосом.
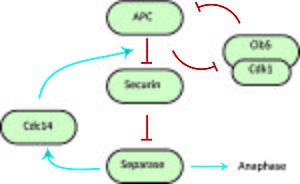
Это было показано Холтом и др. [5] эта сепараза активирует Cdc14, который, в свою очередь, действует на секурин, создавая таким образом петлю положительной обратной связи, которая увеличивает резкость перехода от метафазы к анафазе и координацию разделения сестринских хроматид. [5] Холт и др. исследовали основу эффекта положительной обратной связи при фосфорилировании секурина, используя мутантные штаммы «секурин» дрожжей, и проверив, как изменения в фосфорегуляции секурина влияют на синхронность разделения сестринских хроматид. Их результаты показывают, что вмешательство в эту положительную петлю секурин-сепараза-cdc14 снижает синхронность разделения сестринских хроматид. Эта положительная обратная связь гипотетически может вызвать бистабильность при переходе в анафазу, заставляя клетку принять необратимое решение разделить сестринские хроматиды.
Митотический выход
[ редактировать ]Выход из митоза является важной переходной точкой, которая означает окончание митоза и начало новой фазы G1 для клетки, и клетке необходимо полагаться на определенные механизмы контроля, чтобы гарантировать, что после выхода из митоза она никогда не вернется в митоз до тех пор, пока не прошли фазы G1, S и G2 и прошли все необходимые контрольные точки. Многие факторы, включая циклины , циклин-зависимые киназы (CDK), убиквитинлигазы , ингибиторы циклин-зависимых киназ и обратимое фосфорилирование , регулируют выход из митоза, чтобы гарантировать, что события клеточного цикла происходят в правильном порядке с наименьшим количеством ошибок. [20] Завершение митоза характеризуется разрушением веретена, укорочением кинетохорных микротрубочек и выраженным разрастанием астральных (некинетохорных) микротрубочек. [21] Для нормальной эукариотической клетки выход из митоза необратим. [22]
Протеолитическая деградация
[ редактировать ]
Было высказано множество предположений относительно механизмов контроля, используемых клеткой для обеспечения необратимости выхода из митоза в модельном эукариотическом организме, почкующихся дрожжах Saccharomyces cerevisiae . Протеолитическая деградация регуляторов клеточного цикла и соответствующее влияние на уровни циклин-зависимых киназ были предложены в качестве механизма, который способствует развитию эукариотического клеточного цикла и, в частности, перехода из метафазы в анафазу.Согласно этой теории, комплекс, способствующий анафазе (APC), класс убиквитинлигазы, облегчает деградацию митотических циклинов (Clb2) и факторов, ингибирующих анафазу (PDS1, CUT2), способствуя выходу из митоза. [23] APC убиквитинирует мотив из девяти аминокислот, известный как блок разрушения (D-бокс) в NH2-концевом домене митотических циклинов для деградации протеасомой. [23] APC в сочетании с Cdc20 (APC-Cdc20) убиквитинирует и нацеливает митотические циклины (Clb2) на деградацию на начальной фазе. В то же время APC-Cdc20 опосредует деградацию секуринов, которые ингибируют сепаразы посредством связывания, в начале анафазы. Высвобожденная и активная сепараза расщепляет когезин, который удерживает сестринские хроматиды вместе, облегчая разделение сестринских хроматид и инициируя выход из митоза, способствуя высвобождению Cdc14 из ядрышка. [24] [25] На более поздней фазе снижение регуляции Cdk1 и активация Cdc14, фосфатазы, активирующей Cdh1, способствуют образованию APC в сочетании с Cdh1 (APC-Cdh1) для деградации Clb2. [22] Cdc20 и Cdh1, которые являются активаторами APC, привлекают субстраты, такие как секурин и циклины B-типа (Clb), для убиквитинирования. [26] Без комплексов Cdk1-Clb2 для фосфорилирования белков, которые участвуют в динамике веретена, таких как Sli15, Ase1 и Ask1 , происходит удлинение веретена и сегрегация хромосом, что облегчает выход из митоза. [22] Важность протеолитической деградации в эукариотическом клеточном цикле изменила представление о делении клеток как о простом киназном каскаде на более сложный процесс, в котором необходимы взаимодействия между фосфорилированием, убиквитинированием и протеолизом. [23] Однако эксперименты с использованием почкующихся дрожжевых клеток с cdc28-as1, аллелем Cdk, чувствительным к INM-PP1 (аналог АТФ), доказали, что разрушение циклинов B-типа (Clb) не является необходимым для запуска необратимого выхода из митоза. [22] Деградация Clb2 действительно сокращает период ингибирования Cdk1, необходимый для запуска необратимого выхода из митоза, что указывает на то, что протеолиз циклина способствует динамическому характеру эукариотического клеточного цикла из-за более медленного времени его действия, но вряд ли является основным определяющим фактором в запуске необратимого клеточного цикла. переходы. [22]
уровни Sic1
[ редактировать ]Были сделаны открытия, указывающие на важность уровня ингибиторов циклинзависимых киназ в регуляции клеточного цикла эукариот. В частности, было показано, что уровень Sic1 , стехиометрического ингибитора комплексов Clb-CDK у почкующихся дрожжей, особенно важен при необратимом переходе G1-S за счет необратимой активации киназ S-фазы. [27] Было показано, что уровень Sic1 играет важную роль в запуске необратимого выхода из митоза (переход M-G1), а также в переходе G1-S. Во время митоза снижение уровня Cdk1 приводит к активации Cdc14, фосфатазы, которая противодействует Cdk1 посредством активации Cdh1 и Swi5, активатора транскрипции белков Sic1. [28] В то время как деградация Sic1 до определенного низкого уровня запускает начало S-фазы, накопление Sic1 до определенного высокого уровня необходимо для запуска необратимого выхода из митоза. [22] Ингибиторы Cdk1 могут индуцировать выход из митоза, даже если деградация циклинов B-типа блокируется экспрессией неразлагаемых Clbs или ингибиторов протеасом. Однако сестринские хроматиды не смогли сегрегировать, и клетки вернулись к митозу после вымывания ингибиторов, что указывает на то, что необходимо достичь порогового уровня ингибиторов, чтобы вызвать необратимый выход из митоза независимо от деградации циклинов. [29] Несмотря на разные пороговые значения уровня Sic1, необходимые для запуска выхода из митоза по сравнению с переходом G1-S, было показано, что уровень Sic1 играет ключевую роль в регуляции цикла эукариотических клеток путем ингибирования активности CDK.
Динамический системный подход
[ редактировать ]
Поскольку эукариотический клеточный цикл включает в себя множество белков и регуляторных взаимодействий, можно использовать подход динамических систем для упрощения сложной биологической схемы до общей структуры для лучшего анализа. [30] [31] Среди четырех возможных отношений ввода/вывода, отношения между уровнем Sic1 и митотическим выходом, по-видимому, демонстрируют характеристики необратимого бистабильного переключения, управляемого обратной связью между APC-Cdh1, Sic1 и Clb2-Cdk1. [22] бистабильность контролирует биологические функции, такие как контроль клеточного цикла и клеточная дифференцировка, и играет ключевую роль во многих клеточных регуляторных сетях. Известно, что [32] Бистабильные отношения ввода/вывода характеризуются двумя устойчивыми состояниями с двумя точками бифуркации. Для одного конкретного входа возможны несколько выходов в области бистабильности, отмеченной двумя точками бифуркации. Кроме того, бистабильная связь отображает гистерезис: конечное состояние/выход зависит от истории ввода, а также от текущего значения ввода, поскольку система имеет память. [30] Одна точка бифуркации имеет отрицательное значение параметра управления (точка бифуркации находится по другую сторону оси), что приводит к разрыву связи между двумя устойчивыми состояниями и необратимости перехода из одного состояния в другое. Что касается выхода из митоза, два стабильных состояния определяются митозом и фазой G1. Как только уровень Sic1 (вход) накапливается выше порогового значения, происходит необратимый переход от митоза (стабильное состояние I) к фазе G1 (стабильное состояние II).В несовершенной среде единственная бифуркация, которая остается нетронутой, — это бифуркация седло-узел . Бифуркация седло-узел не нарушается (седло-узел — это ожидаемое общее поведение), тогда как транскритические и вилочные бифуркации разрушаются при наличии несовершенств. [33] Таким образом, единственная одномерная бифуркация, которая может существовать в несовершенном биологическом мире, — это седло-узловая бифуркация. [30] Бистабильную связь между переходом M-G1 и уровнем Sic1 можно представить в виде схемы двух седло-узловых бифуркаций, в которых поведение системы качественно меняется при небольшом изменении управляющего параметра - количества Sic1.
Обратная связь на системном уровне
[ редактировать ]
Поскольку поведение клеточного цикла критически зависит от количества Sic1 в переходном состоянии M-G1, количество Sic1 жестко регулируется обратными связями на системном уровне. Поскольку Cdk1-Clb2 ингибирует Sic1 путем фосфорилирования Sic1 и делает Sic1 доступным для деградации посредством убиквитилирования, APC-Cdh1-зависимая деградация Cdk1-Clb2 не только снижает уровень доступных комплексов Cdk1-Clb2, но также увеличивает уровень Sic1, что, в свою очередь, еще больше снижает уровень доступных комплексов Cdk1-Clb2. ингибирует функцию Cdk1-Clb2. [28] Эта активация петли двойной отрицательной обратной связи инициируется APC-Cdc20-зависимой деградацией Cdk1-Clb2 и высвобождением Cdc14 из ядрышкового белка Net1/Cfi1. [34] Путь FEAR (раннее анафазное высвобождение Cdc14) облегчает Clb2-Cdk1-зависимое фосфорилирование Net1, которое временно высвобождает Cdc14 из Net1. [35] Высвобожденные комплексы Cdc14 и Clb2-Cdk1 образуют веретена, которые активируют сеть митотического выхода (MEN). MEN обеспечивает устойчивое высвобождение Cdc14 из ядрышка, [35] и Cdc14 противодействует активности Clb2-Cdk1 путем активации Cdh1 и стабилизации Sic1 посредством активации Sic1-активатора транскрипции Swi5. [36] Sic1 положительно регулирует себя, ингибируя Cdk1-Clb2, чтобы снять ингибирование Swi5, а Cdh1 также положительно регулирует себя, ингибируя Clb2-Cdk1, чтобы снять ингибирование MEN, которое может активировать Cdc14, а затем и сам Cdh1. Петля двойной отрицательной обратной связи, образованная APC-Cdh1 и Sic1, необходима для поддержания низкой активности Clb2-Cdk1, поскольку Clb2 автоактивирует свой синтез путем активации транскрипционных факторов, Fkh2- Mcm1 Ndd1. комплекса [28]
Подразумеваемое
[ редактировать ]Цикл эукариотической клетки состоит из различных контрольных точек и петель обратной связи, обеспечивающих правильное и успешное деление клеток. Например, во время митоза, когда дублированные хромосомы неправильно прикреплены к митотическому веретену, белки контрольной точки сборки веретена (SAC), включая Mad и Bub, ингибируют APC-Cdc20, чтобы задержать вход в анафазу и деградацию циклина B-типа. Кроме того, когда митотические веретена смещены, MEN и, следовательно, Cdc14 ингибируются Bub2 и Bfa1-зависимым образом, чтобы предотвратить деградацию митотических циклинов и вход в анафазу. [36] Sic1 — хороший пример, демонстрирующий, как обратные связи на системном уровне взаимодействуют, определяя условия окружающей среды и запуская переходы клеточного цикла. Несмотря на то, что фактический переход M-G1 чрезвычайно сложен и включает в себя множество белков и регуляций, подход динамических систем позволяет упростить эту сложную систему до бистабильного соотношения вход/выход с двумя бифуркациями седловидного узла, в которых выход (митотический выход) зависит от критической концентрации. из Sic1. Используя одномерный анализ, возможно, удастся объяснить многие необратимые точки перехода в клеточном цикле эукариот, которые управляются контролем и обратной связью на системном уровне. Другие примеры необратимых точек перехода включают Start (необратимое начало нового цикла клеточного деления), который можно объяснить необратимым бистабильным переключателем, контрольный параметр которого жестко регулируется системными обратными связями с участием Cln2, Whi5 и SBF. [37]
Соответствующая информация
[ редактировать ]- Cdc25
- Клеточная биология
- Клеточный цикл
- Контрольная точка клеточного цикла
- Математическая модель клеточного цикла
- Митоз
- Контрольная точка шпинделя
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г час я дж к Морган Д. (2006), Клеточный цикл: принципы контроля, OUP/New Science Press
- ^ Jump up to: а б Сантос, СДМ; Феррелл, Дж. Э. (2008), «О клеточном цикле и его переключателях», Nature , 454 (7202): 288–9, Bibcode : 2008Natur.454..288S , doi : 10.1038/454288a , PMC 2727670 , PMID 18633407
- ^ Jump up to: а б с Скотхайм, Дж. М.; Ди Талия, С.; Сиггия, Эд; Кросс, Франция (2008), «Положительная обратная связь циклинов G1 обеспечивает согласованное вступление в клеточный цикл», Nature , 454 (7202): 291–6, Bibcode : 2008Natur.454..291S , doi : 10.1038/nature07118 , PMC 2606905 , PMID 18633409
- ^ Jump up to: а б с Померенинг-младший; Зонтаг ЭД; и др. (2003). «Построение осциллятора клеточного цикла: гистерезис и бистабильность при активации Cdc2». Nat Cell Biol . 5 (4): 346–351. дои : 10.1038/ncb954 . ПМИД 12629549 . S2CID 11047458 .
- ^ Jump up to: а б с Холт Л.Дж.; Кручинский А.Н.; и др. (2008). «Положительная обратная связь обостряет переключатель анафазы» . Природа . 454 (7202): 353–357. Бибкод : 2008Natur.454..353H . дои : 10.1038/nature07050 . ПМЦ 2636747 . ПМИД 18552837 .
- ^ Феррелл, Дж. Э. (2008), «Регуляция противоположных ферментов с помощью обратной связи генерирует надежные, бистабильные ответы по принципу «все или ничего»» (PDF) , Current Biology , 18 (6): 244–245, doi : 10.1016/j.cub.2008.02. 035 , PMC 2832910 , PMID 18364225 , заархивировано из оригинала (PDF) 22 октября 2012 г. , получено 11 декабря 2009 г.
- ^ Анджели, Д.; Феррелл, Дж. Э.; Зонтаг, Эд (2004), «Обнаружение мультистабильности, бифуркаций и гистерезиса в большом классе биологических систем с положительной обратной связью», Труды Национальной академии наук , 101 (7): 1822–7, Бибкод : 2004PNAS..101.1822 А , doi : 10.1073/pnas.0308265100 , PMC 357011 , PMID 14766974
- ^ Пфеуты Б.; Канеко К. (2009). «Сочетание положительной и отрицательной обратной связи придает биохимическим переключателям исключительную гибкость». Физ. Биол . 046013 (4): 1–11. Бибкод : 2009PhBio...6d6013P . дои : 10.1088/1478-3975/6/4/046013 . hdl : 20.500.12210/35259 . ПМИД 19910671 . S2CID 7144154 .
- ^ Jump up to: а б Ким С.Ю.; Феррелл Дж. Э. (2007). «Субстратная конкуренция как источник сверхчувствительности при активации Wee1» . Клетка . 128 (6): 1133–45. дои : 10.1016/j.cell.2007.01.039 . ПМИД 17382882 .
- ^ Строгац С.Х. (1994), Нелинейная динамика и хаос, издательство Perseus Books Publishing
- ^ Кет Хинг Чонг; Сандхья Самарасингхе; Дон Куласири и Цзе Чжэн (2015). «Вычислительные методы математического моделирования биологических переключателей». Модсим2015 : 578–584. https://dr.ntu.edu.sg/handle/10356/83213
- ^ Стюарт, Д.; Виттенберг, К. (1995), «CLN3, а не положительная обратная связь, определяет время транскрипции CLN2 в циклических клетках». (PDF) , Genes & Development , 9 (22): 2780–94, doi : 10.1101/gad.9.22.2780 , PMID 7590253 , получено 11 декабря 2009 г.
- ^ Харпер Дж.В. (март 2002 г.). «Переключатель убиквитинирования, управляемый фосфорилированием, для контроля клеточного цикла». Тенденции клеточной биологии . 12 (3): 104–7. дои : 10.1016/S0962-8924(01)02238-3 . ПМИД 11859016 .
- ^ Новак, Б.; Тайсон, Дж. Дж. (1993), «Численный анализ комплексной модели контроля М-фазы в экстрактах ооцитов Xenopus и интактных эмбрионах» (PDF) , Journal of Cell Science , 106 (4): 1153–68, doi : 10.1242/jcs .106.4.1153 , PMID 8126097 , получено 11 декабря 2009 г.
- ^ Джин, Пей (18 мая 1998 г.). «Ядерная локализация циклина B1 контролирует вход в митоз после повреждения ДНК» . Журнал клеточной биологии . 141 (4): 875–885. дои : 10.1083/jcb.141.4.875 . ПМК 2132764 . ПМИД 9585407 .
- ^ Сантос, Сильвия (22 июня 2012 г.). «Пространственная положительная обратная связь в начале митоза» . Клетка . 149 (7): 1500–1513. дои : 10.1016/j.cell.2012.05.028 . ПМЦ 3395376 . ПМИД 22726437 .
- ^ Ша, В.; Мур, Дж.; Чен, К.; Лассалетта, AD; Йи, CS; Тайсон, Джей-Джей ; Сибл, Дж. К. (2003), «Гистерез управляет переходами клеточного цикла в экстрактах яиц Xenopus laevis», Proceedings of the National Academy of Sciences , 100 (3): 975–80, Bibcode : 2003PNAS..100..975S , doi : 10.1073/pnas.0235349100 , PMC 298711 , PMID 12509509
- ^ Купер, Г. (2000), «Клетка: молекулярный подход», получено 21 ноября 2010 г.
- ^ Ульманн Ф.; Лотспайх Ф.; Нэсмит К. (1999). «Разделению сестринских хроматид в начале анафазы способствует расщепление субъединицы сцепления Scc1». Природа . 400 (6739): 37–42. Бибкод : 1999Natur.400...37U . дои : 10.1038/21831 . ПМИД 10403247 . S2CID 4354549 .
- ^ Эрих А. Нигг (2005). «Циклин-зависимые протеинкиназы: ключевые регуляторы эукариотического клеточного цикла». Биоэссе . 17 (6): 471–480. doi : 10.1002/bies.950170603 . ПМИД 7575488 . S2CID 44307473 .
- ^ Митоз # Цитокинез
- ^ Jump up to: а б с д и ж г Сандра Лопес-Авиле; Орсоля Капуй; Бела Новак; Франк Ульманн (2009). «Необратимость выхода из митоза является следствием обратной связи на системном уровне» . Письма о природе . 459 (7246): 592–595. Бибкод : 2009Natur.459..592L . дои : 10.1038/nature07984 . ПМЦ 2817895 . ПМИД 19387440 .
- ^ Jump up to: а б с Рэндалл В. Кинг; Раймонд Дж. Деше; Ян-Майкл Петерс; Марк В. Киршнер (1996). «Как протеолиз управляет клеточным циклом». Наука . 274 (5293): 1652–1659. Бибкод : 1996Sci...274.1652K . дои : 10.1126/science.274.5293.1652 . ПМИД 8939846 . S2CID 25369228 .
- ^ И. Вайценеггер; Дж.Ф. Хименес-Абиан; Д. Верник; ДжМ. Питерс (2002). «Регуляция сепаразы человека путем связывания секурина и авторасщепления» . Современная биология . 12 (16): 1368–1378. дои : 10.1016/S0960-9822(02)01073-4 . ПМИД 12194817 .
- ^ Мэтт Салливан; Франк Ульманн (2003). «Непротеолитическая функция сепаразы связывает начало анафазы с выходом из митоза» . Nat Cell Biol . 5 (3): 249–254. дои : 10.1038/ncb940 . ПМК 2610357 . ПМИД 12598903 .
- ^ Розелла Висинтин; Сюзанна Принц; Анжелика Амон (1997). «CDC20 и CDH1: семейство субстрат-специфичных активаторов APC-зависимого протеолиза». Наука . 278 (5337): 460–463. Бибкод : 1997Sci...278..460В . дои : 10.1126/science.278.5337.460 . ПМИД 9334304 .
- ^ Стивен И. Рид (2003). «Храповики и часы: клеточный цикл, убиквитилирование и оборот белка». Nature Reviews Молекулярно-клеточная биология . 4 (11): 855–864. дои : 10.1038/nrm1246 . ПМИД 14625536 . S2CID 8330242 .
- ^ Jump up to: а б с ПК Винод; Паула Фрейре; Ахмед Раттани; Андреа Силиберто; Франк Ульманн и Бела Новак (2011). «Вычислительное моделирование выхода из митоза у почкующихся дрожжей: роль сепаразы и эндоциклов Cdc14» . JR Soc. Интерфейс . 8 (61): 1128–1141. дои : 10.1098/rsif.2010.0649 . ПМК 3119881 . ПМИД 21288956 .
- ^ Тамара Александровна Потапова; Джон Р. Даум; Брэдли Д. Питтман; Джоанна Р. Хадсон; Тара Н. Джонс; Дэвид Л. Сатиновер; П. Тодд Стукенберг и Гэри Дж. Горбски (2006). «Обратимость выхода митоза в клетках позвоночных» . Письма о природе . 440 (7086): 954–958. Бибкод : 2006Natur.440..954P . дои : 10.1038/nature04652 . ПМЦ 1513549 . ПМИД 16612388 .
- ^ Jump up to: а б с Строгац, Стивен Х, изд. (1994). «Глава 2 и 3». Нелинейная динамика и хаос: с приложениями к физике, биологии, химии и технике . Книги Персея.
- ^ Джон Дж. Тайсон ; Аттила Чикаш-Надь и Бела Новак (2002). «Динамика регуляции клеточного цикла» . Биоэссе 24 (12): 1095–1109. дои : 10.1002/bies.10191 . ПМИД 12447975 .
- ^ Дэн Сигал-Гаскинс; Мария Кэтрин Мехия-Гуэрра; Грегори Д. Смит; Эрих Гротеволд (2011). «Появление переключающего поведения в большом семействе простых биохимических сетей» . PLOS Вычислительная биология . 7 (5): 1–12. arXiv : 1104.2845 . Бибкод : 2011PLSCB...7E2039S . дои : 10.1371/journal.pcbi.1002039 . ПМЦ 3093349 . ПМИД 21589886 .
- ^ Кроуфорд, Джон (1991). «Введение в теорию бифуркаций». Обзоры современной физики . 63 (4): 991–1037. Бибкод : 1991РвМП...63..991С . дои : 10.1103/revmodphys.63.991 . hdl : 2152/61063 .
- ^ Висинтин Р., Хван Э.С., Амон А. (1999). «Cfi1 предотвращает преждевременный выход из митоза, закрепляя фосфатазу Cdc14 в ядрышке». Природа . 398 (6730): 818–823. Бибкод : 1999Natur.398..818V . дои : 10.1038/19775 . ПМИД 10235265 . S2CID 4344363 .
- ^ Jump up to: а б А. Линдквист; В. ван Зон; Розенталь К. Карлссон; РМ. Вольтуис (2007). «Активация циклина B1 – Cdk1 продолжается после разделения центросом для контроля митотической прогрессии» . ПЛОС Биология . 5 (5): 1127–1137. doi : 10.1371/journal.pbio.0050123 . ПМК 1858714 . ПМИД 17472438 .
- ^ Jump up to: а б Джоанна Блум; Фредерик Р. Кросс (2007). «Множественные уровни специфичности циклина в контроле клеточного цикла». Nature Reviews Молекулярно-клеточная биология . 8 (2): 149–160. дои : 10.1038/nrm2105 . ПМИД 17245415 . S2CID 7923048 .
- ^ Чарвин Г., Ойконому С., Сиггиа Э.Д., Кросс ФР (2010). «Происхождение необратимости начала клеточного цикла у почкующихся дрожжей» . ПЛОС Биология . 8 (1): 1–13. дои : 10.1371/journal.pbio.1000284 . ПМЦ 2797597 . ПМИД 20087409 .