Термодинамический и кинетический контроль реакции

Термодинамический контроль реакции или кинетический контроль реакции в химической реакции может определять состав смеси продуктов реакции, когда конкурирующие пути приводят к различным продуктам, а условия реакции влияют на селективность или стереоселективность . Это различие актуально, когда продукт A образуется быстрее, чем продукт B, поскольку энергия активации продукта A ниже, чем у продукта B , но продукт B более стабилен. В таком случае A является кинетическим продуктом и ему отдается предпочтение при кинетическом контроле, а B представляет собой термодинамический продукт и ему отдается предпочтение при термодинамическом контроле. [1] [2] [3]
Условия реакции, такие как температура, давление или растворитель, влияют на то, какой путь реакции может быть предпочтительным: либо кинетически контролируемый, либо термодинамически контролируемый. Обратите внимание, что это верно только в том случае, если энергия активации двух путей различается, причем один путь имеет более низкую E a ( энергию активации ), чем другой.
Преобладание термодинамического или кинетического контроля определяет окончательный состав продукта, когда эти конкурирующие пути реакции приводят к различным продуктам. Условия реакции, как упомянуто выше, влияют на селективность реакции, т.е. на выбор пути.
Асимметричный синтез - это область, в которой особенно важно различие между кинетическим и термодинамическим контролем. Поскольку пары энантиомеров по сути имеют одинаковую свободную энергию Гиббса, термодинамический контроль приведет к образованию рацемической смеси неизбежно . Таким образом, любая каталитическая реакция, которая дает продукт с ненулевым энантиомерным избытком, находится под, по крайней мере, частичным кинетическим контролем. (Во многих стехиометрических асимметричных превращениях энантиомерные продукты фактически образуются в виде комплекса с источником хиральности перед стадией обработки реакции, что технически делает реакцию диастереоселективной. Хотя такие реакции обычно все еще контролируются кинетически, термодинамический контроль, по крайней мере, важен. в принципе возможно)
Объем
[ редактировать ]В реакциях Дильса-Альдера
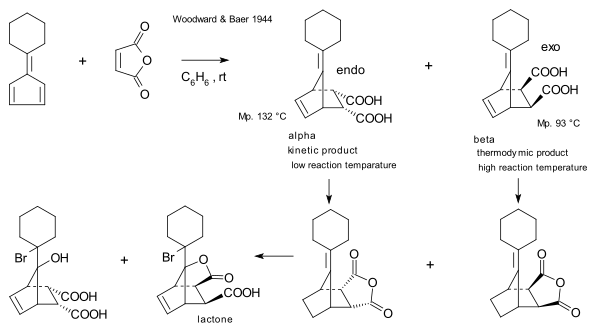
[ редактировать ]Дильса -Альдера циклопентадиена фураном с Реакция может давать два изомерных продукта. При комнатной температуре менее стабильный эндо-изомер 2 преобладает кинетический контроль реакции, и основным продуктом реакции является . При 81 °C и после длительного времени реакции химическое равновесие может утвердиться и термодинамически более стабильный экзоизомер 1 . образуется [4] Экзо - продукт более стабилен благодаря более низкой степени стерического застоя , тогда как эндо- продукту благоприятствует перекрытие орбиталей в переходном состоянии .

выдающийся и очень редкий пример полного кинетического и термодинамического контроля реакции в процессе тандемной меж- /внутримолекулярной реакции Дильса–Альдера бисфурилдиенов 3 с гексафтор-2-бутином или диметилацетилендикарбоксилатом Обнаружен (ДМАД) и описано в 2018 году. [5] [6] При низкой температуре реакции протекают хемоселективно, приводя исключительно к аддуктам клещевого-[4+2]-циклоприсоединения ( 5 ). Исключительное образование домино -аддуктов ( 6 ) наблюдается при повышенных температурах.

теоретические DFT-расчеты реакции гексафтор-2-бутина с диенами 3a – c Проведены . Реакция, начинающаяся с [4+2]-циклоприсоединения CF 3 C≡CCF 3 по одному из фурановых фрагментов, протекает согласованно через TS1 и представляет собой лимитирующую стадию всего процесса с активационным барьером Δ G. ‡ ≈ 23,1–26,8 ккал/моль.
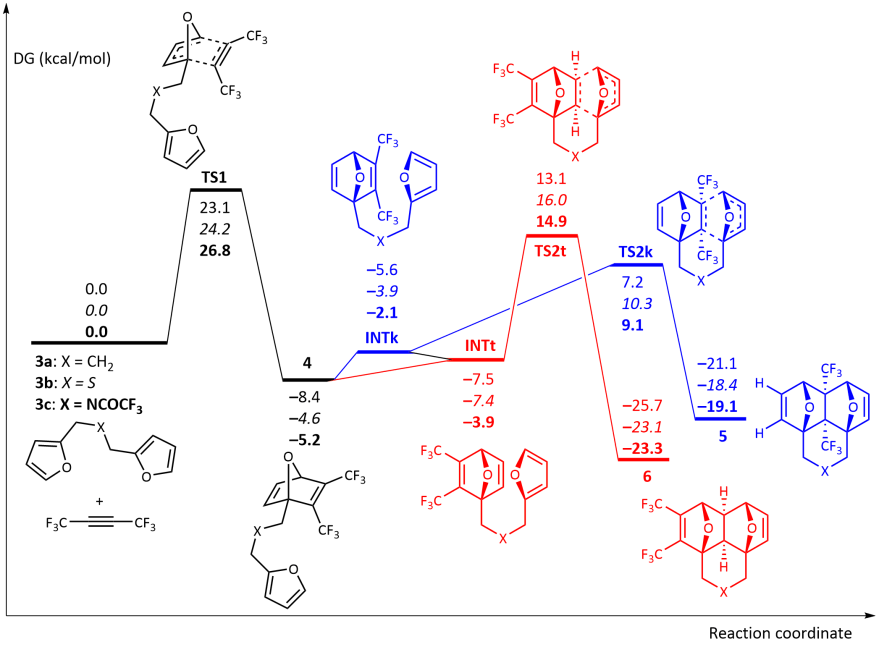
Кроме того, реакция может протекать по двум конкурирующим каналам, т.е. либо приводя к образованию продуктов типа клещей 5 через TS2k , либо приводя к образованию домино-продукта 6 через TS2t . Расчеты показали, что первый канал кинетически более выгоден (Δ G ‡ ≈ 5,7–5,9 ккал/моль). Между тем, продукты домино 6 термодинамически более стабильны, чем 5 (Δ G ‡ ≈ 4,2-4,7 ккал/моль), что может вызвать изомеризацию 5 в 6 при повышенной температуре. Действительно, рассчитанные барьеры активации 5 → 6 изомеризации по ретро-реакции Дильса–Альдера 5 с последующим внутримолекулярным [4+2]-циклоприсоединением в интермедиате цепи 4 с образованием 6 составляют 34,0–34,4 ккал/моль.
В енолятной химии
[ редактировать ]При протонировании енолят -иона кинетическим продуктом является енол , а термодинамическим продуктом — кетон или альдегид . Карбонильные соединения и их енолы быстро обмениваются информацией за счет переноса протонов , катализируемого кислотами или основаниями , даже в следовых количествах, в данном случае при посредничестве енолята или источника протонов.
При депротонировании несимметричного кетона кинетическим продуктом является енолят, образующийся в результате удаления наиболее доступного α-H, в то время как термодинамический продукт имеет более сильно замещенный енолятный фрагмент. [7] [8] [9] [10] Использование низких температур и стерически требовательных оснований повышает кинетическую селективность. Здесь разница в p K b между основанием и енолятом настолько велика, что реакция по существу необратима, поэтому равновесие, приводящее к термодинамическому продукту, вероятно, является протонным обменом, происходящим во время присоединения между кинетическим енолятом и пока еще непрореагировавший кетон. Обратное добавление (добавление кетона к основе) с быстрым перемешиванием позволит свести это к минимуму. Положение равновесия будет зависеть от противокатиона и растворителя.

Если использовать гораздо более слабое основание, депротонирование будет неполным и между реагентами и продуктами будет равновесие. Термодинамический контроль достигается, однако реакция остается незавершенной, если енолят продукта не улавливается, как в примере ниже. Поскольку перенос H происходит очень быстро, а реакция захвата медленнее, соотношение захваченных продуктов в значительной степени отражает равновесие депротонирования.

В электрофильных добавках
[ редактировать ]Реакция электрофильного присоединения бромистого водорода к 1,3-бутадиену при температуре выше комнатной приводит преимущественно к термодинамически более стабильному 1,4-аддукту, 1-бром-2-бутену, но снижение температуры реакции до температуры ниже комнатной благоприятствует кинетике 1, 2-аддукт, 3-бром-1-бутен. [3]

- Обоснование различной селективности следующее: оба продукта возникают в результате протонирования Марковникова в положении 1, что приводит к образованию резонансно -стабилизированного аллильного катиона. Аддукт 1,4 помещает больший атом Br в менее перегруженное место и включает более сильно замещенный алкеновый фрагмент, тогда как аддукт 1,2 является результатом атаки нуклеофила (Br − ) у углерода аллильного катиона, несущего наибольший положительный заряд (наиболее вероятное место для положительного заряда — более высокозамещенный углерод).

Характеристики
[ редактировать ]- В принципе, каждая реакция находится на континууме между чистым кинетическим контролем и чистым термодинамическим контролем. Эти термины относятся к данной температуре и временному масштабу. Процесс приближается к чисто кинетическому контролю при низкой температуре и коротком времени реакции. В течение достаточно длительного периода времени каждая реакция приближается к чистому термодинамическому контролю, по крайней мере, в принципе. [11] [12] Этот временной масштаб становится короче по мере повышения температуры.
- В каждой реакции первым образуется тот продукт, который образуется легче всего. Таким образом, каждая реакция априори начинается под кинетическим контролем. [13]
- Необходимым условием термодинамического контроля является обратимость или механизм, позволяющий уравновешивать продукты. Считается, что реакции протекают под термодинамическим контролем реакции, когда обратная реакция протекает достаточно быстро, чтобы равновесие установилось в течение отведенного времени реакции. Таким образом, всегда отдается предпочтение термодинамически более стабильному продукту.
- При кинетическом контроле реакции одна или обе прямые реакции, ведущие к возможным продуктам, происходят значительно быстрее, чем установление равновесия между продуктами. После времени реакции t соотношение продуктов представляет собой соотношение констант скорости k и, таким образом, является функцией разницы энергий активации E a или Δ G. ‡ :
- (уравнение 1)
- Если не предотвратить достижение равновесия (например, путем удаления продукта из реакционной смеси сразу после его образования), «чистый» кинетический контроль, строго говоря, невозможен, поскольку некоторая степень равновесия произойдет до того, как реагенты полностью израсходуются. На практике многие системы хорошо приближены к работающим под кинетическим контролем из-за пренебрежимо медленного установления равновесия. Например, многие энантиоселективные каталитические системы дают почти энантиочистый продукт (> 99% ее), даже несмотря на то, что энантиомерные продукты имеют одинаковую свободную энергию Гиббса и одинаково предпочтительны с термодинамической точки зрения.
- При чисто термодинамическом контроле реакции, когда равновесие достигнуто, распределение продуктов будет функцией стабильности G °. После бесконечного времени реакции соотношение концентраций продуктов будет равно константе равновесия K eq и, следовательно, будет функцией разности свободных энергий Гиббса ,
- (уравнение 2)
- В принципе, «чистый» термодинамический контроль также невозможен, поскольку равновесие достигается только после бесконечного времени реакции. На практике, если A и B взаимопревращаются с общими константами скорости и kr ) или примерно пяти , t большинства практических целей изменение состава становится незначительным после ~ 3,5/( kf + то для kr kf периодов полураспада. а соотношение продуктов системы можно рассматривать как результат термодинамического контроля.
- В целом, короткое время реакции благоприятствует кинетическому контролю, тогда как более длительное время реакции способствует термодинамическому контролю реакции. Низкие температуры повысят селективность в обоих случаях, поскольку в обоих случаях T находится в знаменателе. Идеальной температурой для оптимизации выхода наиболее быстро образующегося продукта будет самая низкая температура, которая обеспечит завершение реакции за разумный промежуток времени. [14] Идеальная температура для реакции под термодинамическим контролем — это самая низкая температура, при которой равновесие будет достигнуто за разумный промежуток времени. [15] При необходимости селективность можно повысить путем медленного охлаждения реакционной смеси, чтобы еще больше сместить равновесие в сторону наиболее стабильного продукта. Когда разница в стабильности продукта очень велика, термодинамически контролируемый продукт может доминировать даже в относительно жестких условиях реакции.
- Если реакция находится под термодинамическим контролем при данной температуре, она будет находиться под термодинамическим контролем и при более высокой температуре в течение того же времени реакции.
- Точно так же, если реакция находится под кинетическим контролем при данной температуре, она также будет находиться под кинетическим контролем при любой более низкой температуре в течение того же времени реакции.
- Если предположить, что новая реакция априори будет находиться под кинетическим контролем, то можно обнаружить наличие механизма равновесия (и, следовательно, возможность термодинамического контроля), если распределение продуктов:
- меняется с течением времени,
- показывает, что один продукт доминирует при одной температуре, в то время как другой доминирует при другой температуре (инверсия доминирования), или
- изменяется с температурой, но не соответствует уравнению 1, то есть изменение температуры (без изменения времени реакции) вызывает изменение соотношения продуктов это больше или меньше, чем можно было бы ожидать, исходя только из изменения температуры, если предположить, что в значительной степени инвариантен к температуре в умеренном температурном диапазоне. [16]
- Таким же образом можно обнаружить возможность кинетического управления, если изменение температуры вызывает изменение соотношения продуктов, не согласующееся с уравнением 2, полагая, что в значительной степени инвариантен к температуре в умеренном температурном диапазоне. [17]
История
[ редактировать ]Первыми, кто сообщил о взаимосвязи между кинетическим и термодинамическим контролем, были Р.Б. Вудворд и Гарольд Бэр в 1944 году. [18] Они повторно исследовали реакцию между малеиновым ангидридом и фульвеном, о которой впервые сообщили в 1929 году Отто Дильс и Курт Алдер . [19] Они заметили, что, хотя эндо-изомер образуется быстрее, более длительное время реакции, а также относительно повышенные температуры приводят к более высоким соотношениям экзо/эндо, что необходимо учитывать в свете замечательной стабильности экзосоединения с одной стороны. с другой стороны и очень легкая диссоциация эндо-изомера.
К. К. Ингольд вместе с Э. Д. Хьюзом и Дж. Кэтчполом независимо друг от друга описали термодинамическую и кинетическую модель управления реакцией в 1948 году. [20] Они повторно исследовали определенную аллильную перегруппировку, о которой в 1930 году сообщил Якоб Мейзенхаймер . [21] Было обнаружено, что сольволиз гамма-фенилаллилхлорида с AcOK в уксусной кислоте дает смесь гамма- и альфа-ацетата, причем последний превращается в первый путем уравновешивания. Это было интерпретировано как случай из области анионотропии явления, известного в прототропии, различия между кинетическим и термодинамическим контролем при ионной рекомбинации .
Ссылки
[ редактировать ]- ^ Органическая химия, 3-е изд., М. А. Фокс и Дж. К. Уайтселл, Джонс и Бартлетт, 2004 г. ISBN 0-7637-2197-2
- ^ Путеводитель по механизмам в органической химии, 6-е издание, Питер Сайкс, Пирсон Прентис Холл, 1986. ISBN 0-582-44695-3
- ^ Jump up to: а б Введение в органическую химию I, Сет Роберт Эльшеймер, Blackwell Publishing, 2000 г. ISBN 0-632-04417-9
- ^ Продвинутая органическая химия, часть A: Структура и механизмы, 5-е изд., Фрэнсис А. Кэри, Ричард Дж. Сундберг, 2007 г. ISBN 978-0-387-44899-2
- ^ Ксения К. Борисова, Елизавета А. Квятковская, Евгения В. Никитина, Ринат Р. Айсин, Роман А. Новиков и Федор И. Зубков. «Классический пример полного кинетического и термодинамического контроля. Реакция Дильса-Альдера между DMAD и бисфурилдиеном». Дж. Орг. Хим., 2018, 83 (8), стр. 4840-4850. doi:10.1021/acs.joc.8b00336 https://pubs.acs.org/doi/abs/10.1021/acs.joc.8b00336
- ^ Kseniya K. Borisova, Eugeniya V. Nikitina, Roman A. Novikov, Victor N. Khrustalev, Pavel V. Dorovatovskii, Yan V. Zubavichus, Maxim L. Kuznetsov, Vladimir P. Zaytsev, Alexey V. Varlamov and Fedor I. Zubkov. “Diels–Alder reactions between hexafluoro-2-butyne and bis-furyl dienes: kinetic versus thermodynamic control.” Chem. Commun., 2018, 54, pp 2850-2853. doi:10.1039/c7cc09466c http://pubs.rsc.org/en/content/articlelanding/2018/cc/c7cc09466c#!divAbstract
- ^ Термодинамический продукт против кинетического продукта
- ^ Жан д'Анджело, Отчет о тетраэдре № 25: Еноляты кетонов: региоспецифическое приготовление и синтетическое использование , Тетраэдр, том 32, выпуск 24, 1976, страницы 2979-2990, ISSN 0040-4020 , дои : 10.1016/0040-4020(76)80156-1
- ^ Химия карбанионов. IX. Еноляты калия и лития, полученные из циклических кетонов Герберт О. Хаус, Барри М. Трост J. Org. Хим., 1965, 30 (5), стр. 1341–1348. два : 10.1021/jo01016a001
- ^ Химия карбанионов. XV. Стереохимия алкилирования 4-трет-бутилциклогексанона Герберт О. Хаус, Бен А. Тефертиллер, Хью Д. Олмстед Дж. Орг. Chem., 1968, 33 (3), стр. 935–942. дои : 10.1021/jo01267a002
- ^ Хопаде, Тушар; Мете, Тримбак; Арора, Джьотсна; Бхат, Рамакришна (2018). «Неблагоприятное влияние более высокой загрузки катализатора и более длительного времени реакции на энантиоселективность в органокаталитической многокомпонентной реакции». Химия: Европейский журнал . 24 (23): 6036–6040. дои : 10.1002/chem.201800278 . ПМИД 29465758 .
- ^ Рулли, Джузеппе; Дуангди, Нонгнафат; Баер, Катрин; Хаммель, Вернер; Беркессель, Альбрехт; Грегер, Харальд (2011). «Направление кинетического и термодинамически контролируемого органокатализа и его применение в химиоферментативном синтезе» . Angewandte Chemie, международное издание . 50 (34): 7944–7947. дои : 10.1002/anie.201008042 . ПМИД 21744441 . S2CID 42971817 .
- ^ Это неправда, только если последующее уравновешивание происходит так же быстро или быстрее.
- ^ Если не довольствоваться неполной реакцией, может потребоваться отделение продукта от непрореагировавшего исходного материала.
- ^ В худшем случае K eq будет приближаться к 1 по мере увеличения T , а доля наиболее стабильного продукта будет стремиться к 50% реакционной смеси.
- ^ будет зависеть от температуры или почти не зависит от температуры, если мала, что было бы в том случае, если бы этапы, определяющие скорость, ведущие к каждому продукту, имели одинаковую молекулярность , например, если бы оба включали столкновения с одним и тем же реагентом.
- ^ будет зависеть от температуры или почти не зависит от температуры, если мала, что было бы в том случае, если бы общие превращения каждого продукта имели одинаковую молекулярность , например, если бы оба были фрагментациями молекулы с образованием пары молекул или если бы оба были конденсацией двух молекул с образованием одной молекулы.
- ^ Исследования реакций присоединения диена. II.1 Реакция 6,6-пентаметиленфульвена с малеиновым ангидридом Р.Б. Вудворд, Гарольд Баер Дж. Ам. хим. Сок., 1944, 66 (4), стр. 645–649. два : 10.1021/ja01232a042
- ^ Дильс О. и Алдер К. (1929), синтезы в гидроароматической серии, IV. Сообщение: О добавлении малеинового ангидрида к арилированным диенам, триенам и фульвенам (под редакцией Пола Приса). Отчеты Немецкого химического общества (серии A и B), 62: 2081–2087. два : 10.1002/cber.19290620829
- ^ Перегруппировка и замещение в анионотропных системах. Часть III. Механизм и равновесие при анионотропных изменениях А.Г. Кэтчпол, Э.Д. Хьюз и К.К. Ингольд J. Chem. Сок., 1948, 8-17. дои : 10.1039/JR9480000008
- ^ Майзенхаймер Дж. и Линк Дж. (1930), О сдвиге аллильной группы. 3. Уведомление о замене и дополнении . «Анналы химии» Юстуса Либиха, 479: 211–277. два : 10.1002/jlac.19304790114
![{\displaystyle \ln \left({\frac {[A]_{t}}{[B]_{t}}}\right)=\ln \left({\frac {k_{A}}{k_ {B}}}\right)=-{\frac {\Delta E_{a}}{RT}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d3c4abce8554f016a84af1e7dad83761b5dd71d7)
![{\ displaystyle \ ln \ left ({\ frac {[A] _ {\ infty } {[B] _ {\ infty }}} \ right) = \ ln \ K_ {eq} = - {\ frac {\ Дельта G^{\circ }}{RT}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fe18ae931f200f667234f9ff8c2033ba94c98205)
![{\displaystyle {[A]_{t}}/{[B]_{t}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6e66460d660f8572d9b47c3943b17e49c35a4048)