Тиострептон

| |
| Имена | |
|---|---|
| Название ИЮПАК
N-[3-[(3-амино-3-оксопроп-1-ен-2-ил)амино]-3-оксопроп-1-ен-2-ил]-2-[(1R,8S,11Z,18S ,25S,26R,53S,59S)-37-бутан-2-ил-18-[(2S,3R)-2,3-дигидрокси бутан-2-ил]-11-этилиден-59-гидрокси-8-[(1R)-1-гидроксиэтил]-31-[(1S)-1-гидроксиэтил]-26,40,46-триметил-43-метилиден -6,9,16,23,28,38,4 1,44,47-нонаоксо-27-окса-3,13,20,56-тетратия-7,10,17,24,36,39,42,45,48,52,58,61,62,63, 64-пентадеказанонацикло[23.23.9.329,35.12,5.112,15.1 19,22.154,57.01,53.032,60]тетрагексаконта-2(64),4,12(63),19(62),21,29(61),30,32(60),33,51,54,57 -додекаен-51-ил]-1,3-тиазол-4-карбоксамид
| |
| Другие имена
Аланинамид, Бриамицин, Тиактин
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| КЭБ | |
| ХЭМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.014.304 |
| Номер ЕС |
|
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 72 Ч 85 Н 19 О 18 С 5 | |
| Молярная масса | 1664.83 g/mol |
| Появление | Порошок от белого до почти белого цвета |
| Температура плавления | От 246 до 256 ° C (от 475 до 493 ° F; от 519 до 529 К) |
| нерастворимый | |
| Растворимость в других растворителях | Растворим в CHCl 3 , CH 2 Cl 2 , диоксане, пиридине, ледяной уксусной кислоте, ДМФ. Практически нерастворим в низших спиртах, неполярных органических растворителях, разбавленных водных кислотах и основаниях. Может растворяться метанольной кислотой или основанием, но с разложением. [ 2 ] |
| Опасности | |
| СГС Маркировка : | |

| |
| Предупреждение | |
| H302 | |
| П264 , П270 , П301+П312 , П330 , П501 | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Тиострептон — природный циклический олигопептидный антибиотик класса тиопептидов , полученный из нескольких штаммов стрептомицетов , таких как Streptomyces azureus и Streptomyces laurentii . Тиострептон – природный продукт класса рибосомально синтезируемых и посттрансляционно модифицированных пептидов (RiPP).
История
[ редактировать ]Тиострептон был открыт Доновиком и др. который описал его антибактериальные свойства в 1955 году. [ 3 ] Дороти Кроуфут Ходжкин раскрыла структуру тиострептона в 1970 году. [ 4 ] В начале 1978 года Байкрофт и Гоуленд [ 5 ] предложил биосинтез тиострептона, который был неясен до 2009 года. Несколько исследований биосинтеза тиопептидов [ 6 ] [ 7 ] [ 8 ] [ 9 ] были одновременно опубликованы в 2009 году, и два из них (Ляо и др. и Келли и др. ) включали аналогичный биосинтез тиострептона: он синтезируется рибосомами из генов биосинтеза тиострептона (генов tsr), и необходима посттрансляционная модификация. [ нужна ссылка ]
Полный синтез тиострептона был завершен Николау К.С. и др. в 2004 году. [ 10 ] [ 11 ]
Приложения
[ редактировать ]Тиострептон применяется в ветеринарии при мастите, вызванном грамотрицательными микроорганизмами, и при дерматологических заболеваниях. Чаще всего он используется в комплексных мазях, содержащих неомицин , нистатин , тиострептон и стероиды местного применения . Он также активен в отношении грамположительных бактерий. Примечательно, что мази для человеческого применения содержат неомицин , нистатин и стероиды для местного применения , но не содержат тиострептон. [ нужна ссылка ]
Сообщалось (в 2008 г.), что тиострептон проявляет активность против клеток рака молочной железы путем воздействия на транскрипционный фактор forkhead box M1 ( FOXM1 ), [ 12 ] также в 2011 году. [ 13 ] Также было показано, что он предотвращает приобретенную резистентность к цисплатину в клетках рака молочной железы в условиях in vitro . [ 14 ]
Тиострептон используется в молекулярной биологии в качестве реагента как для положительной, так и для отрицательной селекции генов, участвующих в метаболизме нуклеотидов. [ нужна ссылка ]
Тиострептон также показал многообещающие результаты при лечении остеопороза на животных моделях, поскольку он может ингибировать необычные клетки-предшественники остеокластов. [ 15 ]
Антибиотик тиострептон был идентифицирован как резистентность к инсулину средство, обращающее . Последующая проверка на ex vivo и инсулинорезистентных мышечных трубочках, индуцированных пальмитатом, продемонстрировала мощное восстановление действия инсулина, возможно, за счет усиления регуляции гликолиза из-за ослабления митохондриального окислительного фосфорилирования тиострептоном. инсулинорезистентных мышцах мышей [ 16 ]
Биосинтез
[ редактировать ]Всего в кластере биосинтетических генов имеется 21 ген (tsrA~tsrU). Предшественник тиострептона содержит 58 аминокислот в пептидной цепи, которая включает 41 аминокислотный лидерный пептид (LP) и 17 аминокислотный структурный пептид (IASASCTTCICTCSCSS). После синтеза предшественника циклодегидратаза tsrO и дегидрогеназа tsrM катализируют образование тиазола или тиазолина из каждого остатка цистеина в пептидной цепи. После образования тиазола/тиазолина дегидратазы tsrJ, K и S преобразуют все остатки серина в дегидроаланин. Гетероциклизация Дильса-Альдера центрального дегидропиперидина (по S5, C13 и S14) была предложена Байкрофтом еще в 1978 году и использована в химическом синтезе этой основной структуры Николау и др. в 2005 году. Альтернативный механизм образования дегидропиперидина также был предложен Kelly et al . в 2009 году. Тем не менее, на основании экспериментальных данных предполагается, что tsrN и L несут ответственность за гетероциклизацию Дильса-Альдера. Предполагается, что фрагмент хинальдиновой кислоты синтезируется девятью генами tsrFAEBDUPQI из триптофана и затем приводит к замыканию макроцикла хинальдиновой кислоты. Наконец, tsrR служит кандидатом на окисление остатка Ile с образованием тиострептона. [ нужна ссылка ]
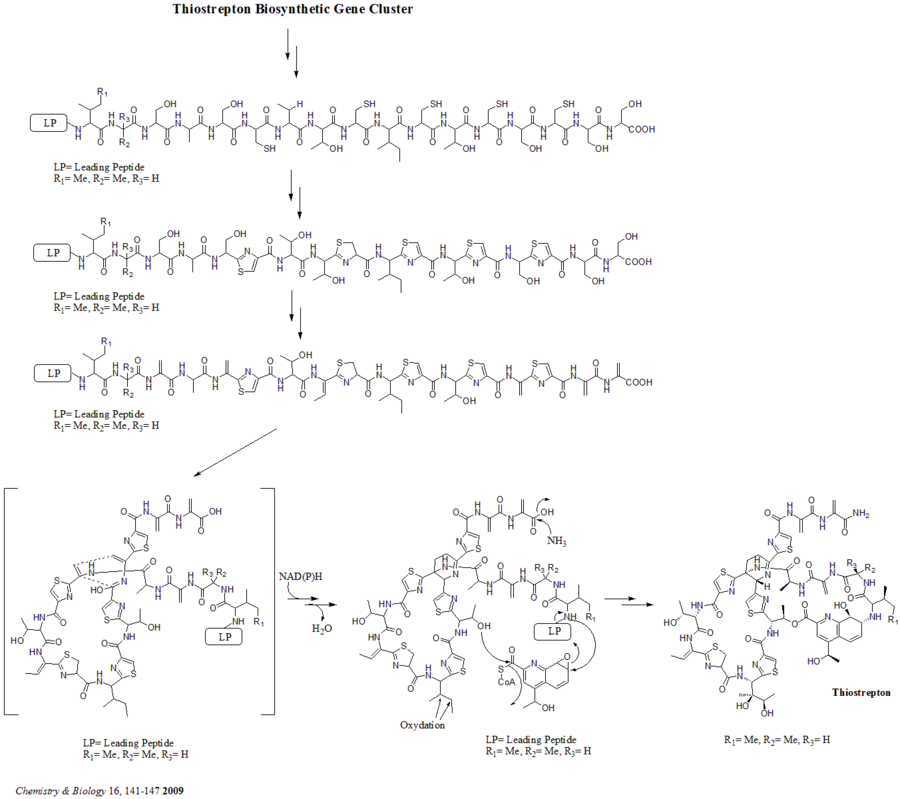
Альтернативный механизм образования дегидропиперидинового ядра
[ редактировать ]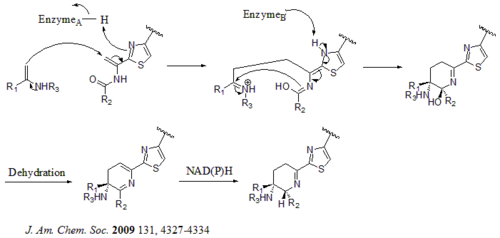
Полный синтез
[ редактировать ]В 2005 году Николау и др. опубликовал полный синтез тиострептона. Сначала они построили ключевые строительные блоки тиострептона (1): дегидропиперидиновое ядро (2), тиазолиновый макроцикл (3), бис-дегидроаланиновый хвост (4) и макроцикл хинальдиновой кислоты (5). Затем последовательно собирали строительные блоки, как показано на синтетической схеме (номера соединений взяты из справочника).
Строительные блоки
[ редактировать ]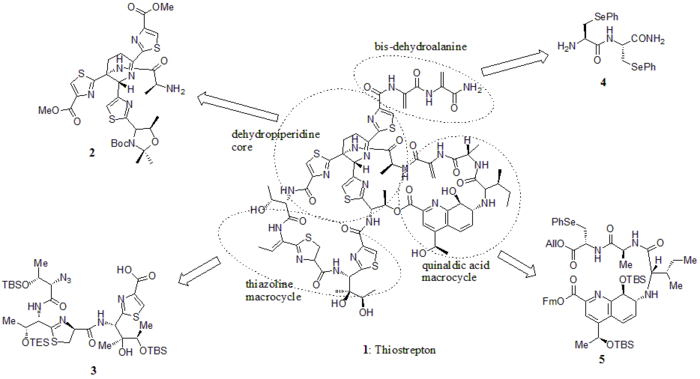
Синтетическая схема
[ редактировать ]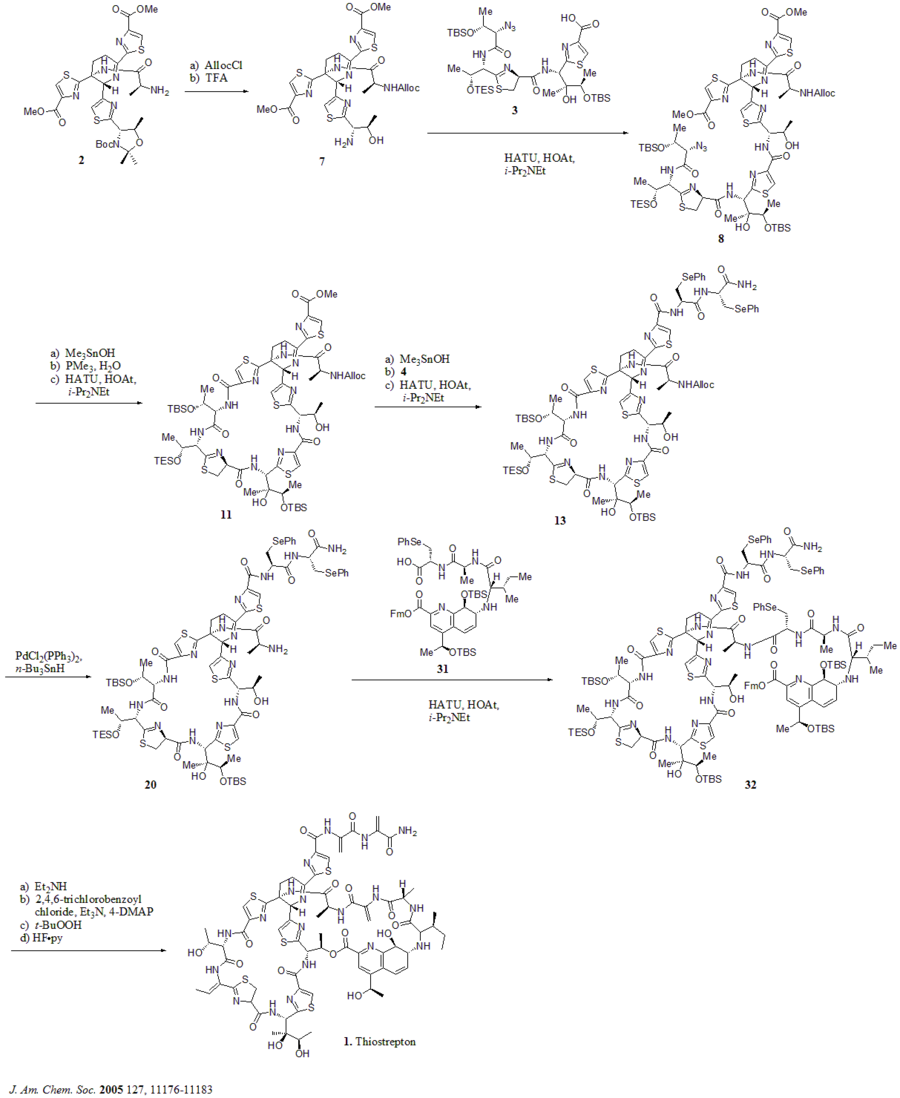
Ссылки
[ редактировать ]- ^ Индекс Merck , 11-е издание, 9295 .
- ^ Страница продукта Тиострептона на Fermentek.
- ^ Доновик Р., Пагано Дж. Ф., Стаут Х. А., Вайнштейн М. Дж. (1955). «Тиострептон, новый антибиотик. I. Исследования in vitro». Антибиот Анну . 3 : 554–9. ПМИД 13355325 .
- ^ Андерсон Б., Кроуфут Ходжкин Д., Висвамитра М.А. (1970). «Структура тиострептона». Природа . 225 (5229): 223–235. Бибкод : 1970Natur.225..233A . дои : 10.1038/225233a0 . ПМИД 5409975 . S2CID 40344493 .
- ^ Байкрофт, Барри В.; Гоуленд, Максим С. (1978). «Структура высокомодифицированных пептидных антибиотиков микрококцина Р1 и Р2». Журнал Химического общества, Chemical Communications (6): 256. doi : 10.1039/c39780000256 . ISSN 0022-4936 .
- ^ Виланд Браун LC, Акер М.Г., Кларди Дж., Уолш КТ, Фишбах М.А. (2009). «Тринадцать посттрансляционных модификаций превращают пептид из 14 остатков в антибиотик тиоциллин» . Учеб. Натл. акад. наук. США . 106 (8): 2549–53. Бибкод : 2009PNAS..106.2549W . дои : 10.1073/pnas.0900008106 . ПМК 2650375 . ПМИД 19196969 .
- ^ Моррис Р.П., Лидс Дж.А., Нагели Х.У., Оберер Л., Меммерт К., Вебер Э., Ламарш М.Дж., Паркер К.Н., Беррер Н., Эстероу С., Хейн А.Е., Шмитт Е.К., Крастель П. (2009). «Тиопептидные антибиотики, синтезируемые рибосомально, нацеленные на фактор элонгации Tu». Дж. Ам. хим. Соц . 131 (16): 5946–55. дои : 10.1021/ja900488a . ПМИД 19338336 .
- ^ Ляо Р., Дуань Л., Лэй С., Пан Х., Дин Ю, Чжан Ц, Чен Д., Шэнь Б., Ю Ю, Лю В (2009). «Биосинтез тиопептидов с участием рибосомально синтезируемых пептидов-предшественников и консервативных посттрансляционных модификаций» . хим. Биол . 16 (2): 141–7. doi : 10.1016/j.chembiol.2009.01.007 . ПМЦ 2676563 . ПМИД 19246004 .
- ^ Келли В.Л., Пан Л., Ли С. (2009). «Биосинтез тиострептона: прототип нового семейства бактериоцинов». Дж. Ам. хим. Соц . 131 (12): 4327–34. дои : 10.1021/ja807890a . ПМИД 19265401 .
- ^ Николау, КЦ; Зак, Марк; Сафина, Брайан С.; Эстрада, Энтони А.; Ли, Сан Хёп; Невалайнен, Марта (2005). «Полный синтез тиострептона. Сборка ключевых строительных блоков и завершение синтеза». Журнал Американского химического общества . 127 (31): 11176–11183. дои : 10.1021/ja052934z . ISSN 0002-7863 . ПМИД 16076225 .
- ^ Николау К.К., Сафина Б.С., Зак М., Ли Ш.Х., Невалайнен М., Белла М., Эстрада А.А., Функе С., Зекри Ф.Дж., Булат С. (2005). «Полный синтез тиострептона. Ретросинтетический анализ и построение ключевых строительных блоков». Дж. Ам. хим. Соц . 127 (31): 11159–75. дои : 10.1021/ja0529337 . ПМИД 16076224 .
- ^ Квок Дж.М., Мятт СС, Марсон СМ, Кумбс Р.К., Константиниду Д., Лам Э.В. (июль 2008 г.). «Тиострептон избирательно воздействует на клетки рака молочной железы посредством ингибирования экспрессии M1 forkhead box». Мол. Рак Там . 7 (7): 2022–32. дои : 10.1158/1535-7163.MCT-08-0188 . ПМИД 18645012 . S2CID 33941442 .
- ^ http://www.news-medical.net/news/20110822/Scientists-reveal-how-thiostrepton-blocks-FOXM1-protein-prevents-breast-cancer-development.aspx Ученые показывают, как тиострептон блокирует белок FOXM1 и предотвращает развитие молочной железы развитие рака. 2011 г.
- ^ Квок Дж.М.; Пек Б; Монтейру LJ; Швенен HD; Миллор Дж; Кумбс RC; Мятт СС; Лам ЭВ. (январь 2010 г.). «FOXM1 придает приобретенной резистентности к цисплатину клеткам рака молочной железы» . Молекулярные исследования рака . 8 (1): 24–34. дои : 10.1158/1541-7786.MCR-09-0432 . ПМК 2809047 . ПМИД 20068070 .
- ^ Масару Исии (февраль 2023 г.). Виновник остеопороза – медицинские рубежи . НХК ТВ .
- ^ Массон, С.В., Мэдсен, С., Кук, К.К., Поттер, М., Вегас, А.Д., Кэрролл, Л., ... и Джеймс, DE (2023). Использование генетического разнообразия для идентификации небольших молекул, которые обращают вспять резистентность к инсулину скелетных мышц мышей. Элайф, 12, RP86961 https://doi.org/10.7554/eLife.86961 ; bioRxiv дои : 10.1101/2023.03.01.530673
 В эту статью включен текст из этого источника, доступного по лицензии CC BY 4.0 .
В эту статью включен текст из этого источника, доступного по лицензии CC BY 4.0 .