Бета-милк
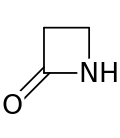
Бета -лактам ( β-лактам ) кольцо представляет собой четырехчленый лактам . [ 1 ] Лактам представляет собой циклический амид , и бета -лактамы называются так, потому что атом азота прикреплен к атому β -углерода по сравнению с карбонилом. Самый простой β-лактам-2-азетидинон. β-лактамы представляют собой значительные структурные единицы лекарств, которые проявляются во многих β-лактамных антибиотиках . [ 2 ] До 1970 года большинство исследований β-лактам было связано с группами пенициллина и цефалоспорина , но с тех пор было описано широкое разнообразие структур. [ 3 ] [ 4 ]
Клиническое значение
[ редактировать ]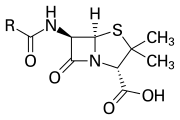
Кольцо β-лактама является частью основной структуры нескольких семейств антибиотиков , основными являются пенициллины , цефалоспорины , карбапенемы и монобактамы , которые, следовательно, также называются β-лактамными антибиотиками . Почти все эти антибиотики работают, ингибируя биосинтез бактериальной клеточной стенки . Это оказывает смертельное влияние на бактерии , хотя любая данная популяция бактерий, как правило, будет содержать подгруппу, которая устойчива к антибиотикам β-лактама. Устойчивость бактерий возникает в результате экспрессии одного из многих генов для продукции β-лактамаз , класса ферментов, которые разбивают кольцо β-лактама. Более 1800 различных ферментов β-лактамазы были задокументированы у различных видов бактерий. [ 5 ] Эти ферменты сильно различаются по их химической структуре и каталитической эффективности. [ 6 ] Когда бактериальные популяции имеют эти устойчивые подгруппы, лечение β-лактамом может привести к тому, что устойчивый штамм станет более распространенным и, следовательно, более вирулентным. Антибиотики, полученные с β-лактамом, можно считать одним из наиболее важных классов антибиотиков, но склонны к клинической резистентности. β-лактам демонстрирует его антибиотические свойства путем имитации естественного субстрата D-ALA-D-D-ALA для группы ферментов, известных как пенициллин, связывающие белки (PBP), которые имеют как функционирование для сшивки пептидогликана бактерии. [ 7 ]
Кольцо β-лактама также обнаруживается в некоторых других препаратах, таких как поглощения холестерина ингибитора препарат .
Синтез
[ редактировать ]Первый синтетический β-лактам был получен Штаудингером в 1907 году реакцией основания анилина Германом и бензальдегида с дифенилкетом [ 8 ] [ 9 ] В [2+2] циклический цикл (рН указывает фенильную функциональную группу):
Многие методы были разработаны для синтеза β-лактамов. [ 10 ] [ 11 ] [ 12 ]
Breckpot Синтез β-лактама [ 13 ] Производит замещенные β-лактамы путем циклизации эфиров бета-аминокислот с использованием реагента Grignard . [ 14 ] Реагент Мукайямы также используется в модифицированном синтезе Брекпота. [ 13 ]
Реакция
[ редактировать ]Из-за деформации кольца β-лактамы более легко гидролизуются , чем линейные амиды или более крупные лактамы. Этот штамм дополнительно увеличивается за счет слияния до второго кольца, как обнаружено у большинства β-лактамных антибиотиков. Эта тенденция обусловлена амидным характером β-лактама, сниженным в результате апланарности системы. Атом азота идеального амида - SP 2 -Сибридизирован из -за резонанса и sp 2 -Гибридизированные атомы имеют геометрию плоской плоской плоской связи . Поскольку геометрия пирамидальной связи навязывается атом азота с помощью кольцевого штамма, резонанс амидной связи уменьшается, а карбонил становится более кетоновым . Нобелевский лауреат Роберт Бернс Вудворд описал параметр h как меру высоты тригональной пирамиды, определяемой азотом (как вершина ) и его трех соседних атомов. H соответствует силе связей β-лактама с более низким числом (более плоским; больше похожими на идеальные амиды) более сильными и менее реактивными. [ 15 ] Монобактамы имеют значения H от 0,05 до 0,10 ангстремы (Å). Cephems имеют значения H в 0,20–0,25 Å. Пенис имеет значения в диапазоне 0,40–0,50 Å, в то время как карбапенемы и клавамы имеют значения 0,50–0,60 Å, что является наиболее реактивным из β-лактамов в направлении гидролиза. [ 16 ]
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Гилкрист Т. (1987). Гетероциклическая химия . Харлоу: Longman Scientific. ISBN 978-0-582-01421-3 .
- ^ Фишер, JF; Меро, так; Mobashery, S. (2005). «Устойчивость бактерий антибиотикам β-лактама: убедительный оппортунизм, убедительная возможность». Химические обзоры . 105 (2): 395–424. doi : 10.1021/cr030102i . PMID 15700950 .
- ^ Флинн Эх (1972). Цефалоспорины и пенициллины: химия и биология . Нью -Йорк и Лондон: академическая пресса.
- ^ Hossayni S, Jarrahpour A (октябрь 2018 г.). «Последние достижения в синтезе β-лактама» Органическая и биомолекулярная химия 16 (38): 6840–6 Doi : 10.1039/ c8ob01833b 30209477PMID
- ^ Брандт С., Браун С.Д., Стейн С., Сликукс П., Эрихт Р., Плец М.В., Макаревич О (февраль 2017 г.). «В анализе β-лактамаз Silico Serine выявляет огромный потенциальный резист у окружающей среды и патогенных видов» . Научные отчеты . 7 : 43232. Bibcode : 2017natsr ... 743232b . doi : 10.1038/srep43232 . PMC 5324141 . PMID 28233789 .
- ^ Эманн Д.Е., Яхич Х., Росс П.Л., Гу Р.Ф., Ху Дж, Керн Г., Уолк Г.К., Фишер С.Л. (июль 2012 г.). «Avibactam-это ковалентный, обратимый, не β-лактамный ингибитор β-лактамазы» . Труды Национальной академии наук Соединенных Штатов Америки . 109 (29): 11663–8. BIBCODE : 2012PNAS..10911663E . doi : 10.1073/pnas.1205073109 . PMC 3406822 . PMID 22753474 .
- ^ Tipper DJ, Strominger JL (октябрь 1965 г.). «Механизм действия пенициллинов: предложение, основанное на их структурном сходстве с ацилом-D-аланил-D-аланином» . Труды Национальной академии наук Соединенных Штатов Америки . 54 (4): 1133–41. Bibcode : 1965pnas ... 54.1133t . doi : 10.1073/pnas.54.4.1133 . PMC 219812 . PMID 5219821 .
- ^ Tidwell TT (2008). «Хьюго (Уго) Шифф, базы Шиффа и столетие синтеза бета-лактама». Angewandte Chemie . 47 (6): 1016–20. doi : 10.1002/anie.200702965 . PMID 18022986 .
- ^ Staudinger H (1907). «Для знания кетины. Дифенилкетене» . Юстус Либигс Энн. Химический 356 (1–2): 51–123. Doi : 10.1002/jlac.19073560106 . Архивировано из оригинала 2020-08-02 . Получено 2019-06-27 .
- ^ Алькаид, Бенито; Almendros, Pedro; Aragoncillo, Cristina (2007). «Β-лактамы: универсальные строительные блоки для стереоселективного синтеза не β-лактамных продуктов». Химические обзоры . 107 (11): 4437–4492. doi : 10.1021/cr0307300 . PMID 17649981 .
- ^ Хоссейни, Сейедмортеза; Jarrahpour, Aliasghar (2018). «Последние достижения в синтезе β-лактама » Органическая и биомолекулярная химия 16 (38): 6840–6 Doi : 10.1039/ c8ob01833b ISSN 1477-0 30209477PMID
- ^ Питтс, Коди Росс; Лекка, Томас (2014-08-27). «Химический синтез β-лактамов: асимметричный катализ и другие последние достижения» . Химические обзоры . 114 (16): 7930–7953. doi : 10.1021/cr4005549 . ISSN 0009-2665 . PMID 24555548 . Архивировано из оригинала 2022-07-21 . Получено 2020-12-17 .
- ^ Jump up to: а беременный «Синтез β-лактама Breckpot» , Комплексные органические реакции и реагенты , Хобокен, Нью-Джерси, США: John Wiley & Sons, Inc., с. 521–524, 2010-09-15, doi : 10.1002/9780470638859.conrr115 , ISBN. 978-0-470-63885-9 , архивировано из оригинала 2024-01-16 , извлечен 2021-02-04
- ^ Богданов Б., Здравковский З., Христовски К. «Синтез Брекпота» . Институт химии Скопье . Архивировано из оригинала 2015-11-06 . Получено 2014-12-30 .
- ^ Woodward RB (май 1980). «Penems и связанные с ними вещества» . Философские транзакции Королевского общества Лондона. Серия B, биологические науки . 289 (1036): 239–50. Bibcode : 1980rsptb.289..239W . doi : 10.1098/rstb.1980.0042 . PMID 6109320 .
- ^ Nangia A, Biradha K, Desiraju GR (1996). «Корреляция биологической активности у антибиотиков β-лактама со структурными параметрами Woodward и Cohen: исследование базы данных в Кембридже». J. Chem. Соц Perkin Trans . 2 (5): 943–53. doi : 10.1039/p2996000000943 .

