Дифенилкетен

| |

| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
2,2-Дифенилэтен-1-он | |
| Другие имена
Дифенилэтенон
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 14 Н 10 О | |
| Молярная масса | 194.233 g·mol −1 |
| Появление | Красно-оранжевое масло |
| Температура плавления | От 8 до 9 ° C (от 46 до 48 ° F; от 281 до 282 К) |
| Точка кипения | От 118 до 120 при 1 мм рт. ст. |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Дифенилкетен – химическое вещество семейства кетенов . Дифенилкетен, как и большинство стабильных дизамещенных кетенов представляет собой красно-оранжевое масло , при комнатной температуре и давлении . За счет последовательных двойных связей в структуре кетена R 1 Р 2 C=C=O, дифенилкетен представляет собой гетерокумулен . Важнейшей реакцией дифенилкетена является [2+2] -циклоприсоединение по кратным связям CC, CN, CO и CS. [ 1 ]
История
[ редактировать ]Дифенилкетен был впервые выделен Германом Штаудингером в 1905 году и идентифицирован как первый пример исключительно реакционноспособного класса кетенов. [ 2 ] с общей формулой R 1 Р 2 С=С=О (Р 1 =Р 2 =фенильная группа). [ 3 ]
Подготовка
[ редактировать ]Первый синтез Г. Штаудингера был основан на 2-хлордифенилацетилхлориде (полученном из бензиловой кислоты и тионилхлорида). [ 4 ] ), от которого два атома хлора отщепляются цинком в реакции дегалогенирования : [ 2 ]

В раннем синтезе используется бензилмоногидразон (из дифенилэтандиона и гидразингидрата). [ 5 ] ), который окисляется оксидом ртути (II) и сульфатом кальция с образованием монодиазокетона, а затем превращается в дифенилкетен при 100 ° C при удалении азота с выходом 58%: [ 6 ]
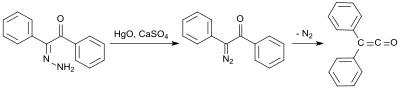
Дальнейший ранний синтез дифенилкетена принадлежит Эдуарду Ведекинду, который уже получил дифенилкетен в 1901 году путем дегидрогалогенирования дифенилацетилхлорида триэтиламином , однако без выделения и характеристики. [ 7 ] Этот вариант был также описан в 1911 г. Х. Штаудингером. [ 8 ]
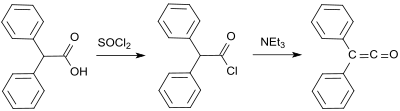
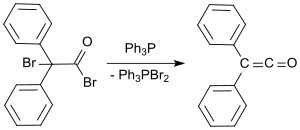
Стандартный лабораторный протокол основан на методе Штаудингера и дает дифенилкетен в виде оранжевого масла с выходом от 53 до 57%. [ 9 ] В более позднем процессе 2-бром-2,2-дифенилацетилбромид подвергается реакции с трифенилфосфином с образованием дифенилкетена с выходом до 81%. [ 10 ]
Недавно был осуществлен синтез дифенилкетена из дифенилуксусной кислоты и реактива Хендриксона (ангидрид трифенилфосфония-трифторметансульфонат). [ 11 ] с удалением воды с выходом 72%. [ 12 ]

Характеристики
[ редактировать ]Дифенилкетен при комнатной температуре представляет собой масло от оранжевого до красного цвета (цвета концентрированного раствора дихромата калия) . [ 2 ] ), который смешивается с неполярными органическими растворителями (такими как диэтиловый эфир , ацетон , бензол , тетрагидрофуран , хлороформ ) [ 13 ] и затвердевает на холоде, образуя желтые кристаллы. [ 2 ] Соединение легко окисляется воздухом, но может храниться в плотно закрытых емкостях при температуре 0 °С в течение нескольких недель без разложения. [ 9 ] или в атмосфере азота с добавлением небольшого количества гидрохинона в качестве ингибитора полимеризации. [ 6 ]
Реактивность
[ редактировать ]Дифенилкетен может подвергаться атаке со стороны множества нуклеофилов , включая спирты , амины и еноляты , с довольно медленной скоростью. Эти скорости могут быть увеличены в присутствии катализаторов . В настоящее время механизм атаки неизвестен, но ведутся работы по определению точного механизма.
Высокая реакционная способность дифенилкетена проявляется также в образовании трех димеров: [ 14 ]
- циклический дикетон 2,2,4,4-тетрафенилциклобутан-1,3-дион (I) нагреванием с хинолином
- β-лактон 4-(дифенилметилен)-3,3-дифенилоксетан-2-он (II) нагреванием с метоксидом натрия и
- производное тетралина 2,2,4-трифенилнафталин-1,3-(2H , 4H ) -диона (III) при нагревании с бензоилхлоридом
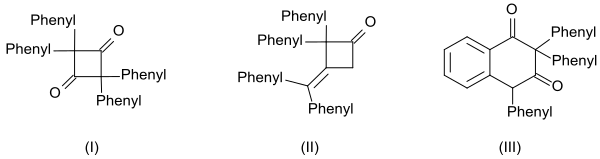
и олигомеры, полученные из них.
Приложение
[ редактировать ]Кетены (общей формулы R). 1 Р 2 C=C=O) имеют много параллелей с изоцианатами (общей формулы RN=C=O) по своему строению, а также по своей реакционной способности.
Дифенилкетен реагирует с водой в реакции присоединения с образованием дифенилуксусной кислоты , с этанолом - с этиловым эфиром дифенилуксусной кислоты или с аммиаком - с соответствующим амидом. [ 2 ] Карбоновые кислоты производят смешанные ангидриды дифенилуксусной кислоты, которые можно использовать для активации защищенных аминокислот для пептидной связи .
Таким образом, защищенный дипептид Z-Leu-Phe-OEt (этиловый эфир N-бензилоксикарбонил-L-лейцил-L-фенилаланина) получают с выходом 59% путем активации Z-лейцина дифенилкетеном и последующей реакции с этиловым эфиром фенилаланина. [ 15 ]
Дифенилкетен склонен к автоокислению , при котором соответствующий полиэфир образуется при температуре выше 60 °C через промежуточный дифенилацетолактон. [ 16 ]

Виттига . реакцией Аллены можно получить из дифенилкетена [ 17 ]

С трифенилфосфином, дифенилметиленом и дифенилкетеном, например, при 140 °C и под давлением тетрафенилаллены образуются с выходом 70%. [ 18 ]
Наиболее интересными с синтетической точки зрения реакциями дифенилкетена являются [2+2]циклоприсоединения, например реакция с циклопентадиеном с образованием аддукта Дильса-Альдера. [ 19 ]

Имины, такие как бензаланилин, образуют β-лактамы с дифенилкетеном.
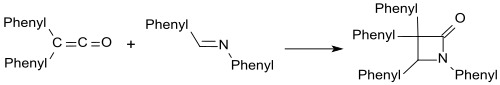
С карбонильными соединениями аналогично образуются β-лактоны. [ 19 ]
[2+2]циклоприсоединение дифенилкетена к фенилацетилену сначала приводит к циклобутенону , который термически ароматизируется до фенилвинилкетена и циклизуется при [4+2]циклоприсоединении к 3,4-дифенил-1-нафтолу с выходом 81%. [ 20 ]

На основе этой так называемой реакции Смита-Хёна был разработан общий метод синтеза замещенных фенолов и хинонов. [ 3 ]
Ссылки
[ редактировать ]- ^ Ульрих, Х. (1967), Реакции циклоприсоединения гетерокумуленов , Нью-Йорк: Academic Press, с. 374
- ^ Перейти обратно: а б с д и Штаудингер, Х. (1905). «Кетене, новый класс тела» . Бер. Немецкий. Хим. Гес . 38 (2): 1735–1739. дои : 10.1002/cber.19050380283 .
- ^ Перейти обратно: а б Тидвелл, Т.Т. (2005), «Первый век кетенов (1905–2005): рождение универсального семейства реактивных промежуточных продуктов», Ангью. хим. , том. 44, нет. 36, стр. 5778–5785, номер документа : 10.1002/anie.200500098 , PMID 16149113.
- ^ Кинг, FE; Холмс, Д. (1947), «Синтетические мидриатики. Дифенилхлорацетилхлорид как реагент для получения бензиловых эфиров третичных аминоспиртов», J. Chem. Соц. , стр. 164–168, doi : 10.1039/JR9470000164 , PMID 20238643
- ^ Куртиус, Т.; Тун, К. (1891), «Влияние гидразингидрата на монокетоны и ортодикетоны» , J. Prakt. хим. , вып. 44, № 2, стр. 161–186, doi : 10.1002/prac.18910440121.
- ^ Перейти обратно: а б Смит, Л.И.; Хен, Х.Х. (1940). «Дифенилкетен [Кетен, дифенил-]» . Органические синтезы . 20 : 47. дои : 10.15227/orgsyn.020.0047 ; Сборник томов , т. 3, с. 356 .
- ^ Ведекинд Э. (1901), «О производстве ангидридов кислот с помощью третичных аминов» , Бер. Немецкий. хим . 34, № 2, стр. 2070–2077, doi : 10.1002/cber.190103402122.
- ^ Штаудингер, Х. (1911), «О кетене.XIX. Об образовании и получении дифенилкетена» , Ber. Немецкий. хим . 44, № 2, стр. 1619–1623, номер документа : 10.1002/cber.19110440258.
- ^ Перейти обратно: а б Тейлор, ЕС; МакКиллоп, А; Хоукс, GH (1972). «Дифенилкетен [Этенон, дифенил-]» . Органические синтезы . 52 : 36. дои : 10.15227/orgsyn.052.0036 ; Сборник томов , т. 6, с. 549 .
- ^ Дарлинг, SD; Кидвелл, Р.Л. (1968), "Дифенилкетен. Трифенилфосфиновое дегалогенирование альфа-бромдифенилацетилбромида", J. Org. хим. , том. 33, нет. 10, стр. 3974–3975, doi : 10.1021/jo01274a074.
- ^ МакКоли, Дж.И. (2012), «Реагент Хендриксона (трифторметансульфонат трифенилфосфонийского ангидрида», Synlett , т. 23, № 20, стр. 2999–3000, doi : 10.1055/s-0032-1317486
- ^ Мусса, З. (2012), «Реагент Хендриксона 'POP' и его аналоги: синтез, структура и применение в органическом синтезе», Arkivoc , 2012 (1): 432–490, doi : 10.3998/ark.5550190.0013.111 , HDL : 2027/спо.5550190.0013.111
- ^ Лихи, JW (2001). «Дифенилкетен». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.rd421 . ISBN 0471936235 .
- ^ Бросаться.; Койман, EC (1965). «Олигомеры дифенилкетена». Коллекция химических предприятий Нидерландов . 84 (8): 965–978. дои : 10.1002/recl.19650840802 .
- ^ Лосс, Г.; Демут, Э. (1961), «Дифенилкетен как реагент для образования пептидных связей», Ber. Немецкий. Chem. (на немецком языке), том. 94, № 7, стр. 1762–1766, номер документа : 10.1002/cber.19610940713.
- ^ Штаудингер, Х.; Дайкерхофф, К.; Клевер, Х.В.; Ружичка, Л. (1925), «Об автоокислении органических соединений. IV.: Об автоокислении кетенов», Ber. Немецкий. Chem. (на немецком языке), том. 58, № 6, стр. 1079–1087, номер документа : 10.1002/cber.19250580618.
- ^ Виттиг, Г.; Хааг, А. (1963), «О фосфиналкиленах как олефинобразующих реагентах, VIII. Аллельные производные кетенов», Ber. Немецкий. Chem. (на немецком языке), том. 96, № 6, стр. 1535–1543, номер документа : 10.1002/cber.19630960609.
- ^ Люшер, Г. (1922). Вклад в образование алифатических диазотел и гидразонов. Новые органические соединения фосфора (PDF) (докторская диссертация) (на немецком языке). Швейцарский федеральный технологический институт в Цюрихе. дои : 10.3929/ethz-a-000096667 . hdl : 20.500.11850/134328 .
- ^ Перейти обратно: а б Штаудингер, Х. (1907), «О знаниях кетенов. Дифенилкетен» , Liebigs Ann. Chem (на немецком языке), том. 356, № 1–2, стр. 51–123, номер документа : 10.1002/jlac.19073560106.
- ^ Смит, Л.И.; Хен, Х.Х. (1939), «Реакция дифенилкетена и фенилацетилена», J. Am. хим. Соц. , том. 61, нет. 10, стр. 2619–2624, doi : 10.1021/ja01265a015.
2CO-O-CO-{}}}{\text{Z -Leu }}{\ce {->[{} \atop {\ce {H-Phe-OEt}}]}}{\text{ Z-Leu}}{\ce {-Phe-OEt}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a7b4b915bc917b7c77143009ead9cc799bd83acc)