Альфа-аминоадипическая полуалдегида-синтаза
| Аас | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | Aass , LKR/SDH, LKRSDH, LORSDH, Aminoadipate-Semial | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Омим : 605113 ; MGI : 1353573 ; Гомологи : 4212 ; Genecards : Aass ; OMA : AASS - Ортолы | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викидид | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Альфа-аминоадипическая полуалдегида-синтаза представляет собой фермент, кодируемый геном AASS у людей, и участвует в их основном лизина пути деградации . Он похож на отдельные ферменты, кодируемые генами Lys1 и Lys9 в дрожжах, и связано с, хотя и не схожим по структуре, бифункциональный фермент, обнаруженный в растениях. [ 5 ] [ 6 ] У людей мутации в гене AASS и соответствующий альфа-аминоадипический полуалдегид-синтазный фермент связаны с семейной гиперлизинемией . [ 5 ] [ 7 ] [ 8 ] Это редкое заболевание наследуется на аутосомно -рецессивном паттерне, и пациенты часто не имеют клинических симптомов. [ 9 ]
Функция
[ редактировать ]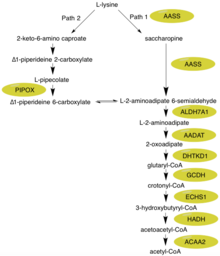
Альфа-аминоадипический полуалдегидсинтаз белок катализирует первые два шага в деградации лизина млекопитающих посредством сахаропина пути в митохондриях , что, как считается, является основным метаболическим путем для деградации лизина в верхних эукариотах . [ 11 ] [ 12 ] Специфический подпадный путь, на котором фокусируется этот фермент,-это синтез глутарил-КоА из L-лизина. [ 9 ] Глютарил-КоА может действовать как промежуточный соединение в более расширенном пути конверсии/деградации от L-лизина в ацетил-КоА.
Двумя заметными компонентами деградации L-лизина посредством пути сахаропина являются промежуточный глутамат реакции/продукта и возможный поглотителя углерода ацетил-COA . Глутамат является важным соединением в организме, которое действует как нейротрансмиттер, связанный с обучением и болезнью Хантингтона. [ 13 ] [ 14 ] Ацетил-КоА, возможно, имеет еще более высокий уровень важности, действуя как один из интегральных компонентов цикла лимонной кислоты/Kreb, причем основная функция предоставления ацетильной группы окислена для производства энергии. [ 15 ] Таким образом, функция альфа-аминоадипической полуалдегидсинтазы привязана к уровням двух интегральных соединений в организме.
Механизм
[ редактировать ]
Во-первых, N-концевая часть этого фермента, который содержит активность лизин - кетоглутарат редуктазы (LOR/LKR) ( EC : 1.5.1.8) конденсирует лизин и 2-оксоглутарат в молекулу, называемую сахаропином (реакция 1 на рисунке справа)) Полем [ 7 ] [ 11 ] Затем С-концевая часть этого фермента, который содержит активность сахаропиндегидрогеназы (SHD) (EC: 1.5.1.9), катализирует окисление сахаропина для получения альфа-аминоадипического полуалдегида и глутамата (реакция 2 на рисунке)) Полем [ 7 ] [ 11 ] Примечание. Эти реакции являются обратной задачей соответствующих этапов в путях биосинтеза лизина, присутствующих в дрожжах и грибах . [ 16 ] [ 17 ] [ 18 ]
Эти реакции могут быть визуализированы также в форме уравнения реакции:
N (6)-(L-1,3-дикарбоксипропил) -L-лизин + NADP + + H 2 o = l-лизин + 2-оксоглутарат + nadph с последующим
N (6)-(L-1,3-дикарбоксипропил) -l-лизин + nad + + H 2 o = l-глютамат + (s) -2-амино-6-оксогексаноат + nadh. [ 9 ]
Структура
[ редактировать ]Нативный человеческий фермент является бифункциональным, так же, как LKR/SHD, обнаруженный в растениях, и, следовательно, считается одинаковым по структуре. [ 16 ] Бифункциональность этого фермента происходит от того факта, что он содержит два различных активных участка, один на его С-конце и один на его N-конце. [ 7 ] С-концевая часть альфа-аминоадипического полуалдегида-синтазы содержит активность SHD, а N-концевая часть содержит LKR. [ 19 ] На сегодняшний день структура альфа-аминоадипической полуалдегида-синтазы не была определена. [ 20 ] Фермент не имеет области линкера, присутствующей в растениях между его C и N-концами, поэтому теории предполагают, что фактическая структура содержит область LKR-активности, связанную с областью SHD-активности, подобной таковой в Magnaporthe Grisea . [ 19 ]

Актуальность заболевания
[ редактировать ]Альфа-аминоадипическая полуалдегида-синтаза кодируется геном AASS, а мутации в этом гене приводят к гиперлизинемии. [ 5 ] [ 7 ] Это характеризуется нарушением разбивки лизина, что приводит к повышенным уровням лизина в крови и моче. Эти повышенные уровни лизина, по -видимому, не оказывают негативного воздействия на организм. [ 8 ] Другие имена для этого условия включают: [ 8 ]
- Альфа-аминоадипический дефицит полуалдегида заболевания
- Семейная гиперлизинемия
- Лизин альфа-кетоглутарат-дефицит дефицита дефицита
- заболевание дефицита дефицита сахаропиндегидрогеназы
- Saccharopinuria
Гиперлизинемия характеризуется повышенными уровнями лизина в плазме, которые превышают 600 мкмоль/л и могут достигать 2000 мкмоль/л. [ 21 ] [ 22 ] Эти повышенные уровни лизина, по -видимому, не оказывают негативного воздействия на организм. [ 8 ] Основная причина этого заключается в том, что могут происходить несколько альтернативных биохимических реакций. Во -первых, лизин может использоваться вместо орнитина в цикле мочевины, что приводит к производству гомоаргинина . [ 23 ] Кроме того, даже если большинство млекопитающих используют путь сахаропина для большинства деградации лизина (путь 1), мозг имеет альтернативный путь (путь 2), который проходит через промежуточное соединение L -пипеколевой кислоты - оба из них можно увидеть на рисунке. [ 23 ] Важно отметить, что путь 1 происходит в митохондриях, в то время как путь 2 находится в пероксисоме. [ 12 ] Глядя на другие ключевые ферменты в пути деградации L-лизина, ALDH7A1 имеет дефицит у детей с пиридоксинозависимыми припадками. [ 24 ] GCDH имеет дефицит в глутарной ациумею типа 1. [ 25 ] Промежуточный 2-оксоадипат метаболизируется с помощью 2-оксоадипатдегидрогеназы, напоминающей фермент-комплекс цикла лимонной кислоты/Kreb. [ 10 ]
До сих пор были описаны два типа семейной гиперлизинемии: тип I связан с комбинированным дефицитом двух ферментных активностей, LOR и SDH, тогда как в семейной гиперлизинемии II только активность сахаропиндегидрогеназы нарушается. [ 26 ] [ 27 ] Гиперлисинемия типа II также называется Saccharopinuria. [ 10 ]
Дополнительным условием, которое показано, связано с гиперлизинемией, является дефицит диенойл-КоА редуктазы, хотя это относительно недавнее открытие, и не так много публикаций, подтверждающих это. [ 28 ]
Ссылки
[ редактировать ]- ^ Jump up to: а беременный в GRCH38: Ensembl Release 89: ENSG00000008311 - Ensembl , май 2017 г.
- ^ Jump up to: а беременный в GRCM38: Ensembl Release 89: Ensmusg00000029695 - Ensembl , май 2017 г.
- ^ «Человеческая PubMed ссылка:» . Национальный центр информации о биотехнологии, Национальная медицина США .
- ^ «Мышь Pubmed ссылка:» . Национальный центр информации о биотехнологии, Национальная медицина США .
- ^ Jump up to: а беременный в Sacksteder KA, Biery BJ, Morrell JC, Goodman BK, Geisbrecht BV, Cox RP, Gould SJ, Geraghty Mt (июнь 2000 г.). «Идентификация гена альфа-аминоадипического полуалдегида-синтазы, который дефектный по семейной гиперлизинемии» . Американский журнал человеческой генетики . 66 (6): 1736–43. doi : 10.1086/302919 . PMC 1378037 . PMID 10775527 .
- ^ Zhu X, Tang G, Galili G (декабрь 2002 г.). «Активность бифункционального лизин-кетоглутарат-редуктазы/сахаропиндегидрогеназного фермента лизина катаболизма регулируется функциональным взаимодействием между двумя его ферментными доменами» . Журнал биологической химии . 277 (51): 49655–61. doi : 10.1074/jbc.m205466200 . PMID 12393892 .
- ^ Jump up to: а беременный в дюймовый и «Ген Entrez: Aass aminoadipate-semialehygydybysase» .
- ^ Jump up to: а беременный в дюймовый «Гиперлизинемия» . Генетика дома ссылка . Получено 2017-03-04 .
- ^ Jump up to: а беременный в «Альфа-аминоадипическая полуалдегида-синтаза, митохондрия» . Uniprot . Получено 2017-03-04 .
- ^ Jump up to: а беременный в Houtes SM, T Brinike H, Denis S, Ruiter JP, Change AC, Cleck JB, Augoustide-Savopulou P, Häberle J, Coşkun T, Schocke J, Schocke Jo, Polran M (Spril 2013). «Генетическая базовая или гиперлизинмия» . Orpanet Journal of RRE расставается . 8 : 57. DOI : 10,1186/1750-1172-8-8-8-57 . PMC 3626681 . PMID 2357048 .
- ^ Jump up to: а беременный в Papes F, Kemper EL, Cord-Neto G, Langone F, Arruda P (декабрь 1999). «Разрушение лизина по пути сахаропина у млекопитающих: участие как бифункциональных, так и монофункциональных ферментов, разрушающих лизин в мыши» . Биохимический журнал . 344 (2): 555–63. doi : 10.1042/0264-6021: 3440555 . PMC 1220675 . PMID 10567240 .
- ^ Jump up to: а беременный Danhauser K, Sauer SW, Haack TB, Wieland T, Staufner C, Graf E, Zschocke J, Strom TM, Traub T, Okun JG, Meitcher T, Hoffmann GF, Prokisch H, Kölker S (декабрь 2012 г.). «Мутации DHTKD1 вызывают 2-аминоадипическую и 2-осокоадипическую ацидоурию» . Американский журнал человеческой генетики . 91 (6): 1082–7. doi : 10.1016/j.ajhg.2012.10.006 . PMC 3516599 . PMID 23141293 .
- ^ Meldrum BS (апрель 2000 г.). «Глутамат как нейротрансмиттер в мозге: обзор физиологии и патологии» . Журнал питания . 130 (4S Suppl): 1007S - 15 с. doi : 10.1093/jn/130.4.1007s . PMID 10736372 . Архивировано с оригинала 2017-05-16 . Получено 2017-03-05 .
- ^ «О токсичности глутамата» . Охотника за болезнью для образования в Стэнфорде (надежды) . Американское общество болезней Хантингтона. 26 июня 2011 года . Получено 2017-03-05 .
- ^ Ophardt CE (2003). «Соединение ацетил -коа» . Виртуальная химическая книга . Элмхерст -колледж. Архивировано с оригинала 2016-11-15 . Получено 2017-03-05 .
- ^ Jump up to: а беременный Марковиц П.Дж., Чуан Д.Т., Кокс Р.П. (октябрь 1984). «Семейная гиперлисинемация. Очистка и характеристика бифункциональной аминоадипической полуалдегидсинтазы с лизин-кетоглутаратредуктазой и активностью сахаропиндегидрогеназы» . Журнал биологической химии . 259 (19): 11643–6. doi : 10.1016/s0021-9258 (20) 71252-4 . PMID 6434529 .
- ^ Jones EE, Broquist HP (июнь 1965 г.). «Сахаропин, промежуточный соединение пути аминоадипической кислоты биосинтеза лизина. II. Исследования на Saccharomyces cereviseae [ sic ]» . Журнал биологической химии . 240 (6): 2531–6. doi : 10.1016/s0021-9258 (18) 97358-8 . PMID 14304864 .
- ^ Trupin JS, Broquist HP (июнь 1965 г.). «Сахаропин, промежуточный соединение путем аминоадипической кислоты биосинтеза лизина. I. Исследования на нейроспоре Crassa» . Журнал биологической химии . 240 (6): 2524–30. doi : 10.1016/s0021-9258 (18) 97357-6 . PMID 14304863 .
- ^ Jump up to: а беременный Йоханссон Э., Штеффенс Дж.Дж., Линдквист Ю., Шнайдер Г. (октябрь 2000 г.). «Кристаллическая структура сахаропинредуктазы из магнапорте, фермент альфа-аминоадипатного пути биосинтеза лизина» . Структура 8 (10): 1037–47. doi : 10.1016/s0969-2126 (00) 00512-8 . PMID 11080625 .
- ^ «Aass - аминоаджат -семиальдегид -синтаза» . RCSB Белковой банк данных . Архивировано из оригинала 2017-11-07 . Получено 2017-03-06 -через PDB.
- ^ Хоффманн Г.Ф., Колкер С. (2012). «Расстройства головного органического кислоты и другие расстройства катаболизма лизина». В Saudubray JM, Van Den Berghe G, Walter JH (Eds.). Диагностика и лечение врожденных метаболических заболеваний (5 -е изд.). Берлин: Спрингер. С. 333–346. ISBN 978-3-642-15720-2 .
- ^ Saudubray JM, Rabier D (июнь 2007 г.). «Биомаркеры, идентифицированные в врожденных ошибках для лизина, аргинина и орнитина» . Журнал питания . 137 (6 Suppl 2): 1669s - 1672s. doi : 10.1093/jn/137.6.1669s . PMID 17513445 .
- ^ Jump up to: а беременный Vd Heiden C, Brink M, De Bree PK, V Sprang FJ, Wadman SK, De Pater JM, Van Biervliet JP (1978). «Семейная гиперлисинемия из-за L-лизин-альфа-кетоглутарат-дефицита редуктазы: результаты попытки лечения». Журнал наследственного метаболического заболевания . 1 (3): 89–94. doi : 10.1007/bf01805679 . PMID 116084 . S2CID 35326745 .
- ^ Миллс П.Б., Струйс Е., Якобс С., Плекко Б., Бакстер П., Баумгартнер М., Виллемсен М.А., Омран Х., Так У, Уленберг Б., Уэшке Б., Клейтон П.Т. (март 2006 г.). «Мутации в антиквитине у людей с пиридоксином-зависимыми припадками». Природная медицина . 12 (3): 307–9. doi : 10.1038/nm1366 . PMID 16491085 . S2CID 27940375 .
- ^ Гудман С.И., Крац Л.Е., Дигиулио К.А., Бири Б.Дж., Гудман К.Е., Исая Г., Ферман Ф.Е. (сентябрь 1995). «Клонирование клонирования кДНК-дегидрогеназы глутарил-КоА и экспрессия ферментов дикого типа и мутантов в Escherichia coli». Молекулярная генетика человека . 4 (9): 1493–8. doi : 10.1093/hmg/4.9.1493 . PMID 8541831 .
- ^ Dancis J, Hutzler J, Cox RP (май 1979). «Семейная гиперлизинемия: ферментные исследования, диагностические методы, комментарии к терминологии» . Американский журнал человеческой генетики . 31 (3): 290–9. PMC 1685795 . PMID 463877 .
- ^ Cederbaum SD, Shaw KN, Dancis J, Hutzler J, Blaskovics JC (август 1979 г.). «Гиперлизинемия с сахаропинурией из-за комбинированной дефицита лизин-кетоглутаратредуктазы и сахаропиндегидрогеназы, представляющих в качестве цистинурии». Журнал педиатрии . 95 (2): 234–8. doi : 10.1016/s0022-3476 (79) 80657-5 . PMID 571908 .
- ^ Houtes SM, Denis S, Terke H, Youngjan A, из Kampen AH, Bradley EJ, Baas F, Hennekam RC, Millington DS, Young SP, Fracsavas-Calicglu M, Wonders RJ (сентябрь 2014 г.). «Дефицит Mitchundry NADP (H) из-за мутации при причин NADK2 гиперлисинемины ThenOyl-CoA» . Молекулярная генетика человека . 23 (18): 5009–16. doi : 10,1093/hmg/ddu218 . PMID 24847004 .
Дальнейшее чтение
[ редактировать ]- Maruyama K, Sugano S (январь 1994 г.). «Олиго-капитализация: простой метод замены структуры крышки эукариотических мРНК олигорибонуклеотидами». Ген . 138 (1–2): 171–4. doi : 10.1016/0378-1119 (94) 90802-8 . PMID 8125298 .
Внешние ссылки
[ редактировать ]- AASS Human Gene Location в браузере генома UCSC .
- Аасс человеческий ген детали в браузере генома UCSC .





