Дамасценон

| |

| |
| Имена | |
|---|---|
| Название ИЮПАК
( E )-1-(2,6,6-Триметил-1-циклогекса-1,3-диенил)бут-2-ен-1-он
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| КЭБ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.041.662 |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 13 Н 18 О | |
| Молярная масса | 190.286 g·mol −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Дамасценоны представляют собой ряд близкородственных химических соединений, которые являются компонентами различных эфирных масел . Дамасценоны принадлежат к семейству химических веществ, известных как розовые кетоны , в которое также входят дамасконы и иононы . Бета -дамасценон вносит основной вклад в аромат роз, несмотря на его очень низкую концентрацию, и является важным ароматическим химическим веществом, используемым в парфюмерии. [ 1 ]
Дамасценоны образуются в результате разложения каротиноидов . [ 2 ]
В 2008 году (E)-β-дамасценон был идентифицирован как основной ароматизатор бурбона в Кентукки . [ 3 ]
Биосинтез
[ редактировать ]Этот раздел может быть слишком техническим для понимания большинства читателей . ( Май 2016 г. ) |
Биосинтез β-дамасценона начинается с реакции фарнезилпирофосфата (FPP) и изопентенилпирофосфата (IPP) с образованием геранилгеранилпирофосфата (GGPP). Рисунок 1.
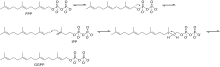
Следующие две молекулы GGPP конденсируются вместе с образованием фитоена путем удаления дифосфата и сдвига протона, катализируемого ферментом фитоенсинтазой (PSY). Затем фитоен проходит серию реакций десатурации с использованием фермента фитоендесатуразы (PDS) с образованием фитофлуена , а затем ζ-каротина . Было обнаружено, что другие ферменты катализируют эту реакцию, включая CrtI и CrtP. [ 4 ] Следующая серия реакций десатурации катализируется ферментом ζ-каротиндесатураза (ZDS) с образованием нейроспорина, а затем ликопина . Другие ферменты, способные катализировать эту реакцию, включают CtrI и CrtQ. Затем ликопин проходит две реакции циклизации с использованием фермента ликопин-β-циклазы, сначала производящего γ-каротин , а затем вторую циклизацию с образованием β-каротина , как показано на рисунке 2.
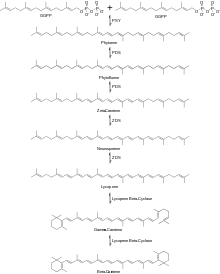
Механизм циклизации ликопина в β-каротин показан на схеме 2.
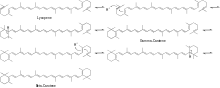
Затем β-каротин реагирует с O2 и ферментом β-каротиновой кольцевой гидроксилазой, образуя зеаксантин . [ 5 ] Затем зеаксантин реагирует с O2, НАДФН (H+) и восстановленным кластером ферредоксина [железо-сера] в присутствии фермента зеаксантинэпоксидазы (ZE) с образованием антераксантина, который реагирует аналогичным образом с образованием виолаксантина . Затем виолаксантин реагирует с ферментом неоксантинсинтазой, образуя неоксантин, основной предшественник β-дамасценона, как показано на рисунке 3.
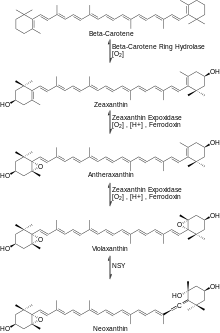
[ 6 ] Чтобы получить β-дамасценон из неоксантина, необходимо еще несколько модификаций. Сначала неоксантин подвергается окислительному расщеплению с образованием кетона кузнечика. Затем кетон кузнечика подвергается восстановлению с образованием алленового триола. На этом этапе существует два основных пути, по которым алленовый триол может получить конечный продукт. Алленовый триол может подвергаться реакции дегидратации с образованием либо ацетиленового диола, либо алленового диола. Наконец, последняя реакция дегидратации ацетилендиола или аллендиола дает конечный продукт β-дамасценон, как показано на рисунке 4.

[ 7 ] [ 8 ] Предлагаемый механизм превращения алленового триола в ацетиленовый диол показан на схеме 3.
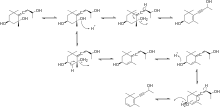
Предлагаемый механизм превращения ацетилендиола в конечный продукт показан на схеме 4.

Этот механизм известен как перегруппировка Мейера-Шустера .
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Роза (Rosa damascena) , Джон К. Леффингвелл
- ^ Сачихико Исоэ; Сигео Кацумура; Такео Сакан (1973). «Синтез дамасценона и бета-дамаскона и возможный механизм их образования из каротиноидов». Helvetica Chimica Acta . 56 (5): 1514–1516. дои : 10.1002/hlca.19730560508 .
- ^ ЛУИДЖИ ПУАССОН; ПИТЕР ШИБЕРЛЕ (2008). «Характеристика наиболее активных по запаху соединений в американском бурбонском виски с помощью анализа разбавления ароматического экстракта». Журнал сельскохозяйственной и пищевой химии . 56 (14): 5813–5819. дои : 10.1021/jf800382m . ПМИД 18570373 .
- ^ Майкл Х. Уолтер; Дитер Штрак (2011). «BCarotenoids и продукты их расщепления: биосинтез и функции». Нат. Прод. Представитель . 28 (4): 663–692. дои : 10.1039/c0np00036a . ПМИД 21321752 .
- ^ Цзянь Цзэн; Си Чен; Цуйхун Ван; Цюн Миао Ли; Цзюньли Чанг; Гуансянь Хэ (2015) . -циклаза играет значительную роль в биосинтезе провитамина А в эндосперме пшеницы» . BMC Plant Biology . 15 112): 112. doi : 10.1186/ s12870-015-0514-5 PMC 4433027. ( PMID 25943989 .
- ^ Кодзи Миками; Масаси Хосокава (2013). «Биосинтетический путь и польза для здоровья фукоксантина, ксантофилла, специфичного для водорослей, в бурых морских водорослях» . Межд. Дж. Мол. Наука . 14 (7): 13763–13781. дои : 10.3390/ijms140713763 . ПМЦ 3742216 . ПМИД 23820585 .
- ^ Яир Безман; Ицхак Билкис; Питер Винтерхальтер; Питер Флейшманн; Рассел Л. Русефф; Сюзанна Бальдерманн; Майкл Наим (2005). «Термическое окисление 9'-цис-неоксантина в модельной системе, содержащей пероксиуксусную кислоту, приводит к получению сильнодействующего одоранта β-дамасценона». Журнал сельскохозяйственной и пищевой химии . 53 (23): 9199–9206. дои : 10.1021/jf051330b . ПМИД 16277423 .
- ^ Питер Винтерхальтер; Реджеп Гёк (2013). «TDN и β-дамасценон: два важных каротиноидных метаболита в вине». Продукты расщепления каротиноидов . Серия симпозиумов ACS. Том. 1134. стр. 125–137. дои : 10.1021/bk-2013-1134.ch011 . ISBN 978-0-8412-2778-1 .