Гиперметилирование CpG-островков
Гиперметилирование CpG-островков — явление, важное для регуляции экспрессии генов в раковых клетках, поскольку это нарушение эпигенетического контроля, ответственное за инактивацию генов. Гиперметилирование CpG -островков описано практически во всех типах опухолей .
Многие важные клеточные пути , такие как восстановление ДНК ( hMLH1 например, ), клеточный цикл ( p14ARF ), апоптоз ( DAPK ) и прилипание клеток ( CDH1 , CDH13 ), инактивируются им. [ 1 ] Гиперметилирование связано с метилсвязывающими белками , ДНК-метилтрансферазами и деацетилазой гистонов , но степень, в которой этот процесс избирательно подавляет гены-супрессоры опухолей, остается областью исследований. Список гиперметилированных генов растет.
История
[ редактировать ]Первым открытием метилирования CpG-островка гена-супрессора опухоли у человека было открытие гена ретинобластомы (Rb) в 1989 году. [ 2 ] Это произошло всего через несколько лет после того, как первая мутация онкогена была обнаружена в первичной опухоли человека. Открытие связанной с метилированием инактивации гена фон Хиппеля-Линдау (VHL) возродило идею о том, что гиперметилирование промотора островка CpG является механизмом инактивации генов при раке. [ 3 ] рака Эпигенетическое молчание в его нынешнем состоянии зародилось в лабораториях Бэйлина и Джонса. [ 3 ] где было доказано, что гиперметилирование CpG-островков является распространенным механизмом инактивации гена-супрессора опухоли p16INK4a . Внедрение ПЦР, специфичной для метилирования , и модификации бисульфита натрия добавили инструменты в область исследований эпигенетики рака. [ 3 ] [ 4 ] и с тех пор список генов-кандидатов с аберрантным метилированием их CpG-островков растет. [ 5 ] Первоначально наличие изменений в профиле метилирования ДНК при раке рассматривалось как глобальное гипометилирование генома, приводящее к массовой сверхэкспрессии онкогенов с обычно гиперметилированным CpG-островком. [ 6 ] В последнее время это считается неполным сценарием, несмотря на то, что идея о том, что в геноме раковой клетки снижается содержание 5-метилцитозина по сравнению с родительской нормальной клеткой, верна. [ 5 ] В нормальных тканях подавляющее большинство CpG-островков, за некоторыми исключениями, полностью неметилированы. [ 1 ] Ассоциация подавления транскрипции генов-супрессоров опухолей с гиперметилированием является основой, на которой стоит это подмножество эпигенетики рака.
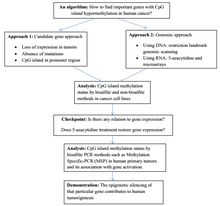
Структура
[ редактировать ]В нормальной клетке CpG гипометилирован . островок [ 7 ] а остальная часть генома метилирована. Очевидно, что гипометилирование CpG-островка в нормальных клетках не создает дополнительных стерических препятствий для будущего связывания. Большинство CpG у млекопитающих химически модифицированы путем ковалентного присоединения метильной группы к положению C5 цитозинового пар кольца. [ 8 ] Эта модификация распространяется по всему геному и подавляет транскрипцию. Островок CpG представляет собой цитозин и гуанин , связанные фосфатом в повторяющейся последовательности. Это генетические «горячие точки», поскольку они являются сайтами активного метилирования . Экспрессия гена тканеспецифична , что приводит к изменению функции ткани. Метилирование гена предотвращает экспрессию гена определенным образом.
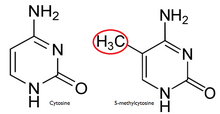
Причиной того, что метилирование почти исключительно для динуклеотидов CpG, является симметрия динуклеотида. Это позволяет сохраняться во время деления клеток и является признаком эпигенетических модификаций.

Роль в раке
[ редактировать ]Гиперметилированные CpG-островки могут играть три роли при раке: в диагностике , прогнозе и мониторинге . Полезно рассмотреть конкретный тип опухоли, называемый фенотипом метилатора островков CpG , или CIMP: при CIMP обнаруживаются более высокие уровни гиперметилирования островков CpG. Частое возникновение гиперметилирования впервые было описано при колоректальном раке , а затем и при глиоме . Совсем недавно его изучали при нейробластомах . Колоректальный рак не обязательно будет иметь тот же набор гиперметилированных CpG-островков, что и глиома, и эту клиническую особенность опухолей могут интерпретировать врачи. Гиперметилированные CpG-островки также действуют как биомаркеры , поскольку они могут помочь отличить рак от нормальных клеток в одном и том же образце.
Колоректальный CIMP был описан одним из первых. Пациенты с этой категорией рака, как правило, старше, женщины и имеют дефектную функцию MLH1 . Опухоли обычно локализуются в восходящей ободочной кишке. Они также имеют хороший прогностический результат. Клинически различные фенотипы CIMP также позволяют предположить, что существует потенциал для эпигенетической терапии .
При диагностике можно определить тип и подтип опухоли, а также ее первичную опухоль, если она неизвестна. Гиперметилирование увеличивается с ростом туморогенности , что является показателем прогноза рака. Например, высокое метилирование является маркером плохого прогноза при раке легких. Гиперметилирование CpG-островков перспективно для молекулярного мониторинга пациентов с раком, а также является потенциальной мишенью для терапевтического использования.

Нарушения эпигенетического контроля, наблюдаемые при раке, связаны с метилированием ДНК , которое может быть либо локус -специфическим гиперметилированием ДНК, либо гипометилированием ДНК по всему геному . Под локус-специфическим гиперметилированием ДНК происходит гиперметилирование CpG-островков . Метилирование ДНК действует как альтернатива генетической мутации . Согласно гипотезе Кнудсона , рак является результатом множественных воздействий на ДНК, и метилирование ДНК может быть одним из таких воздействий. Эпигенетические мутации, такие как метилирование ДНК, передаются по наследству митотически , но также обратимы, в отличие от генных мутаций. Идентичность гиперметилированных CpG-островков варьируется в зависимости от типа опухоли. Некоторые примеры отдельных генов включают MLH1 при колоректальном раке и BRCA1 при раке молочной железы .
Ссылки
[ редактировать ]- ^ Jump up to: а б Эстеллер М. (12 августа 2002 г.). «Гиперметилирование CpG-островков и гены-супрессоры опухолей: бурное настоящее, светлое будущее» . Онкоген . 21 (35): 5427–40. дои : 10.1038/sj.onc.1205600 . ПМИД 12154405 . ПроКвест 227311892 .
- ^ Грегер В., Пассарж Э., Хёппинг В., Мессмер Э., Хорстемке Б. (1 сентября 1989 г.). «Эпигенетические изменения могут способствовать формированию и спонтанной регрессии ретинобластомы». Генетика человека . 83 (2): 155–8. дои : 10.1007/BF00286709 . ПМИД 2550354 . S2CID 2058532 .
- ^ Jump up to: а б с Герман Дж.Г. , Латиф Ф., Венг Ю., Лерман М.И., Збар Б., Лю С., Самид Д., Дуан Д.С., Гнарра Дж.Р., Линехан В.М. (11 октября 1994 г.). «Замалчивание гена-супрессора опухолей VHL путем метилирования ДНК при раке почки» . Труды Национальной академии наук . 91 (21): 9700–4. Бибкод : 1994PNAS...91.9700H . дои : 10.1073/pnas.91.21.9700 . ПМК 44884 . ПМИД 7937876 .
- ^ Кларк Дж., Рокс П.Дж., Крю Эй.Дж., Гилл С., Шипли Дж., Чан А.М., Гастерсон Б.А., Купер К.С. (1 августа 1994 г.). «Идентификация новых генов, SYT и SSX, участвующих в транслокации t (X; 18) (p11.2; q11.2), обнаруженной при синовиальной саркоме человека». Природная генетика . 7 (4): 502–8. дои : 10.1038/ng0894-502 . ПМИД 7951320 . S2CID 20503729 .
- ^ Jump up to: а б Эстеллер М., Корн П.Г., Бэйлин С.Б. , Герман Дж.Г. (15 апреля 2001 г.). «Профиль гиперметилирования генов рака человека» . Исследования рака . 61 (8): 3225–9. ПМИД 11309270 .
- ^ Фейнберг А.П., Фогельштейн Б (1 июля 1983 г.). «Методика радиоактивной метки фрагментов эндонуклеазы рестрикции ДНК с высокой специфической активностью». Аналитическая биохимия . 132 (1): 6–13. дои : 10.1016/0003-2697(83)90418-9 . ПМИД 6312838 .
- ^ Университет Мельбурна, Coursera
- ^ Иллингворт Р.С., Bird AP (5 июня 2009 г.). «Острова CpG – приблизительный путеводитель » . Письма ФЭБС . 583 (11): 1713–20. дои : 10.1016/j.febslet.2009.04.012 . ПМИД 19376112 .