Бгл II
Эта статья может быть слишком технической для понимания большинства читателей . ( февраль 2012 г. ) |
| Эндонуклеаза рестрикции Bgl II | |||
|---|---|---|---|
 структура эндонуклеазы рестрикции Bst YI, связанной с неродственной ДНК | |||
| Идентификаторы | |||
| Символ | Эндонук- Bgl II | ||
| Пфам | PF09195 | ||
| Пфам Клан | CL0236 | ||
| ИнтерПро | ИПР015278 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1дфм / СКОПе / СУПФАМ | ||
| |||
Bgl II типа II представляет собой эндонуклеазу рестрикции , выделенную из некоторых штаммов Bacillus globigii .
Основная функция рестриктаз - защита генома хозяина от чужеродной ДНК , но они также могут участвовать в рекомбинации и транспозиции . [1]
Как и большинство ферментов рестрикции типа II, Bgl II состоит из двух идентичных субъединиц, которые образуют гомодимер вокруг двойной спирали ДНК. Каждый мономер состоит из 223 аминокислот и симметрично связывает обе стороны уникальной палиндромной нуклеотидной последовательности AGATCT, расщепляя разрезающую фосфодиэфирную связь между первыми нуклеотидами аденина и гуанина на обеих цепях молекулы ДНК, создавая липкие концы с выступающими 5'-концами.
Будучи ферментом рестрикции типа II, Bgl II не требует АТФ ( аденозинтрифосфата ) для своей ферментативной функции, а требует только ассоциации с катионом двухвалентного металла, скорее всего Mg. 2+ . в отличие от других ферментов рестрикции этого класса Bgl Было показано, что II обладает некоторыми уникальными структурными характеристиками, такими как β-сэндвич-субдомен, и, по-видимому, претерпевает уникальные конформационные изменения при димеризации. [2] но его общая структура и механизм катализа остаются соответствующими другим ферментам рестрикции типа II.
Эндонуклеазы рестрикции играют очень важную роль в современных методах молекулярного клонирования . Благодаря своим уникальным сайтам узнавания/разреза ферменты рестрикции можно использовать для точного разрезания ДНК в определенных местах предсказуемым образом. После разрезания ДНК (обычно) имеет так называемые « липкие концы », которые затем позволяют фрагменту ДНК гибридизоваться с вектором ДНК . Лигирующие ферменты используются для ковалентного связывания желаемого фрагмента с вектором для последующего клонирования ДНК.
| Идентификаторы | |
| Имя | Bgl Эндонуклеаза рестрикции II |
| Входить | 6173168 |
| ПДБ | 1ДФМ |
| № ПРИСОЕДИНЕНИЯ | Q45488 |
| Номер ЕС | 3.1.21.4 |
Механизм
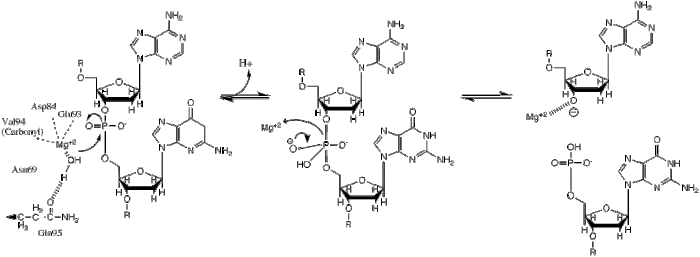
[ редактировать ]Bgl II катализирует расщепление фосфодиэфирной связи в основной цепи ДНК посредством переноса фосфорила в воду. [1] Исследования механизма ферментов рестрикции выявили несколько общих особенностей, которые кажутся верными почти во всех случаях, хотя фактический механизм каждого фермента, скорее всего, представляет собой некоторую вариацию этого общего механизма. Этот механизм требует основания для образования гидроксид-иона из воды, который будет действовать как нуклеофил и атаковать фосфор в фосфодиэфирной связи. Также необходима кислота Льюиса для стабилизации дополнительного отрицательного заряда пентакоординированного переходного состояния фосфора, а также обычная кислота или ион металла, который стабилизирует уходящую группу (3'-O − ).
Структура
[ редактировать ]
Хотя эндонуклеазы рестрикции демонстрируют небольшое сходство последовательностей, кристаллические структуры показывают, что все они имеют очень похожее ядро α/β, состоящее из шестинитевого β-листа, фланкированного пятью α-спиралями , две из которых опосредуют димеризацию. [1] Это ядро содержит активный центр (каталитический центр) и остатки, которые контактируют с ДНК в большой бороздке . Bgl II уникален тем, что его α/β-ядро дополнено субдоменом β-сэндвича, который имеет несколько выступов, которые простираются наружу и захватывают ДНК, что позволяет Bgl II полностью окружать молекулу ДНК. Эта нетипичная особенность Bgl II предполагает уникальное шарнирное движение для связывания и высвобождения ДНК. [2] Сравнительные структурные исследования свободного фермента по сравнению с комплексом Bgl II-ДНК показали, что фермент открывается резким ножницеобразным движением, сопровождающимся полной перестановкой α-спиралей на границе раздела димеров. Эти структурные исследования также показали, что внутри каждого мономера набор остатков понижается или повышается, альтернативно изолируя или обнажая остатки активного центра. Эти резкие различия в структуре свободного и связанного фермента еще не наблюдались ни у одной другой эндонуклеазы рестрикции и, возможно, представляют собой новый механизм захвата ДНК, который может распространяться на другие белки, окружающие ДНК. [2] [3]
Активный сайт
[ редактировать ]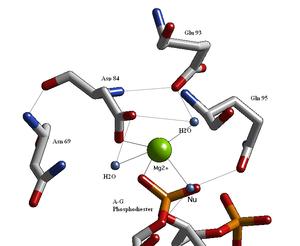
Структурные исследования эндонуклеаз выявили сходную архитектуру активного сайта с остатками, следующими за слабой консенсусной последовательностью Glu/Asp-(X) 9-20 -Glu/Asp/Ser-X-Lys/Glu. Активный сайт Bgl II аналогичен активному сайту других эндонуклеаз и соответствует последовательности Asp-(X) 9 -Glu-X-Gln. В его активном центре находится катион двухвалентного металла, скорее всего Mg. 2+ , который взаимодействует с Asp-84, Val-94, фосфорильным кислородом и тремя молекулами воды. Одна из этих молекул воды способна действовать как нуклеофил из-за своей близости к расщепленному фосфорилу (его ориентация фиксируется водородной связью с кислородом амида боковой цепи Gln-95). [1] [4] ) и его контакт с катионом металла (который снижает его pK a , способствуя нуклеофильности воды).
См. также
[ редактировать ]- BamHI , фермент нуклеаза Bacillus amyloliquefaciens.
- FokI , a nuclease enzyme from Flavobacterium okeanokoites
- EcoRI , фермент нуклеаза из E. coli.
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж Лукач С.М., Кучера Р., Шильдкраут И., Аггарвал А.К. (февраль 2000 г.). «Понимание неизменности ферментов рестрикции: кристаллическая структура BglII и его ДНК-субстрата с разрешением 1,5 А». Структурная биология природы . 7 (2): 134–40. дои : 10.1038/72405 . ПМИД 10655616 . S2CID 20478739 .
- ^ Jump up to: а б с Лукач С.М., Кучера Р., Шильдкраут И., Аггарвал А.К. (февраль 2001 г.). «Структура свободного BglII демонстрирует беспрецедентное ножницеобразное движение для открытия эндонуклеазы». Структурная биология природы . 8 (2): 126–30. дои : 10.1038/84111 . ПМИД 11175900 . S2CID 25488558 .
- ^ Гальбурт Э.А., Стоддард Б.Л. (февраль 2000 г.). «Эндонуклеазы рестрикции: одна из этих вещей не похожа на другие». Структурная биология природы . 7 (2): 89–91. дои : 10.1038/72450 . ПМИД 10655603 . S2CID 26817049 .
- ^ Jump up to: а б Пингуд А., Йельч А. (сентябрь 2001 г.). «Структура и функции эндонуклеаз рестрикции II типа» . Исследования нуклеиновых кислот . 29 (18): 3705–27. дои : 10.1093/нар/29.18.3705 . ПМК 55916 . ПМИД 11557805 .