Полигалогенские ионы
Ионы полигагенов представляют собой группу полиатомных катионов и анионов, содержащих только галогены . Ионы могут быть классифицированы на два класса, ионы изополигагена, которые содержат только один тип галогена, и ионы гетерополигагена с более чем одним типом галогена.
Введение
[ редактировать ]Были обнаружены многочисленные ионы полигагенов с их солями, выделенными в твердом состоянии и структурно охарактеризованы. Следующие таблицы суммируют известные виды. [ 1 ] [ 2 ] [ 3 ] [ 4 ] [ 5 ] [ 6 ]
| Диатомные виды | * [CL 2 ] + , Br 2 ] + , [I 2 ] + |
| ТРИАТОМИЧЕСКИЙ ВИД | [CL 3 ] + , [Br 3 ] + . + |
| Тетраатомические виды | [CL 4 ] + . 2+ |
| Пентаатомические виды | [Br 5 ] + , [I 5 ] + |
| Гептаатомические виды | † [I 7 ] + |
| Высшие виды | [I 15 ] 3+ |
* [CL 2 ] + может существовать только как [CL 2 O 2 ] 2+ При низких температурах заряда комплекс переноса O 2 до [CL 2 ] + . [ 2 ] Бесплатно [CL 2 ] + известен только из его электронного диапазона спектра, полученного в пробирке разгрузки низкого давления. [ 3 ]
† Существование [I 7 ] + возможно, но все еще неуверенный. [ 1 ]
| ТРИАТОМИЧЕСКИЙ ВИД | [CLF 2 ] + , [Cl 2 f] + , [BRF 2 ] + , [Если 2 ] + , [ICL 2 ] + , [Ibrcl] + , [IRR 2 ] + , [I 2 cl] + , [I 2 br] + |
| Пентаатомические виды | [CLF 4 ] + , [BRF 4 ] + , [Если 4 ] + , [I 3 Cl 2 ] + |
| Гептаатомические виды | [CLF 6 ] + , [BRF 6 ] + , [Если 6 ] + |
| ТРИАТОМИЧЕСКИЙ ВИД | [CL 3 ] − , [Br 3 ] − . − |
| Тетраатомические виды | [BR 4 ] 2− . 2− |
| Пентаатомические виды | [I 5 ] − |
| Гептаатомические виды | [I 7 ] − |
| Октаатомические виды | [BR 8 ] 2− , [I 8 ] 2− |
| Высшие виды | [I 9 ] − , [I 10 ] 2− , [I 10 ] 4− , [I 11 ] − , [I 12 ] 2− , [I 13 ] 3− , [I 16 ] 2− , [I 22 ] 4− , [I 26 ] 3− , [I 26 ] 4− , [I 28 ] 4− , [I 29 ] 3− |
| ТРИАТОМИЧЕСКИЙ ВИД | [CLF 2 ] − , [BRF 2 ] − , [BRCL 2 ] − , [Если 2 ] − , [ICL 2 ] − , [Ibrf] − , [Ibrcl] − , [IRR 2 ] − , [I 2 cl] − , [I 2 br] − , [Atbrcl] − , [Удаляет 2 ] − , [Aticl] − , [Atibr] − , [Ati 2 ] − |
| Пентаатомические виды | [CLF 4 ] − , [BRF 4 ] − , [Если 4 ] − , [ICL 3 F] − , [ICL 4 ] − , [Ibrcl 3 ] − , [I 2 Cl 3 ] − , [I 2 Brcl 2 ] − , [I 2 Br 2 Cl] − , [I 2 Br 3 ] − , [I 4 Cl] − , [I 4 Br] − |
| Гексаатомические виды | [Если 5 ] 2− |
| Гептаатомические виды | [CLF 6 ] − , [BRF 6 ] − , [Если 6 ] − , [I 3 Br 4 ] − |
| Неатомические виды | [Если 8 ] − |
Структура
[ редактировать ]
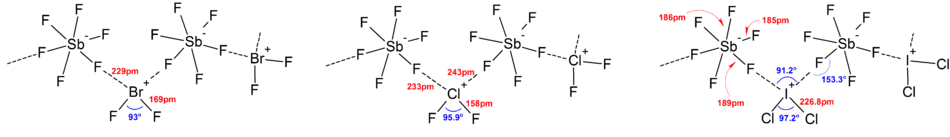

Большинство структур ионов определялись с помощью ИК-спектроскопии , спектроскопии комбинационного рамана и рентгеновской кристаллографии . Полигалогенские ионы всегда имеют самый тяжелый и наименее электроотрицательный галоген, присутствующий в ионе в качестве центрального атома, что делает ионный асимметричный в некоторых случаях. Например, [CL 2 F] + имеет структуру [Cl - cl - f] − но нет [Cl - f - cl] − .
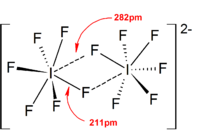
В целом, структуры большинства ионов гетерополигагенов и более низких ионов изополигагенов соответствовали модели VSEPR . Однако были исключительные случаи. Например, когда центральный атом тяжелый и имеет семь одиноких пар , например, как [BRF 6 ] − и [EF 6 ] − Они имеют регулярное октаэдрическое расположение фторидных лигандов вместо искаженного из -за присутствия стереохимически инертной одинокой пары . Больше отклонений от идеальной модели VSEPR были обнаружены в структурах твердого состояния из-за сильных катион-анионных взаимодействий, что также усложняет интерпретацию вибрационных спектроскопических данных. Во всех известных структурах солей полигагеновых анионов анионы вносят очень близкий контакт через галогенные мостики с противоречиями. [ 4 ] Например, в твердом состоянии, [EF 6 ] − не является регулярным октаэдрическим, как структура твердого состояния [(Ch 3 ) 4 N] + [EF 6 ] − раскрывает свободно связанную [I 2 f 11 ] 2− димперс. Значительные взаимодействия катион-анионов также были обнаружены в [BRF 2 ] + [SBF 6 ] − , [CLF 2 ] + [SBF 6 ] − , [BRF 4 ] + [SB 6 F 11 ] − . [ 2 ]
| Линейный (или почти линейный) | [CLF 2 ] − , [BRF 2 ] − , [BRCL 2 ] − , [Если 2 ] − , [ICL 2 ] − , [IRR 2 ] − , [I 2 cl] − , [I 2 br] − |
| Наклонный | [CLF 2 ] + , [Cl 2 f] + , [BRF 2 ] + , [Если 2 ] + , [ICL 2 ] + , [I 2 cl] + , [IRR 2 ] + , [I 2 br] + , [Ibrcl] + |
| Квадратный плоский | [CLF 4 ] − , [BRF 4 ] − , [Если 4 ] − , [ICL 4 ] − |
| Дисфеноидальный (или качели) | [CLF 4 ] + , [BRF 4 ] + , [Если 4 ] + |
| Пентагональный плоский | ‡ [Если 5 ] 2− |
| Октаэдральный | [CLF 6 ] + , [BRF 6 ] + , [Если 6 ] + , ¶ [CLF 6 ] − , [BRF 6 ] − , [Если 6 ] − |
| Квадратный антипризматический | [Если 8 ] − |
‡ [Если 5 ] 2− один из двух Виды Xy N -типа, известный, имеют редкую пентагонную плоскую геометрию, другой [XEF 5 ] − .
¶ [CLF 6 ] − является искаженным октаэдрическим, так как стереохимический эффект инертной пары не является значимым в атоме хлора.
А [I 3 Cl 2 ] + и [I 3 Br 2 ] + Ионы имеют структуру транс -z теку , аналогичную [I 5 ] + .
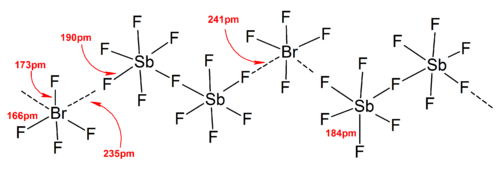
Более высокие полиодиды
[ редактировать ]Полиодидные ионы имеют гораздо более сложные структуры. Дискретные полиодиды обычно имеют линейную последовательность атомов йода и йодидных ионов и описаны в терминах связи между Я 2 , я − и [I 3 ] − единицы, которые отражают происхождение полиодида. В твердых состояниях полиодиды могут взаимодействовать друг с другом, образуя цепочки, кольца или даже сложные двумерные и трехмерные сети.
Связывание
[ редактировать ]Связь в ионах полигагена в основном вызывает преобладающее использование P -орбиталей. Значительное участие D-Orbital в связующей среде невероятно, так как потребуется много рекламной энергии, в то время как в видах, содержащих йод, ожидается скудное участие в S-Orbital из-за эффекта инертной пары , предложенные данными спектроскопии Mössbauer . Тем не менее, модель связывания не была способна воспроизводить такой широкий диапазон длины связей и углов, наблюдаемых до сих пор. [ 3 ]
Как и ожидалось из того факта, что электрон удаляется из орбиты антибондирования, когда X 2 ионизируется на [X 2 ] + , порядок облигаций , а также сила связи в [X 2 ] + Следовательно, становятся все выше, межатомные расстояния в молекулярном ионе меньше, чем в X 2 .
Линейные или почти линейные триатомные полигалиды имеют более слабые и более длинные связи по сравнению с таковой в соответствующем диатомном межгагеном или галогене, что согласуется с дополнительным отталкиванием между атомами в качестве иона галогенида к нейтральной молекуле. Например, существует другая модель, включающая использование резонансной теории , например, [ICL 2 ] − можно рассматривать как резонансный гибрид следующих канонических форм :

Доказательства, подтверждающие эту теорию, исходят из длины связей (255 вечера в [ICL 2 ] − и 232 вечера в ICL связи (g)) и растягивании (267 и 222 см −1 для симметричного и асимметричного растяжения в [ICL 2 ] − по сравнению с 384 см −1 в ICL), который предполагает порядок связи около 0,5 для каждой связи I -CL в [ICL 2 ] − , в соответствии с интерпретацией с использованием резонансной теории. Другие триатомные виды [Xy 2 ] − может быть аналогично интерпретироваться. [ 2 ]
Несмотря на то, что они имеют пониженный порядок связи, все три атома галогена тесно связаны. Фтор-флюориновая связь трифторида с порядком связи 0,5 имеет силу связи составляет 30 ккал/моль, всего на 8 ккал/моль меньше, чем фторино-флюориновая связь в дифлюорине , порядок связи которого составляет 1. [ 7 ]
Синтез
[ редактировать ]Образование ионов полигагенов можно рассматривать как самоосудиацию их родительских интеркалогенов или галогенов :
- 2 xy n ⇌ [xy n -1 ] + + [Xy n +1 ] −
- 3 x 2 ⇌ [x 3 ] + + [X 3 ] −
- 4 x 2 ⇌ [x 5 ] + + [X 3 ] −
- 5 x 2 ⇌ 2 [x 2 ] + + 2 [x 3 ] −
Полигагеновые катионы
[ редактировать ]Существует две общие стратегии для подготовки полигагеновых катионов:
- Реагируя соответствующий интергалоген с кислотой Льюиса (такой как галогениды B , Al , P , As , Sb ) либо в инертно, либо в окисляющем растворителе (таких как безводный HF ), либо без одного, чтобы получить гетерополихалогенный катион.
- Xy n + my m → [xy n -1 ] + + [MY m +1 ] −
- Путем окислительного процесса, при котором галоген или межгалоген реагируют с окислителем и кислотой Льюиса, чтобы получить катион:
- CL 2 + CLF + ASF 5 → [CL 3 ] + [ASF 6 ] −
В некоторых случаях кислота Льюиса ( акцептор фтора ) действует как окислитель:
- 3 I 2 + 3 SBF 5 → 2 [I 3 ] + [SBF 6 ] − + SBF 3
Обычно первый метод используется для подготовки гетерополихалогенных катионов, а второй применим к обоим. Окислительный процесс полезен при приготовлении катионов [IBR 2 ] + , [CLF 6 ] + , [BRF 6 ] + , как их родительские мегалогены, IBR 3 , CLF 7 , BRF 7 соответственно, никогда не был изолирован:
- Br 2 + ioso 2 f → [ibr 2 ] + [SO 3 F] −
- 2 CLF 5 + 2 PTF 6 → [CLF 6 ] + [PTF 6 ] − + [CLF 4 ] + [PTF 6 ] −
- BRF 5 + [KRF] + [ASF 6 ] − → [BRF 6 ] + [ASF 6 ] − + Kr
Подготовка некоторых отдельных видов кратко суммирована в таблице ниже с уравнениями: [ 1 ] [ 2 ] [ 3 ] [ 4 ]
| Разновидность | Соответствующее химическое уравнение | Требуются дополнительные условия |
|---|---|---|
| [CL 2 ] + (как [CL 2 O 2 ] + ) | Cl 2 + [O 2 ] + [SBF 6 ] − → [CL 2 O 2 ] + [SBF 6 ] − | в безводном HF при низких температурах |
| [BR 2 ] + | Br 2 (в Brso 3 F) + 3 SBF 5 → [BR 2 ] + [SB 3 F 16 ] − (не сбалансирован) | при комнатной температуре |
| [I 2 ] + | 2 i 2 + s 2 o 6 f 2 → 2 [i 2 ] + [SO 3 F] − | в HSO 3 ф |
| [CL 3 ] + | CL 2 + CLF + ASF 5 → [CL 3 ] + [ASF 6 ] − | При температуре 195 К (-78 ° С) |
| [BR 3 ] + | 3 Br 2 + 2 [O 2 ] + [ASF 6 ] − → 2 [Br 3 ] + [ASF 6 ] − + 2 O 2 | |
| [I 3 ] + | 3 I 2 + S 2 O 6 F 2 → 2 [I 3 ] + [SO 3 F] − | |
| [CL 4 ] + | 2 CL 2 + IRF 6 → [CL 4 ] + [IRF 6 ] − | в безводном HF при температуре ниже 193 К (-80 ° C) |
| [I 4 ] 2+ | 2 i 2 + 3 asf 5 → [i 4 ] 2+ [ASF 6 ] - 2 + ASF 3 | в жидкости Итак , 2 |
| [Br 5 ] + | 8 Br 2 + 3 [XEF] + [ASF 6 ] − → 3 [Br 5 ] + [ASF 6 ] − + 3 машины + BRF 3 | |
| [I 5 ] + | 2 i 2 + icl + alcl 3 → [i 5 ] + [ALCL 4 ] − | |
| [I 7 ] + | 7 I 2 + S 2 O 6 F 2 → 2 I 7 SO 3 F | |
| [CLF 2 ] + | CLF 3 + ASF 5 → [CLF 2 ] + [ASF 6 ] − | |
| [CL 2 F] + | 2 CLF + ASF 5 → [CL 2 F] + [ASF 6 ] − | При температуре ниже 197 К |
| [BRF 2 ] + | 5 BRF 3 + 2 AU → 3 BRF + 2 [BRF 2 ] + [AUF 4 ] − | с избытком BRF 3 требуется |
| [Если 2 ] + | Если 3 + asf 5 → [Если 2 ] + [ASF 6 ] − | |
| [ICL 2 ] + | ICL 3 + SBCL 5 → [ICL 2 ] + [SBCL 6 ] − | |
| [IBR 2 ] + | Br 2 + ioso 2 f → [ibr 2 ] + [SO 3 F] − | |
| [CLF 4 ] + | CLF 5 + SBF 5 → [CLF 4 ] + [SBF 6 ] − | |
| [BRF 4 ] + | BRF 5 + ASF 5 → [BRF 4 ] + [ASF 6 ] − | |
| [Если 4 ] + | Если 5 + 2 SBF 5 → [Если 4 ] + [SB 2 F 11 ] − | |
| [CLF 6 ] + | ‡ CS 2 [NIF 6 ] + 5 ASF 5 + CLF 5 → [CLF 6 ] + [ASF 6 ] − + Ni [ASF 6 ] 2 + 2 CS [ASF 6 ] | |
| [BRF 6 ] + | [KRF] + [ASF 6 ] − + BRF 5 → [BRF 6 ] + [ASF 6 ] − + Kr | |
| [EF 6 ] + | Если 7 + brf 3 → [Если 6 ] + [BRF 4 ] − [ сомнительно - обсудить ] |
‡ В этой реакции активные окислительные виды [NIF 3 ] + , который сформирован на месте в CS 2 [NIF 6 ] / ASF 5 /HF -система. Это еще более мощный окислительный и фторирующий агент, чем PTF 6 .
Полигалогенские анионы
[ редактировать ]Для полигагеновых анионов также есть две общие стратегии подготовки:
- Реагируя межгалоген или галоген с основанием Льюиса , скорее всего, фторид:
- [(CH 3 Ch 2 ) 4 N] + И − + Xy n → [(ch 3 ch 2 ) 4 n] + [Xy n +1 ] −
- X 2 + x − → [x 3 ] −
- Путем окисления простых галогенидов :
- Ki + cl 2 → k + [ICL 2 ] −
Подготовка некоторых отдельных видов кратко суммирована в таблице ниже с уравнениями: [ 1 ] [ 2 ] [ 3 ] [ 4 ]
| Разновидность | Соответствующее химическое уравнение | Требуются дополнительные условия |
|---|---|---|
| [CL 3 ] − , [Br 3 ] − . − | X 2 + x − → [x 3 ] − (X = cl, br, i) | |
| [BR 3 ] − | Br 2 + [(ch 3 ch 2 ch 2 ch 2 ) 4 n] + Бренд − → [(CH 3 CH 2 CH 2 CH 2 ) 4 N] + [BR 3 ] − | в 1,2-дихлорэтана или жидкости диоксиде . [BR 3 ] − не существует в растворе и образуется только тогда, когда соль кристаллизуется. |
| [Br 5 ] − | 2 Br 2 + [(CH 3 CH 2 CH 2 CH 2 ) 4 N] + Бренд − → [(CH 3 CH 2 CH 2 CH 2 ) 4 N] + [Br 5 ] − | в диоксиде 1,2-дихлорэтана или жидкости, с избытком Br 2 |
| [CLF 2 ] − | CLF + CSF → CS + [CLF 2 ] − | |
| [BRCL 2 ] − [ 8 ] : v1p294 | Br 2 + cl 2 + 2 cscl → 2 cs + [BRCL 2 ] − | |
| [ICL 2 ] − [ 8 ] : v1p295 | Ki + cl 2 → k + [ICL 2 ] − | |
| [IBR 2 ] − [ 8 ] : v1p297 | CSI + BR 2 → CS + [IBR 2 ] − | |
| [Удаляет 2 ] − , [Aticl] − , [Atibr] − , [Ati 2 ] − | В y + x − → [Atxy] − (X = i, br, cl; y = i, br) | |
| [CLF 4 ] − | Nof + clf 3 → [нет] + [CLF 4 ] − | |
| [BRF 4 ] − | 6 KCl + 8 BRF 3 → 6 K + [BRF 4 ] − + 3 Cl 2 + Br 2 | избыток BRF 3 нужен |
| [Если 4 ] − | 2 XEF 2 + [(Ch 3 ) 4 N] + я − → [(Ch 3 ) 4 N] + [Если 4 ] − + 2 машины | Реагенты смешивали при 242 К, затем нагревали до 298 К для реакции, чтобы продолжить |
| [ICL 4 ] − [ 8 ] : v1p298 | Ki + icl 3 → k + [ICL 4 ] − | |
| [Если 5 ] 2− | Если 3 + 2 [(ch 3 ) 4 n] + Фон − → [(Ch 3 ) 4 N + ] 2 [если 5 ] 2− | |
| [EF 6 ] − | cs Если 5 + csf → + [EF 6 ] − | |
| [I 3 Br 4 ] − | PH 4 P] + Бренд − + 3 IBR → [PH 4 P] + [I 3 Br 4 ] − | |
| [Если 8 ] − | Если 7 + [(ch 3 ) 4 n] + Фон − → [(Ch 3 ) 4 N] + [Если 8 ] − | в ацетонитриле |
Более высокие полиодиды образовали при кристаллизации растворов, содержащих различные концентрации я − и Я 2 . Например, моногидрат K + [I 3 ] − кристаллизуется, когда насыщенное решение, содержащее соответствующие количества Я 2 и Ки охлаждены. [ 8 ] : v1p294
Характеристики
[ редактировать ]Стабильность
[ редактировать ]В целом, большой встречный катион или анион (например CS + и [SBF 6 ] − ) может помочь стабилизировать ионы полигагенов, образованные в твердом состоянии, от энергетических соображений решетки, поскольку эффективность упаковки увеличивается.
Полигалогенские катионы являются сильными окисливающими агентами, о чем свидетельствует тот факт, что они могут быть получены только в окислительных жидкостях в качестве растворителя, таких как олеум . Наиболее окисляющими и, следовательно, наиболее нестабильными являются виды [X 2 ] + и [XF 6 ] + (X = cl, br), затем [X 3 ] + и [EF 6 ] + .
Стабильность [X 2 ] + Соли (x = br, i) являются термодинамически довольно стабильными. Тем не менее, их стабильность в решении зависит от растворителя супруга . Например, [I 2 ] + стабилен в фторуантонической кислоте (HF с 0,2 Н SBF 5 , H 0 = -20,65), но непропорционально [I 3 ] + , [I 5 ] + и Я 2, когда более слабые акцепторы фторида, как NBF 5 , TAF 5 или NAF , добавляются вместо SBF 5 . [ 4 ]
- 14 [i 2 ] + + 5 ф − → 9 [i 3 ] + + Если 5
Для полигагеновых анионов с одинаковым количеством атомов более стабильными являются анифрованные с более тяжелым галогеном в центре, симметричные ионы также более стабильны, чем асимметричные. Следовательно, стабильность анионов уменьшается в порядке:
- [I 3 ] − > [Ibr 2 ] − > [ICL 2 ] − > [I 2 br] − > [Br 3 ] − > [Brcl 2 ] − > [Br 2 cl] −
Гетерополихалогенные ионы с координационным номером, превышающим или равным четырем, могут существовать только с фторидными лигандами.
Цвет
[ редактировать ]Большинство ионов полигагенов интенсивно окрашены, с углубленным цветом по мере увеличения атомного веса компонентного элемента. Из хорошо известного комплекса крахмала есть глубокий синий цвет из -за линейного [I 5 ] − Ионы, присутствующие в амилозной спирали. [ 4 ] Некоторые цвета общих видов были перечислены ниже: [ 3 ]
- Флуорокации имеют тенденцию быть бесцветными или бледно -желтыми, другие гетерополихалогенные ионы - оранжевые, красные или темно -фиолетовые [ 4 ]
- соединения [ICL 2 ] + вино красное до ярко -оранжевого; в то время как это [I 2 cl] + темно -коричневые или пурпурные черные
- [CL 3 ] + желтый
- [CL 4 ] + синий [ 2 ]
- [BR 2 ] + вишневый красный
- [BR 3 ] + коричневый
- [Br 5 ] + темно -коричневый
- [I 2 ] + Ярко -синий
- [I 3 ] + темно -коричневый до черного
- [I 4 ] 2+ красный и коричневый
- [I 5 ] + зеленый или черный, соль [I 5 ] + [ALCL 4 ] − существует как зеленовато-черные иглы, но кажутся коричнево-красными в тонких секциях
- [I 7 ] + черный, если его существование в соединении [I 7 ] + [SO 3 F] − был прочно установлен
- [I 15 ] 3+ черный [ 5 ]
- [ICL 2 ] − алый красный
- [ICL 4 ] − золотисто-желтый
- Полиодиды имеют очень темные цвета, темно -коричневые или темно -синие
Химические свойства
[ редактировать ]Гетерополихалогенные катионы представляют собой взрывчатые реактивные окислители, а катионы часто имеют более высокую реакционную способность, чем их родительские мегалогены и разлагаются по восстановительным путям. Как и ожидалось от самого высокого уровня окисления +7 в [CLF 6 ] + , [BRF 6 ] + и [EF 6 ] + , эти виды являются чрезвычайно сильными окислителями, продемонстрированными реакциями, показанными ниже:
- 2 O 2 + 2 [BRF 6 ] + [ASF 6 ] − → 2 [O 2 ] + [ASF 6 ] − + 2 BRF 5 + F 2
- Rn + [если 6 ] + [SBF 6 ] − → [RNF] + [SBF 6 ] − + Если 5
Полигалогенские катионы с более низкими состояниями окисления имеют тенденцию к непропорциональному . Например, [CL 2 F] + нестабильна в растворе и полностью непропорционально в HF/ SBF 5 Смесь Даже при 197 К:
- 2 [CL 2 F] + → [CLF 2 ] + + [CL 3 ] +
[I 2 ] + обратимо димеризуется при 193 К и наблюдается как синий цвет парамагнитного [I 2 ] + резко переходит к красно-коричневому цвету диамагнитного [I 2 ] + , вместе с падением парамагнитной восприимчивости и электрической проводимости при охлаждении раствора до 193 К: [ 2 ]
- 2 [i 2 ] + ⇌ [i 4 ] 2+
Димеризация может быть связана с перекрытием наполовину заполненных π* орбиталей в двух [I 2 ] + .
[CL 4 ] + в [CL 4 ] + [IRF 6 ] − структурно аналогичен [I 4 ] 2+ , но разлагается на 195 К, чтобы дать Cl 2 , и соли [CL 3 ] + вместо [CL 2 ] + . [ 2 ]
Попытки подготовиться CLF 7 и BRF 7 по фторированию [CLF 6 ] + и [BRF 6 ] + Использование NOF встретилось с отказом, потому что произошли следующие реакции: [ 3 ]
- [CLF 6 ] + [PTF 6 ] − + Nof → [Нет] + [PTF 6 ] − + CLF 5 + F 2
- [BRF 6 ] + [ASF 6 ] − + 2 nof → [Нет] + [ASF 6 ] − + [Нет] + [BRF 6 ] − + F 2
Анионы менее реактивны по сравнению с катионами и, как правило, являются более слабыми окислителями, чем их родительские мегалогены. Они менее реагируют на органические соединения, а некоторые соли имеют довольно высокую тепловую стабильность. Соли, содержащие полигагеновые анионы типа М + [X m y n z p ] − , где m + n + p = {3, 5, 7, 9 ...}, имеет тенденцию диссоциации на простые моногалидные соли между М + и самый электроотрицательный галоген, так что моногалид имеет самую высокую энергию решетки. Межгалоген обычно формируется в качестве другого продукта. Соль [(Ch 3 ) 4 N] + [CLF 4 ] − разлагается примерно на 100 ° C, и соли [CLF 6 ] − термически нестабильны и могут взорваться даже при -31 ° C. [ 4 ]
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а беременный в дюймовый Кинг, Р. Брюс (2005). «Хлор, Бром, йод и астатин: неорганическая химия». Энциклопедия неорганической химии (2 -е изд.). Уайли. п. 747. ISBN 9780470862100 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Housecroft, Кэтрин Э.; Шарп, Алан Г. (2008). «Глава 17: Элементы группы 17». Неорганическая химия (3 -е изд.). Пирсон. п. 547. ISBN 978-0-13-175553-6 .
- ^ Jump up to: а беременный в дюймовый и фон глин Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2 -е изд.). Баттерворт-Хейнеманн . п. 835. ISBN 978-0-08-037941-8 .
- ^ Jump up to: а беременный в дюймовый и фон глин час Коттон, Ф. Альберт; Уилкинсон, Джеффри; Мурильо, Карлос А.; Бохманн, Манфред (1999). Усовершенствованная неорганическая химия (6 -е изд.). Уайли. ISBN 978-0471199571 .
- ^ Jump up to: а беременный Wiberg, Egon; Wiberg, Nils; Холман, Арнольд Фредерик (2001). Неорганическая химия . Академическая пресса. С. 419–420. ISBN 0-12-352651-5 .
- ^ Сонненберг, Карстен; Человек, Лиза; Redeker, Frenio A.; Шмидт, Бенджамин; Ридель, Себастьян (2020-02-04). «Полигалогены и полиинтер -галогенные анионы от фтора до йода» . Applied Chemistry International Edition . 59 (14): 5464–5493. Doi : 10.1002/ani.201903197 . ISSN 1433-7851 . PMID 31090163 . S2CID 155093006 .
- ^ Брайда, Бенуа; Хиберти, Филипп С. (2004). "То, что делает трифторидный анион F 3 – Такой особенный? Дыхательная орбитальная валентная связь Ab initio исследование " (PDF) . J. Am. Chem. Soc . 126 (45): 14890–14898. : 10.1021 /ja046443a . PMID 15535716. . S2CID 23159174 DOI
- ^ Jump up to: а беременный в дюймовый и Брауэр, Г., изд. (1963). Справочник по подготовительной неорганической химии (2 -е изд.). Нью -Йорк: Академическая пресса.