Вириальное расширение
В этой статье есть несколько проблем. Пожалуйста, помогите улучшить его или обсудите эти проблемы на странице обсуждения . ( Узнайте, как и когда удалять эти шаблонные сообщения )
|
| Статистическая механика |
|---|
 |
Вириальное расширение представляет собой модель термодинамических уравнений состояния . Он выражает давление P газа в локальном равновесии как ряд плотности степенной . представить через коэффициент сжимаемости Z как Это уравнение можно Это уравнение было впервые предложено Камерлингом-Оннесом . [1] Члены A , B и C представляют вириальные коэффициенты . Старший коэффициент A определяется как постоянное значение 1, что гарантирует, что уравнение сводится к выражению идеального газа , когда плотность газа приближается к нулю.
Второй и третий вириальные коэффициенты
[ редактировать ]Второй, B , и третий, C , вириальные коэффициенты широко изучались и сводились в таблицы для многих жидкостей уже более столетия. Два самых обширных сборника находятся в книгах Даймонда. [2] [3] и Национального института стандартов и технологий. база данных Thermo Data Engine [4] и его веб-термотаблицы. [5] В эти сборники включены таблицы вторых и третьих вириальных коэффициентов многих жидкостей.
Приведение уравнений состояния к вириальной форме
[ редактировать ]Большинство уравнений состояния можно переформулировать и преобразовать в вириальные уравнения, чтобы оценить и сравнить их неявные второй и третий вириальные коэффициенты. Основополагающее Ван дер Ваальса уравнение состояния [6] было предложено в 1873 году: где v = 1/ ρ — мольный объем. Его можно переставить, разложив 1/( v − b ) в ряд Тейлора :
В уравнении Ван-дер-Ваальса второй вириальный коэффициент ведет себя примерно правильно, поскольку он монотонно убывает при понижении температуры. Третий и более высокие вириальные коэффициенты не зависят от температуры и неверны, особенно при низких температурах.
Почти все последующие уравнения состояния выводятся из уравнения Ван-дер-Ваальса, как и уравнения Дитеричи: [7] Бертло, [8] Редлих Квонг, [9] и Пэн-Робинсон [10] страдают от особенности, вносимой 1/(v - b) .
Другие уравнения состояния, начатые Битти и Бриджменом, [11] более тесно связаны с вириальными уравнениями и более точно отражают поведение жидкостей как в газообразной, так и в жидкой фазах. [ нужна ссылка ] Уравнение состояния Битти-Бриджмена, предложенное в 1928 году: где
можно переставить как Уравнение состояния Бенедикта-Уэбба-Рубина [12] 1940 года представляет собой лучшие изотермы ниже критической температуры:
Больше улучшений было достигнуто Старлингом [13] в 1972 году:
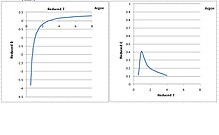
Ниже приведены графики приведенных второго и третьего вириальных коэффициентов в зависимости от пониженной температуры по Старлингу: [13]

Экспоненциальные члены в последних двух уравнениях корректируют третий вириальный коэффициент, так что изотермы в жидкой фазе могут быть представлены правильно. Экспоненциальный член быстро сходится по мере увеличения ρ, и если взять только первые два члена в его ряду Тейлора, , и умноженный на , результат , что способствует член к третьему вириальному коэффициенту и один член к восьмому вириальному коэффициенту, которым можно пренебречь. [ оригинальное исследование? ]
После разложения экспоненциальных членов уравнения состояния Бенедикта-Уэбба-Рубина и Старлинга имеют следующий вид:
Кубическое вириальное уравнение состояния
[ редактировать ]Трехчленное вириальное уравнение или кубическое вириальное уравнение состояния имеет простоту уравнения состояния Ван дер Ваальса без сингулярности при v = b . Теоретически второй вириальный коэффициент представляет собой бимолекулярные силы притяжения, а третий вириальный член представляет собой силы отталкивания между тремя молекулами, находящимися в тесном контакте. [ нужна ссылка ]
С помощью этого кубического вириального уравнения коэффициенты B и C можно решить в замкнутой форме. Наложение критических условий: кубическое уравнение вириала можно решить и получить: и следовательно, составляет 0,333 по сравнению с 0,375 из уравнения Ван-дер-Ваальса.
Между критической точкой и тройной точкой находится область насыщения флюидами. В этой области газовая фаза сосуществует с жидкой фазой под давлением насыщения. , а температура насыщения . Под давлением насыщения жидкая фаза имеет молярный объем , а газообразная фаза имеет молярный объем . Соответствующие молярные плотности равны и . Это свойства насыщения, необходимые для вычисления второго и третьего вириальных коэффициентов.
Действительное уравнение состояния должно давать изотерму, пересекающую горизонтальную линию в и , на . [ нужна ссылка ] Под и , газ находится в равновесии с жидкостью. Это означает, что изотерма PρT имеет три корня при . Кубическое вириальное уравнение состояния при является: Его можно переставить так: Фактор - это объем насыщенного газа согласно закону идеального газа, которому может быть присвоено уникальное имя. : В области насыщения кубическое уравнение имеет три корня и альтернативно может быть записано как: который можно расширить как: представляет собой объем неустойчивого состояния между и . Кубические уравнения идентичны. Следовательно, из линейных членов в этих уравнениях можно решить: Из квадратичных членов B можно решить: А из кубических членов C можно решить: С , и были сведены в таблицы для многих жидкостей с В качестве параметра B и C можно рассчитать в области насыщения этих жидкостей. Результаты в целом согласуются с результатами, рассчитанными на основе уравнений состояния Бенедикта-Уэбба-Рубина и Старлинга. [ нужна ссылка ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Камерлинг Оннес Х., Выражение состояния газов и жидкостей с помощью серий, KNAW Proceedings, 4, 1901–1902, Амстердам, 125–147 (1902).
- ^ Даймонд Дж. Д., Уилхойт Р. К., Вириальные коэффициенты чистых газов и смесей, Springer (2003).
- ^ Даймонд Дж. Х., Смит Э. Б., Вириальные коэффициенты чистых газов и смесей. Критический сборник, Oxford University Press, 1-е издание (1969 г.), 2-е издание (1980 г.).
- ^ «Двигатель Термоданных» .
- ^ «Сетевые термотаблицы NIST/TRC (WTT): критически оцененные данные о теплофизических свойствах» .
- ^ Ван дер Ваальс Дж. Д., О непрерывности газообразного и жидкого состояний (Докторская диссертация). Лейденский университет (1873 г.).
- ^ Дитеричи (7), К. Дитеричи, Энн. Физ. хим. Видеманс Анн. 69, 685 (1899).
- ^ Д. Бертло, Д., в трудах и мемуарах Международного бюро мер и весов - Том XIII (Париж: Готье-Виллар, 1907).
- ^ Редлих, Отто; Квонг, JNS. О термодинамике растворов, Chem. Откр. 44 (1): 233–244 (1949).
- ^ Пэн, ДЮ; Робинсон, Д.Б., Новое двухконстантное уравнение состояния. Промышленная и техническая химия: Основы. 15: 59–64 (1976).
- ^ Битти, Дж. А., и Бриджман, О. К., Новое уравнение состояния жидкостей, Proc. Являюсь. акад. Art Sci., 63, 229–308 (1928).
- ^ Бенедикт, Мэнсон; Уэбб, Джордж Б.; Рубин, Луи К., Эмпирическое уравнение термодинамических свойств легких углеводородов и их смесей: I. Метан, этан, пропан и н-бутан, Журнал химической физики, 8 (4): 334–345 (1940).
- ^ Jump up to: а б Старлинг, Кеннет Э., Свойства жидкости для систем легкой нефти, Gulf Publishing Company, стр. 270 (1973).





































