Реакции карбонильного α-замещения
Эта статья в значительной степени или полностью опирается на один источник . ( сентябрь 2015 г. ) |
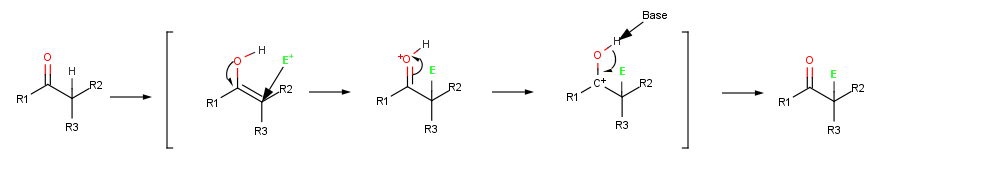
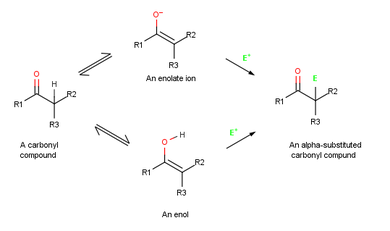
Реакции альфа-замещения происходят в положении рядом с карбонильной группой, α-положение и включает замещение α- водорода атома электрофилом E через енол или енолят-ион промежуточный . [ 1 ]
Механизм реакции
[ редактировать ]Поскольку их двойные связи богаты электронами, енолы ведут себя как нуклеофилы и реагируют с электрофилами почти так же, как алкены . Но из-за резонансного донорства неподеленной пары электронов соседнего кислорода енолы более богаты электронами и, соответственно, более реакционноспособны, чем алкены. Обратите внимание на следующую карту электростатического потенциала этинола (H 2 C=CHOH), на которой имеется значительная электронная плотность на α-углероде.
Когда алкен реагирует с электрофилом, таким как HCl , первоначальное добавление H + дает промежуточный катион и последующую реакцию с Cl − присоединения дает продукт . Однако когда енол реагирует с электрофилом, остается только начальная стадия добавления. Вместо реакции с CI − чтобы дать продукт присоединения, промежуточный катион теряет ОН − протона с образованием α-замещенного карбонильного соединения . [ 1 ] : 845
Альфа-галогенирование альдегидов и кетонов
[ редактировать ]Особенно распространенной реакцией α-замещения в и кетонов по их лаборатории является галогенирование альдегидов α - положениям по реакции Cl 2 , Br 2 или I 2 в кислом растворе. бром в растворителе уксусной кислоты Часто используют .
Примечательно, что галогенирование кетонов также происходит в биологических системах , особенно в морских водорослях, где дибромацетальдегид, бромацетон были обнаружены , 1,l,l-трибромацетон и другие родственные соединения.
Галогенирование представляет собой типичную реакцию α-замещения, которая протекает путем катализируемого кислотой образования енольного промежуточного продукта. [ 1 ] : 846
Кислотность альфа-атомов водорода: образование енолят-иона
[ редактировать ]Водород в α-положении карбонильного соединения является слабокислотным и может быть удален сильным основанием с образованием енолят-иона. Например, при сравнении ацетона (pK a = 19,3) с этаном (pK a = 60) наличие соседней карбонильной группы увеличивает кислотность кетона по сравнению с алканом в 10 раз. 40 .
Отрыв протона от карбонильного соединения происходит, когда связь CH ориентирована примерно параллельно p- орбиталям карбонильной группы. Атом углерода енолята-иона имеет вид sp. 2 -гибридизирован и имеет ап-орбиталь, перекрывающую соседние карбонильные р-орбитали. Таким образом, отрицательный заряд разделяется электроотрицательным атомом кислорода, а енолят-ион стабилизируется за счет резонанса .
Карбонильные соединения более кислые, чем алканы, по той же причине, по которой карбоновые кислоты более кислые, чем спирты. В обоих случаях анионы стабилизируются за счет резонанса. Однако енолят -ионы отличаются от карбоксилат-ионов тем, что их две резонансные формы не эквивалентны — форма с отрицательным зарядом на кислороде имеет меньшую энергию, чем форма с зарядом на углероде. Тем не менее, принцип стабилизации резонанса в обоих случаях один и тот же.
Поскольку карбонильные соединения являются слабокислотными, для образования енолят-иона необходимо сильное основание. Если в качестве основания используется алкоксид, такой как этоксид натрия, депротонирование происходит только до степени около 0,1%, поскольку ацетон является более слабой кислотой, чем этанол (pK a = 16). более мощное основание, такое как гидрид натрия (NaH) или диизопропиламид лития ( LDA Однако если использовать ), карбонильное соединение может быть полностью превращено в его енолят-ион. Диизопропиламид лития (ЛДА), который легко получить реакцией сильного основания бутиллития с диизопропиламином , широко используется в лаборатории в качестве основания для получения енолят-ионов из карбонильных соединений.
Многие типы карбонильных соединений, включая альдегиды , кетоны , сложные эфиры , тиоэфиры , кислоты и амиды , могут быть преобразованы в енолят-ионы путем реакции с LDA. Обратите внимание, что нитрилы также являются кислыми и могут превращаться в енолятоподобные анионы (называемые нитриловыми анионами ). Когда атом водорода окружен двумя карбонильными группами, его кислотность повышается еще больше. Эта повышенная кислотность β-дикарбонильных соединений обусловлена стабилизацией образующихся енолят-ионов за счет делокализации отрицательного заряда по обеим карбонильным группам. [ 1 ] : 850
Реакционная способность енолят-ионов
[ редактировать ]Енолят-ионы более полезны, чем енолы, по двум причинам. Во-первых, чистые енолы обычно не могут быть выделены, а вместо этого образуются только в виде короткоживущих промежуточных продуктов в низкой концентрации . Напротив, стабильные растворы чистых енолят-ионов легко получаются из большинства карбонильных соединений реакцией с сильным основанием. Во-вторых, енолят-ионы более реакционноспособны, чем енолы, и вступают во многие реакции, в которых енолы не участвуют. В то время как енолы нейтральны, енолят-ионы заряжены отрицательно, что делает их гораздо лучшими нуклеофилами. В результате енолят-ионы более распространены, чем енолы, как в лабораторной, так и в биологической химии.
Поскольку они представляют собой резонансные гибриды двух неэквивалентных форм, енолят-ионы можно рассматривать либо как виниловые алкоксиды (C=C-O − ) или в виде α-кетокарбанионов ( − СС= О). Таким образом, енолят-ионы могут реагировать с электрофилами как на кислород, так и на углерод. Реакция на кислород дает производное енола, а реакция на углерод дает α-замещенное карбонильное соединение. Оба вида реакционной способности известны, но более распространена реакция на углерод. [ 1 ] : 853
Алкилирование енолят-ионов
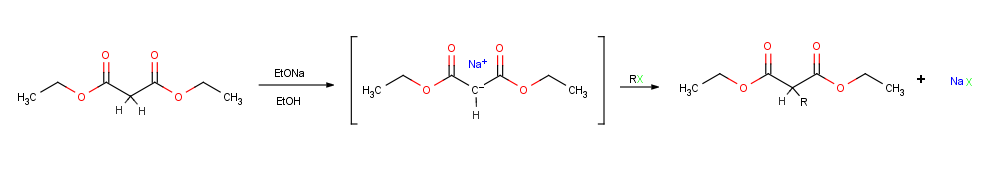
[ редактировать ]Возможно, единственной наиболее важной реакцией енолят-ионов является их алкилирование путем обработки алкилгалогенидом или тозилатом , в результате чего образуется новая связь CC и соединяются две меньшие части в одну большую молекулу . Алкилирование происходит, когда нуклеофильный енолят-ион реагирует с электрофильным алкилгалогенидом в реакции SN 2 и замещает уходящую группу путем атаки с обратной стороны.
На реакции алкилирования распространяются те же ограничения, что и на все SN 2 реакции . Таким образом, уходящей группой X в алкилирующем агенте RX может быть хлорид , бромид , йодид или тозилат . Алкильная группа R должна быть первичной или метильной и предпочтительно должна быть аллильной или бензильной . Вторичные галогениды реагируют плохо, а третичные галогениды вообще не реагируют, потому что вместо этого происходит конкурирующее элиминирование HX E2. Винилгалогениды и арилгалогениды также нереакционноспособны, поскольку стерический подход предотвращается с обратной стороны. [ 1 ] : 855
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж Макмерри, Джон. Органическая химия (6-е изд.). п. 841. ИСБН 978-80-214-3291-8 .