Степени свободы (физика и химия)
Эта статья нуждается в дополнительных цитатах для проверки . ( ноябрь 2009 г. ) |
В физике и химии степень свободы — независимый физический параметр формального описания состояния физической системы . Набор всех состояний системы известен как фазовое пространство системы , а степени свободы системы — это размеры фазового пространства.
Для расположения частицы в трехмерном пространстве требуется три координаты положения . Точно так же направление и скорость движения частицы можно описать с помощью трех компонентов скорости, каждый из которых относится к трем измерениям пространства. Итак, если временная эволюция системы детерминирована (когда состояние в один момент однозначно определяет свое прошлое и будущее положение и скорость как функцию времени), такая система имеет шесть степеней свободы. [ нужна ссылка ] Если движение частицы ограничено меньшим числом измерений – например, частица должна двигаться вдоль провода или по неподвижной поверхности – тогда система имеет менее шести степеней свободы. С другой стороны, система с протяженным объектом, который может вращаться или вибрировать, может иметь более шести степеней свободы.
В классической механике состояние точечной частицы в любой момент времени часто описывается координатами положения и скорости в лагранжевом формализме или координатами положения и импульса в гамильтоновом формализме.
В статистической механике степень свободы — это одно скалярное число, описывающее микросостояние системы. [ 1 ] Спецификация всех микросостояний системы — это точка в фазовом пространстве системы .
В трехмерной модели идеальной цепи в химии два угла для описания ориентации каждого мономера необходимы .
Часто бывает полезно указать квадратичные степени свободы. Это степени свободы, которые вносят квадратичный вклад в энергию системы.
В зависимости от того, что считать, существует несколько разных способов определения степеней свободы: каждый с разным значением. [ 2 ]
Термодинамические степени свободы газов.
[ редактировать ]| Внешние изображения | |
|---|---|
По теореме о равнораспределении внутренняя энергия на моль газа равна c v T , где T — абсолютная температура , а удельная теплоемкость при постоянном объеме равна c v = (f)(R/2). R = 8,314 Дж/(К моль) — универсальная газовая постоянная, а «f» — число термодинамических (квадратичных) степеней свободы, подсчет количества способов, которыми может возникнуть энергия.
Любой атом или молекула имеет три степени свободы, связанные с поступательным движением (кинетической энергией) центра масс относительно осей x, y и z. Это единственные степени свободы для одноатомных частиц, таких как атомы благородных газов .
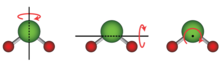
Для структуры, состоящей из двух или более атомов, вся структура также обладает кинетической энергией вращения, при которой вся структура поворачивается вокруг оси. , Линейная молекула в которой все атомы расположены вдоль одной оси, например, любая двухатомная молекула и некоторые другие молекулы, такие как углекислый газ (CO 2 ), имеет две вращательные степени свободы, поскольку может вращаться вокруг любой из двух осей, перпендикулярных оси молекулы. Нелинейная молекула, атомы которой не лежат вдоль одной оси, как вода (H 2 O), имеет три вращательные степени свободы, поскольку может вращаться вокруг любой из трех перпендикулярных осей. В особых случаях, например, при адсорбции больших молекул, вращательные степени свободы могут быть ограничены только одной. [ 3 ]
Структура, состоящая из двух или более атомов, также обладает колебательной энергией, при которой отдельные атомы движутся относительно друг друга. Двухатомная молекула имеет один режим молекулярных колебаний : два атома колеблются вперед и назад, а химическая связь между ними действует как пружина. Молекула с N атомами имеет более сложные моды молекулярных колебаний : 3 N - 5 мод колебаний для линейной молекулы и 3 N - 6 мод для нелинейной молекулы. [ 4 ] В качестве конкретных примеров: линейная молекула CO 2 имеет 4 режима колебаний: [ 5 ] а нелинейная молекула воды имеет 3 режима колебаний [ 6 ] Каждая колебательная мода имеет два энергетических термина: кинетическую энергию движущихся атомов и потенциальную энергию пружинных химических связей. Следовательно, число колебательных энергетических термов составляет 2(3 N - 5) мод для линейной молекулы и 2(3 N - 6) мод для нелинейной молекулы.
Как вращательная, так и колебательная мода квантованы, поэтому для активации требуется минимальная температура. [ 7 ] « Вращательная температура », при которой активируются вращательные степени свободы, для многих газов составляет менее 100 К. Для N 2 и O 2 она составляет менее 3 К. [ 1 ] « Вибрационная температура », необходимая для существенной вибрации, составляет от 10 3 К и 10 4 К, 3521 К для N 2 и 2156 К для O 2 . [ 1 ] Типичные атмосферные температуры недостаточно высоки, чтобы активировать вибрацию N 2 и O 2 , которые составляют большую часть атмосферы. (См. следующий рисунок.) Однако гораздо менее распространенные парниковые газы сохраняют тепло в тропосфере , поглощая инфракрасное излучение от поверхности Земли, что возбуждает их колебательные моды. [ 8 ] Большая часть этой энергии переизлучается обратно на поверхность в инфракрасном диапазоне посредством « парникового эффекта ».
Поскольку комнатная температура (≈298 К) превышает типичную вращательную температуру, но ниже, чем типичная колебательная температура, только поступательная и вращательная степени свободы в равной степени вносят вклад в коэффициент теплоемкости . Вот почему γ ≈ 5/3 ≈ для одноатомных газов γ и 7/5 газов при для двухатомных комнатной температуре. [ 1 ]

Поскольку в воздухе преобладают двухатомные газы ( около 99 %) его молярная внутренняя энергия близка к cv T . = (5/2) R T , определяемая пятью степенями свободы, присущими двухатомным газам [ нужна ссылка ] [ 11 ] [ циклическая ссылка ] См. график справа. При 140 К < Т < 380 К c v отличается от (5/2) R d менее чем на 1%. Только при температурах, значительно превышающих температуры в тропосфере и стратосфере , некоторые молекулы обладают достаточной энергией для активации колебательных мод N 2 и O 2 . Удельная теплоемкость при постоянном объеме, cv , медленно увеличивается в направлении (7/2) R при повышении температуры выше T = 400 К, где cv на 1,3% выше (5/2) R d = 717,5 Дж/(К кг). .
| Одноатомный | Линейные молекулы | Нелинейные молекулы | |
|---|---|---|---|
| Перевод ( x , y и z ) | 3 | 3 | 3 |
| Вращение ( x , y и z ) | 0 | 2 | 3 |
| Вибрация (высокая температура) | 0 | 2 (3 Н - 5) | 2 (3 Н - 6) |
Подсчет минимального количества координат для указания позиции
[ редактировать ]Можно также подсчитать степени свободы, используя минимальное количество координат, необходимое для указания положения. Это делается следующим образом:
- Для одной частицы нам нужны две координаты в двумерной плоскости, чтобы указать ее положение, и три координаты в трехмерном пространстве. Таким образом, его степень свободы в трехмерном пространстве равна 3.
- Для тела, состоящего из двух частиц (например, двухатомной молекулы) в трехмерном пространстве с постоянным расстоянием между ними (скажем, d), мы можем показать (ниже), что его степени свободы равны 5.
Допустим, одна частица в этом теле имеет координату ( x 1 , y 1 , z 1 ), а другая имеет координату ( x 2 , y 2 , z 2 ) с z 2 неизвестным . Применение формулы расстояния между двумя координатами
приводит к одному уравнению с одним неизвестным, в котором мы можем решить z 2 . Один x1 , x2 , y1 или , y2 из , z1 z2 . может неизвестен быть
Вопреки классической теореме о равнораспределении , при комнатной температуре колебательное движение молекул обычно вносит незначительный вклад в теплоемкость . Это связано с тем, что эти степени свободы заморожены , поскольку расстояние между собственными значениями энергии превышает энергию, соответствующую температуре окружающей среды ( k B T ). [ 1 ]
Независимые степени свободы
[ редактировать ]Набор степеней свободы X 1 , ... , X N системы является независимым, если энергию, связанную с этим набором, можно записать в следующем виде:
где E i является функцией единственной переменной X i .
пример: если X 1 и X 2 — две степени свободы, а E — соответствующая энергия:
- Если , то две степени свободы независимы.
- Если , то две степени свободы не являются независимыми. Термин, включающий произведение X 1 и X 2, является связующим термином, который описывает взаимодействие между двумя степенями свободы.
Для i от 1 до N значение i- й степени свободы X i распределяется согласно распределению Больцмана . Его функция плотности вероятности имеет следующий вид:
- ,
В этом разделе и на протяжении всей статьи скобки обозначают среднее значение количества, которое они заключают в себе.
системы Внутренняя энергия представляет собой сумму средних энергий, связанных с каждой из степеней свободы:
Квадратичные степени свободы
[ редактировать ]Степень свободы X i является квадратичной, если энергетические члены, связанные с этой степенью свободы, можно записать как
- ,
где Y — линейная комбинация других квадратичных степеней свободы.
пример: если X 1 и X 2 — две степени свободы, а E — соответствующая энергия:
- Если , то две степени свободы не являются независимыми и неквадратичными.
- Если , то две степени свободы независимы и неквадратичны.
- Если , то две степени свободы не независимы, а квадратичны.
- Если , то две степени свободы независимы и квадратичны.
Например, в Ньютона динамика механике системы квадратичных степеней свободы управляется набором однородных линейных дифференциальных уравнений с постоянными коэффициентами .
Квадратичная и независимая степень свободы
[ редактировать ]X 1 , ... , X N являются квадратичными и независимыми степенями свободы, если энергию, связанную с микросостоянием системы, которую они представляют, можно записать как:
Теорема о равнораспределении
[ редактировать ]В классическом пределе статистической механики при термодинамическом равновесии внутренняя энергия системы N квадратичных и независимых степеней свободы равна:
Здесь средняя энергия, связанная со степенью свободы, равна:
Поскольку степени свободы независимы, внутренняя энергия системы равна сумме средней энергии, связанной с каждой степенью свободы, что и демонстрирует результат.
Обобщения
[ редактировать ]Описание состояния системы как точки ее фазового пространства, хотя и удобно с математической точки зрения, считается принципиально неточным. В квантовой механике степени свободы движения заменяются понятием волновой функции , а операторы , соответствующие другим степеням свободы, имеют дискретный спектр . Например, собственный оператор углового момента (который соответствует свободе вращения) электрона или фотона имеет только два собственных значения . Эта дискретность становится очевидной, когда действие имеет порядок и постоянной Планка можно выделить отдельные степени свободы.
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и Рейф, Ф. (2009). Основы статистической и теплофизики . Лонг-Гроув, Иллинойс: Waveland Press, Inc., с. 51. ИСБН 978-1-57766-612-7 .
- ^ «Физическая химия. Имеет ли двухатомный газ одну или две колебательные степени свободы?» .
- ^ Вальдманн, Томас; Кляйн, Йенс; Хостер, Гарри Э.; Бем, Р. Юрген (2013). «Стабилизация крупных адсорбатов с помощью вращательной энтропии: исследование СТМ с временным разрешением и переменной температурой». ХимияФизХим . 14 (1): 162–9. дои : 10.1002/cphc.201200531 . ПМИД 23047526 . S2CID 36848079 .
- ^ Молекулярная вибрация [ источник, созданный пользователем ]
- ^ Чертежи см. http://www.colby.edu/chemistry/PChem/notes/NormalModesText.pdf.
- ^ Чертежи см. https://sites.cns.utexas.edu/jones_ch431/normal-modes-vibration .
- ^ Раздел 12-7 (стр. 376-379) журнала Sears and Salinger, 1975: Термодинамика, кинетическая теория и статистическая термодинамика. Третье издание. Эддисон-Уэсли Паблишинг Ко.
- ^ «Молекулы вибрируют» . Центр научного образования UCAR . Архивировано из оригинала 10 октября 2014 г. Проверено 19 января 2021 г.
- ^ «Воздух – удельная теплоемкость в зависимости от температуры при постоянном давлении» .
- ^ Гатли, Д.П., С. Херрманн, Х.-Дж. Крецшмар, 2008: Молярная масса сухого воздуха XXI века. Исследование HVAC&R, том. 14, стр. 655-662.
- ^ Теорема о равнораспределении # Двухатомные газы














