Коннексон
| Коннексон | |
|---|---|
 Коннексон и структура коннексина | |
| Подробности | |
| Идентификаторы | |
| латинский | коннексона |
| ТД | Х1.00.01.1.02025 |
| Анатомическая терминология | |
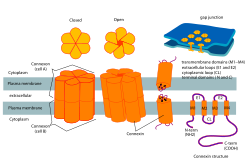
В биологии коннексон коннексинами , также известный как полуканал коннексина , представляет собой совокупность шести белков, называемых , которые образуют пору для щелевого соединения между цитоплазмой двух соседних клеток . Этот канал обеспечивает двунаправленный поток ионов и сигнальных молекул. [1] Коннексон — это полуканал, снабжаемый клеткой на одной стороне соединения; два коннексона из противоположных клеток обычно объединяются, образуя полный канал межклеточного щелевого соединения. В некоторых клетках сам полуканал активен как канал между цитоплазмой и внеклеточным пространством , обеспечивая перенос ионов и небольших молекул с массой менее 1-2 кДа. Об этой функции коннексонов известно мало, кроме новых данных, указывающих на их ключевую роль во внутриклеточной передаче сигналов . [2] Было показано, что в других клетках коннексоны встречаются в митохондриальных мембранах и, по-видимому, играют роль в ишемии сердца . [3]
Коннексоны, состоящие из коннексинов одного и того же типа, считаются гомомерными , тогда как коннексоны, состоящие из коннексинов разных типов, являются гетеромерными . [4]
Структура
[ редактировать ]Сборка
[ редактировать ]Сборка коннексинов, предназначенных для бляшек щелевых соединений, начинается с синтеза коннексинов внутри клетки и заканчивается образованием бляшек каналов щелевых соединений на клеточной мембране. клетки Белки-субъединицы коннексина, входящие в состав коннексонов, синтезируются на мембранах эндоплазматического ретикулума . Эти субъединицы затем олигомеризуются или объединяются с другими более мелкими частями в коннексоны в аппарате Гольджи . [5] Затем коннексоны доставляются в нужное место на плазматической мембране. [6] Затем коннексоны стыкуются с совместимыми коннексонами из соседней клетки, образуя бляшки каналов щелевого соединения. [5] Большая часть этого процесса опосредована фосфорилированием различных ферментов и белков, обеспечивая и предотвращая взаимодействие между определенными белками. [5] Коннексоны, образующие каналы снаружи клетки или в митохондриях, потребуют несколько измененного пути сборки.
Общий
[ редактировать ]Коннексоны способствуют образованию щелевых соединений и являются важным компонентом электрических синапсов в нервных путях. [5] В одном щелевом соединении коннексоны собираются вокруг водной пористой мембраны, образуя полуканал, состоящий из коннексинов. Коннексины — это более мелкие белковые молекулы, которые составляют коннексоны и играют решающую роль в формировании щелевых соединений. Структурно коннексины состоят из 4 альфа-спиральных трансмембранных доменов, соединенных двумя внеклеточными петлями и одной цитоплазматической петлей, при этом оба N- и C-конца расположены внутриклеточно. Типы коннексина можно дополнительно дифференцировать, используя их прогнозируемую молекулярную массу (например: коннексин 43 представляет собой Cx 43 из-за его молекулярной массы 43 кДа). Коннексоны образуют щелевой контакт путем стыковки полуканала с другим полуканалом в соседней клеточной мембране. [2] Во время этой фазы происходит формирование межклеточных каналов, охватывающих обе плазматические мембраны. Впоследствии этот процесс приводит к лучшему пониманию того, как создаются электрические синапсы между нейронами. [2] Ранние исследования выявили коннексоны по их присутствию в щелевых соединениях. С тех пор все чаще обнаруживаются коннексоны, образующие каналы в одиночных мембранах, что значительно расширяет их функциональность в клетках и тканях. [7]
Деградация
[ редактировать ]Структура коннексона разрушается при его удалении из плазматической мембраны. Коннексоны будут интернализованы самой клеткой как структура двухмембранных каналов (из-за стыковки полуканалов). [5] Это называется интернализацией или эндоцитозом . Исследования показывают, что щелевые контакты в целом могут быть интернализованы с использованием более чем одного метода, но наиболее известным и наиболее изученным является метод клатрин-опосредованного эндоцитоза . [5] Проще говоря, этот процесс состоит из связывания лиганда с рецептором, сигнализирующего о том, что определенная часть мембраны должна быть покрыта клатрином . [5] Эта часть мембраны затем отпочковывается в клетку, образуя везикулу . Теперь коннексоны, присутствующие в клеточной мембране, будут разрушаться лизосомальными путями. [5] Лизосомы способны расщеплять белки коннексона, поскольку содержат специфические ферменты , созданные специально для этого процесса. Считается, что убиквитинирование сигнализирует о деградации внутри клетки. [5]
Клеточные функции
[ редактировать ]Характеристики
[ редактировать ]Свойства отдельных белков коннексина определяют общие свойства всего канала коннексина. Проницаемость . и селективность каналов определяются их шириной, а также молекулярной селективностью коннексинов, такой как селективность по заряду [2] Исследования показывают, что коннексоны особенно проницаемы для растворимых вторичных мессенджеров , аминокислот , нуклеотидов , ионов и глюкозы. [2] Каналы также чувствительны к напряжению. Каналы коннексонов имеют ворота, зависящие от напряжения, которые открываются или закрываются в зависимости от разницы напряжений внутри двух ячеек. [2] Ворота также могут проявлять чувствительность к напряжению в зависимости от разницы напряжения внутри и снаружи клетки (т.е. мембранного потенциала ). [2]
Модуляция
[ редактировать ]Связь между щелевыми соединениями можно модулировать/регулировать разными способами. Основными видами модуляции являются:
- Химическая - один из распространенных типов химической модуляции происходит за счет взаимодействия Ca. 2+ и определенные домены коннексинов. Это не до конца понятно, однако предполагается, что это взаимодействие вызывает Ca 2+ блокировать поры канала. Другая форма химической модуляции связана с реакцией канала на подкисление (снижение внутриклеточного pH ). Было обнаружено, что внутриклеточное закисление вызывает изменение С-концевого домена коннексинов, что затем снижает активность каналов. [2]
- Фосфорилирование белков – фосфорилирование белков регулирует связь между каналами несколькими способами, контролируя: перемещение коннексинов из аппарата Гольджи, накопление коннексонов в определенных областях и деградацию ненужных каналов. Процесс этих действий очень сложен, но известно участие фосфорилирования белков. [2]
- Гуморально -гуморальная модуляция связи через щелевые соединения осуществляется посредством многих биомолекул, таких как нейротрансмиттеры , факторы роста и различные биологически активные соединения . Нейромедиаторы, такие как адреналин и норадреналин, действуют в щелевых соединениях нейронов, вызывая распространение потенциалов действия вниз по нейронам. Подобные щелевые контакты с таким типом модуляции часто встречаются в нейронах сердечной ткани и сетчатки позвоночных. [2]
Общие функции
[ редактировать ]Коннексоны играют важную роль в поведении и нейрофизиологии. Многие детали, касающиеся их патологических функций, остаются неизвестными, поскольку исследования начались только недавно. В центральной нервной системе (ЦНС) коннексоны играют важную роль в таких состояниях, как эпилепсия , ишемия , воспаление и нейродегенерация . [1] Молекулярный механизм того, как коннексоны играют роль в перечисленных выше состояниях, еще не полностью понят и находится в стадии дальнейших исследований. Помимо своей ключевой роли в ЦНС, коннексоны играют решающую роль в функционировании сердечных тканей. Прямое соединение обеспечивает быструю и синхронизированную активацию нейронов сердца, что объясняет способность сердца быстро сокращаться и изменять свою частоту в ответ на определенные стимулы. [2] Коннексоны также играют важную роль в развитии клеток. В частности, их роль в нейрогенезе, связанная с развитием мозга, а также с восстановлением мозга во время определенных заболеваний/патологий, а также содействующая как клеточному делению, так и пролиферации клеток. Механизм, с помощью которого коннексоны помогают в этих процессах, все еще исследуется, однако в настоящее время понятно, что этот механизм включает пуринергическую передачу сигналов (форму внеклеточной передачи сигналов, опосредованную пуриновыми нуклеотидами и нуклеозидами, такими как аденозин и АТФ) и проницаемость для АТФ. [1] Другими важными функциями коннексонов являются чувствительность к глюкозе и передача сигналов . Коннексоны вызывают изменения внеклеточной концентрации глюкозы, влияя на поведение при кормлении/насыщении, циклы сна и бодрствования и использование энергии. [1] Дальнейшие исследования показывают, что происходит увеличение поглощения глюкозы, опосредованное коннексонами (механизм которых до сих пор не до конца понятен), а также во время сильного стресса и воспаления. [1] Недавние исследования также показывают, что коннексоны могут влиять на синаптическую пластичность , обучение, память, зрение и сенсомоторную активность.
Сопутствующие заболевания
[ редактировать ]Некоторые из заболеваний, связанных с коннексонами, - это сердечно-сосудистые заболевания и диабет , который представляет собой неспособность организма вырабатывать инсулин для поглощения глюкозы клетками и деградацию более мелких единиц коннексонов, называемых коннексинами, что может привести к возникновению сердечно-сосудистых заболеваний. Сердечно-сосудистые заболевания и диабет I и II типов поражают одинаковые участки клеток сердца и поджелудочной железы. Это место является щелевым соединением, где коннексоны способствуют быстрому взаимодействию между клетками посредством электрической передачи. Щелевые соединения часто присутствуют в нервных окончаниях, например, в сердечной мышце, и играют важную роль в поддержании гомеостаза печени и правильной функции почек. Сам щелевой контакт представляет собой структуру, представляющую собой специализированный трансмембранный белок, образованный полуканалом коннексона. [8] Сердечно-сосудистые заболевания и, возможно, диабет I и II типа связаны с основным белком коннексином, который образует щелевое соединение.
При сердечно-сосудистых заболеваниях Cx43 (коннексин 43), субъединица коннексона, представляет собой общий белок щелевого соединения, стимулирующий кардиомиоциты мышечных клеток вставочных дисков, способствующих синхронизированному сокращению сердца. При возникновении сердечно-сосудистых заболеваний субъединица Cx43 начинает проявлять признаки окислительного стресса, способности сердца противодействовать накоплению вредных токсинов из-за возраста или диеты, что приводит к снижению сосудистых функций. [8] снижение экспрессии Cx43 в сосудистой ткани, которая играет роль в переформировании желудочков и заживлении ран после инфаркта миокарда . Кроме того, при структурных заболеваниях сердца наблюдается [9] Однако механизмы действия Cx43 в сердце до сих пор плохо изучены. [9] В целом, эти изменения в экспрессии Cx43 и окислительный стресс могут привести к нарушениям скоординированного сокращения сердца, предрасполагая его к сердечным аритмиям . [8]
Коннексоны также связаны с диабетом как I , так и II типа . Субъединица Cx36 (коннексин 36) опосредует экскрецию инсулина и индуцированное глюкозой высвобождение инсулина из щелевых соединений печени и поджелудочной железы. [4] Гомеостаз в печени и органах поджелудочной железы поддерживается сложной системой клеточных взаимодействий, называемой эндокринной передачей сигналов. Секреция гормонов в кровоток для поражения отдаленных органов. Однако эндокринная передача сигналов в поджелудочной железе и печени осуществляется на коротких расстояниях в клеточной мембране посредством сигнальных путей, ионных каналов, рецепторов, связанных с G-белком , тирозинкиназных рецепторов и межклеточного контакта. [4] Щелевые контакты в этих тканях, поддерживаемые эндокринной передачей сигналов, регулируют внутриклеточные сигналы между клетками и более крупными системами органов, плотно соединяя соседние клетки друг с другом. Плотное прилегание щелевого соединения таково, что клетки ткани могут более эффективно взаимодействовать и поддерживать гомеостаз. Таким образом, цель щелевого перехода — регулировать прохождение ионов, питательных веществ, метаболитов, вторичных мессенджеров и небольших биологических молекул. [4] При диабете последующая потеря или деградация Cx36 существенно подавляет выработку инсулина в поджелудочной железе и глюкозы в печени, что жизненно важно для производства энергии для всего организма. Дефицит Cx36 отрицательно влияет на способность щелевого соединения работать внутри этих тканей, что приводит к снижению функции и возможному заболеванию. Подобные симптомы, связанные с потерей или деградацией щелевого соединения, наблюдались при диабете II типа, однако функция Cx36 при диабете типа 1 и типа II у людей до сих пор неизвестна. Кроме того, коннексин Cx36 кодируется геном GJD2, который имеет предрасположенность к локусу гена диабета II типа и диабетического синдрома. [4]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и Чунг, Жизель; Чевер, Оана; Руаш, Натали (4 ноября 2014 г.). «Коннексоны и Паннексоны: новички в нейрофизиологии» . Границы клеточной нейронауки . 8 : 348. дои : 10.3389/fncel.2014.00348 . ПМК 4219455 . ПМИД 25408635 .
- ^ Перейти обратно: а б с д и ж г час я дж к Эрве, Жан-Клод; Деранжон, Микаэль (01 сентября 2012 г.). «Межклеточная связь, опосредованная щелевым соединением». Исследования клеток и тканей . 352 (1): 21–31. дои : 10.1007/s00441-012-1485-6 . ПМИД 22940728 . S2CID 176666 .
- ^ Руис-Меана, М.; Родригес-Синовас, А.; Кабестреро, А.; Бенглер, К.; Хойш, Г.; Гарсиа-Дорадо, Д. (2008). «Митохондриальный коннексин43 как новый игрок в патофизиологии ишемически-реперфузионного повреждения миокарда» . Сердечно-сосудистые исследования . 77 (2): 325–333. дои : 10.1093/cvr/cvm062 . ПМИД 18006437 .
- ^ Перейти обратно: а б с д и Райт, Жозефина; Ричардс, Тоби; Беккер, Дэвид (01 марта 2012 г.). «Коннексины и диабет» . Кардиологические исследования и практика . 2012 : 496904. doi : 10.1155/2012/496904 . ПМК 3303578 . ПМИД 22536530 .
- ^ Перейти обратно: а б с д и ж г час я Тевенин, Анастасия Ф (07 марта 2013 г.). «Белки и механизмы, регулирующие сборку, интернализацию и деградацию щелевых соединений» . Физиология . 28 (2): 93–116. дои : 10.1152/физиол.00038.2012 . ПМК 3768091 . ПМИД 23455769 .
- ^ Лауф, Ундина; Гипманс, Бен Н.Г.; Лопес, Патрисия; Браконно, Себастьен; Чен, Шу-Чи; Фальк, Матиас М. (6 августа 2002 г.). «Динамический транспорт и доставка коннексонов к плазматической мембране и прирастание к щелевым контактам в живых клетках» . Труды Национальной академии наук . 99 (16): 10446–10451. дои : 10.1073/pnas.162055899 . ПМЦ 124935 . ПМИД 12149451 .
- ^ Эрве, Жан-Клод (2013). «Коммуникационные соединения, роли и дисфункции» . Biochimica et Biophysical Acta (BBA) – Биомембраны . 1828 (1): 1–3. дои : 10.1016/j.bbamem.2012.10.012 . ПМИД 23088917 .
- ^ Перейти обратно: а б с Томаселли, Гордон Ф. (4 декабря 2010 г.). «Окислительный стресс разрушает связь между сердечными связями» . Журнал клинических исследований . 120 (1): 87–89. дои : 10.1172/jci41780 . ПМЦ 2798705 . ПМИД 20038808 .
- ^ Перейти обратно: а б Чжан, Ян; Ван, Хунтао; Ковач, Аттила; Кантер, Эвелин; Ямада, Кэтрин (01 февраля 2010 г.). «Снижение экспрессии Cx43 ослабляет ремоделирование желудочков после инфаркта миокарда за счет нарушения передачи сигналов TGF-β» . Американский журнал физиологии. Физиология сердца и кровообращения . 298 (2): H477-87. дои : 10.1152/ajpheart.00806.2009 . ПМЦ 2822575 . ПМИД 19966054 .
Дальнейшее чтение
[ редактировать ]- Эндрю Л. Харрис и Даррен Локк (2009). Коннексины, Руководство . Нью-Йорк: Спрингер. п. 574. ИСБН 978-1-934115-46-6 .