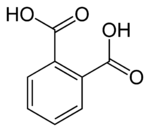
Фталевая кислота
| |
| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
Бензол-1,2-дикарбоновая кислота | |
| Другие имена
1,2-бензолдиовая кислота
Фталевая кислота Бензол-1,2-дикарбоновая кислота орто -фталевая кислота Дикарбоксилбензол Карбоксилбензойная кислота 1,2-фенилендикарбоновая кислота Фенилен-1,2-дикарбоновая кислота | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| КЭБ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.001.703 |
| Номер ЕС |
|
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 8 Н 6 О 4 | |
| Молярная масса | 166.132 g/mol |
| Появление | белое твердое вещество |
| Плотность | 1,593 г/см 3 , твердый |
| Температура плавления | 207 ° С (405 ° F; 480 К) [ 3 ] |
| 0,6 г/100 мл [ 1 ] | |
| Кислотность ( pKa ) | 2.89, 5.51 [ 2 ] |
| -83.61·10 −6 см 3 /моль | |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| Родственные соединения | |
Родственные карбоновые кислоты
|
Изофталевая кислота Терефталевая кислота |
Родственные соединения
|
Фталевый ангидрид Фталимид Фталгидразид Фталоилхлорид Бензол-1,2- дикарбоксальдегид |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
В органической химии фталевая кислота представляет собой дикарбоновую кислоту формулы ароматическую C 6 H 4 (CO 2 H) 2 и строение НО(О)С- С 6 ЧАС 4 - С(О)ОН . Хотя фталевая кислота имеет скромное коммерческое значение, близкородственное производное фталевого ангидрида представляет собой товарный химикат, производимый в больших масштабах. [ 4 ] Фталевая кислота — один из трех изомеров бензолдикарбоновой кислоты , остальные — изофталевая кислота и терефталевая кислота .
Производство
[ редактировать ]Фталевая кислота производится каталитическим окислением непосредственно до фталевого нафталина или ортоксилола ангидрида и последующим гидролизом ангидрида. [ 4 ]
Фталевая кислота была впервые получена французским химиком Огюстом Лораном в 1836 году путем окисления тетрахлорида нафталина. [ 5 ] Полагая, что полученное вещество является производным нафталина, он назвал его «нафталевой кислотой». [ 5 ] [ 6 ] [ 7 ] После того как швейцарский химик Жан Шарль Галиссар де Мариньяк определил ее правильную формулу, [ 8 ] Лоран дал ему нынешнее название. [ 5 ] [ 9 ] [ 10 ] Методы производства в девятнадцатом веке включали окисление тетрахлорида нафталина азотной кислотой или, лучше сказать, окисление углеводорода дымящей серной кислотой с использованием ртути или сульфата ртути (II) в качестве катализатора. [ 5 ]
Синтез
[ редактировать ]Нафталин при окислении перманганатом или дихроматом калия дает фталевый ангидрид. [ 11 ] который при гидролизе горячей водой дает фталевую кислоту. [ 12 ]
Реакции и использование
[ редактировать ]
Это двухосновная кислота с p K a 2,89 и 5,51. Монокалиевая соль гидрофталат калия является стандартной кислотой в аналитической химии . Обычно эфиры фталевой кислоты получают из широко доступного фталевого ангидрида . Восстановление фталевой кислоты амальгамой натрия в присутствии воды дает производное 1,3-циклогексадиена . [ 13 ]
Безопасность
[ редактировать ]Токсичность фталевой кислоты умеренная: ЛД 50 (мышь) составляет 550 мг/кг.
Биодеградация
[ редактировать ]Бактерии Pseudomonas sp. P1 разлагает фталевую кислоту. [ 14 ]
См. также
[ редактировать ]- Изофталевая кислота
- Фталат
- Фталевый ангидрид
- Гидрофталат калия , основной стандарт для кислотно-основного титрования.
- Терефталевая кислота
Ссылки
[ редактировать ]- ^ «ФТАЛИЕВАЯ КИСЛОТА» . опасность.com .
- ^ Браун, Х.К. и др., Бауде, Э.А. и Наход, Ф.К., Определение органических структур физическими методами , Academic Press, Нью-Йорк, 1955.
- ^ Сообщается о нескольких температурах плавления, например: (i) 480 К (веб-сайт NIST), (ii) 210–211 ° C с разложением (Sigma-Aldrich онлайн), (iii) 191 ° C в запечатанной пробирке. (Энциклопедия промышленной химии Ульмана), (iv) 230 °C с преобразованием во фталевый ангидрид и воду (JTBaker MSDS).
- ^ Jump up to: а б Барли, Питер М.; Товаэ, Фридрих К.; Дядя Уолтер; и др. (2007). «Фталевая кислота и производные». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a20_181.pub2 . ISBN 978-3527306732 .
- ^ Jump up to: а б с д Чисхолм, Хью , изд. (1911). . Британская энциклопедия . Том. 21 (11-е изд.). Издательство Кембриджского университета. стр. 545–546.
- ^ Огюст Лоран (1836) «Sur l'acide naphtalique et ses combinisons» (О нафталевой кислоте и ее соединениях), Annales de Chimie et de Physique , 61 : 113-125. (Примечание: эмпирические формулы соединений, которые были проанализированы в этой статье, неверны, отчасти потому, что в этот период химики использовали неправильные атомные массы углерода (6 вместо 12) и других элементов.)
- ^ Перепечатано на немецком языке как: Огюст Лоран (1836) «Уэбер Нафталиновая кислота и ее соединения» (О нафталеновой кислоте и ее соединениях), Annalen der Pharmacie , 19 (1): 38-50; информацию о получении фталевой кислоты см. на стр. 41.
- ^ К. де Мариньяк (1841) «О нафталиновой кислоте и летучем продукте, возникающем при ее приготовлении» , Annals of Chemistry and Pharmacie , 38 (1): 13-20. (Примечание: опять же, эмпирические формулы Мариньяка неверны, потому что химики того времени использовали неправильные атомные массы.)
- ^ Огюст Лоран (1841) «О новых азотистых соединениях нафталина, а также о фталевой кислоте и нитрофталевой кислоте» , Revue Scientifique et Industrielle , 6 : 76-99; на странице 92 Лоран придумал название «фталевая кислота» и признал, что его более ранняя эмпирическая формула для фталевой кислоты была неверной.
- ^ Перепечатано на немецком языке как: Огюст Лоран (1842) «О новых азотистых соединениях нафталина, о фталевой кислоте и нитрофталевой кислоте» , Annals of Chemistry and Pharmacie , 41 (1): 98-114; на странице 108 Лоран придумал название «Фталевая кислота» (фталевая кислота).
- ^ «Окисление нафталина до фталевого ангидрида» . public.websites.umich.edu . Проверено 6 апреля 2024 г.
- ^ Ноллер, Карл Р. (1965). Химия органических соединений (3-е изд.). Филадельфия: У. Б. Сондерс. п. 602.
- ^ Ричард Н. Макдональд и Чарльз Э. Рейнеке (1988). «Транс-1,2-дигидрофталевая кислота» . Органические синтезы ; Сборник томов , т. 6, с. 461 .
- ^ Иштиак Али, Мухаммед (2011). Микробная деградация поливинилхлоридных пластиков (PDF) (доктор философии). Университет Каид-и-Азам. п. 47.
- Индекс Merck, 9-е изд., № 7178.
