Метаболизм ксенобиотиков

Метаболизм ксенобиотиков (от греческого xenos «чужой» и biotic «связанный с живыми существами») представляет собой набор метаболических путей , которые изменяют химическую структуру ксенобиотиков , которые представляют собой соединения, чуждые нормальной биохимии организма, такие как лекарства и яды. Эти пути представляют собой форму биотрансформации, присутствующую во всех основных группах организмов, и считаются имеющими древнее происхождение. Эти реакции часто направлены на детоксикацию ядовитых соединений; однако в таких случаях, как метаболизм алкоголя , промежуточные соединения метаболизма ксенобиотиков сами по себе могут быть причиной токсических эффектов.
Метаболизм ксенобиотиков делится на три фазы. На этапе I ферменты, такие как оксидазы цитохрома P450, вводят в ксенобиотики реактивные или полярные группы. Эти модифицированные соединения затем конъюгируют с полярными соединениями в реакциях фазы II. Эти реакции катализируются ферментами трансфераз, такими как глутатион S-трансферазы . Наконец, на этапе III конъюгированные ксенобиотики могут подвергаться дальнейшей обработке, прежде чем они будут распознаны эффлюксными транспортерами и выкачаны из клеток.
Реакции этих путей представляют особый интерес в медицине как часть метаболизма лекарств и как фактор, способствующий множественной лекарственной устойчивости при инфекционных заболеваниях и рака химиотерапии . Действия некоторых лекарств в качестве субстратов или ингибиторов ферментов, участвующих в метаболизме ксенобиотиков, являются частой причиной опасных лекарственных взаимодействий . Эти пути также важны в науке об окружающей среде , поскольку метаболизм ксенобиотиков микроорганизмов определяет, будет ли загрязнитель расщепляться во время биоремедиации или сохраняться в окружающей среде. Ферменты метаболизма ксенобиотиков, особенно глутатион-S-трансферазы, также важны в сельском хозяйстве, поскольку они могут вызывать устойчивость к пестицидам и гербицидам .
и детоксикация проницаемости Барьеры
То, что точные соединения, воздействию которых подвергается организм, в значительной степени непредсказуемы и могут сильно различаться с течением времени, является основной характеристикой токсического стресса ксенобиотиков. [1] Основная проблема, с которой сталкиваются системы детоксикации ксенобиотиков, заключается в том, что они должны быть способны удалять практически неограниченное количество ксенобиотических соединений из сложной смеси химических веществ, участвующих в нормальном метаболизме . Решением этой проблемы стало элегантное сочетание физических барьеров и ферментативных систем с низкой специфичностью.
Все организмы используют клеточные мембраны в качестве гидрофобных барьеров проницаемости для контроля доступа к своей внутренней среде. Полярные соединения не могут диффундировать через эти клеточные мембраны , а поглощение полезных молекул опосредовано транспортными белками , которые специфически выбирают субстраты из внеклеточной смеси. Такое избирательное поглощение означает, что большинство гидрофильных молекул не могут проникнуть в клетки, поскольку они не распознаются какими-либо специфическими переносчиками. [2] Напротив, диффузию гидрофобных соединений через эти барьеры невозможно контролировать, и поэтому организмы не могут исключить жирорастворимые ксенобиотики с помощью мембранных барьеров.
Однако существование барьера проницаемости означает, что организмы смогли развить системы детоксикации, использующие гидрофобность, присущую мембранопроницаемым ксенобиотикам. Таким образом, эти системы решают проблему специфичности, обладая такой широкой субстратной специфичностью, что они метаболизируют практически любое неполярное соединение. [1] Полезные метаболиты исключены, поскольку они полярны и обычно содержат одну или несколько заряженных групп.
Детоксикация реактивных побочных продуктов нормального метаболизма не может быть достигнута с помощью систем, описанных выше, поскольку эти виды происходят из нормальных клеточных компонентов и обычно имеют общие полярные характеристики. Однако, поскольку этих соединений немного, специальные ферменты могут распознавать и удалять их. Примерами этих конкретных систем детоксикации являются глиоксалазная система , которая удаляет реактивный альдегид метилглиоксаль, [3] и различные антиоксидантные системы, которые устраняют активные формы кислорода. [4]
Фазы детоксикации [ править ]
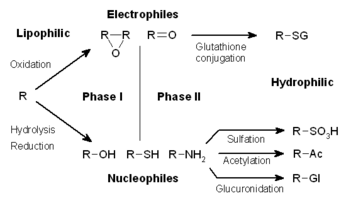
Метаболизм ксенобиотиков часто разделяют на три фазы: модификация, конъюгация и выведение. Эти реакции действуют согласованно, детоксицируя ксенобиотики и удаляя их из клеток.
Фаза I – модификация [ править ]
На этапе I различные ферменты вводят реактивные и полярные группы в свои субстраты. Одной из наиболее распространенных модификаций является гидроксилирование, катализируемое цитохромом P-450-зависимой оксидазной системой со смешанными функциями . Эти ферментные комплексы включают атом кислорода в неактивированные углеводороды, что может привести либо к введению гидроксильных групп, либо к N-, O- и S-деалкилированию субстратов. [5] Механизм реакции оксидаз Р-450 протекает через восстановление цитохром-связанного кислорода и образование высокореактивной формы оксиферрила по следующей схеме: [6]
Фаза II – конъюгация [ править ]
В последующих реакциях фазы II эти активированные метаболиты ксенобиотиков конъюгируются с заряженными соединениями, такими как глутатион (GSH), сульфат , глицин или глюкуроновая кислота . Эти реакции катализируются большой группой трансфераз широкой специфичности, которые в сочетании могут метаболизировать практически любое гидрофобное соединение, содержащее нуклеофильные или электрофильные группы. [1] Одной из наиболее важных из этих групп являются глутатион-S-трансферазы (GST). Добавление крупных анионных групп (таких как GSH) детоксицирует реактивные электрофилы и производит более полярные метаболиты, которые не могут диффундировать через мембраны и, следовательно, могут активно транспортироваться.
– дальнейшая модификация выведение и Фаза III
После реакций фазы II конъюгаты ксенобиотиков могут подвергаться дальнейшему метаболизму. Типичным примером является обработка конъюгатов глутатиона в конъюгаты ацетилцистеина (меркаптуровой кислоты). [7] Здесь остатки γ-глутамата и глицина в молекуле глутатиона удаляются гамма-глутамилтранспептидазой и дипептидазой . На заключительном этапе остаток цистина в конъюгате ацетилируется .
Конъюгаты и их метаболиты могут выводиться из клеток на этапе III их метаболизма, при этом анионные группы действуют как аффинные метки для различных мембранных переносчиков семейства белков множественной лекарственной устойчивости (MRP). [8] Эти белки являются членами семейства АТФ-связывающих кассетных переносчиков и могут катализировать АТФ-зависимый транспорт огромного количества гидрофобных анионов. [9] и, таким образом, способствуют удалению продуктов фазы II во внеклеточную среду, где они могут подвергаться дальнейшему метаболизму или выведению из организма. [10]
Эндогенные токсины [ править ]
Детоксикация эндогенных реактивных метаболитов, таких как пероксиды и реактивные альдегиды, часто не может быть достигнута с помощью системы, описанной выше. Это результат того, что эти виды произошли от нормальных клеточных компонентов и обычно имеют общие полярные характеристики. Однако, поскольку этих соединений немного, ферментные системы могут использовать специфическое молекулярное распознавание для их распознавания и удаления. Таким образом, сходство этих молекул с полезными метаболитами означает, что для метаболизма каждой группы эндогенных токсинов обычно требуются разные ферменты детоксикации. Примерами таких специфических систем детоксикации являются глиоксалазная система , которая удаляет активный альдегид метилглиоксаль , и различные антиоксидантные системы, которые удаляют активные формы кислорода .
История [ править ]
Исследования того, как люди преобразуют вещества, которые они потребляют, начались в середине девятнадцатого века, когда химики обнаружили, что органические химические вещества, такие как бензальдегид, могут окисляться и конъюгироваться с аминокислотами в человеческом организме. [11] В течение оставшейся части девятнадцатого века было открыто несколько других основных реакций детоксикации, таких как метилирование , ацетилирование и сульфирование .
В начале двадцатого века работа перешла к исследованию ферментов и путей, ответственных за выработку этих метаболитов. Эта область стала выделена в отдельную область исследований после публикации Ричардом Уильямсом книги «Механизмы детоксикации» в 1947 году. [12] Это современное биохимическое исследование привело к идентификации глутатион S -трансфераз в 1961 году. [13] за которым последовало открытие цитохрома P450 в 1962 году, [14] и осознание их центральной роли в метаболизме ксенобиотиков в 1963 году. [15] [16]
См. также [ править ]
- Дизайн лекарств
- Метаболизм лекарств
- Микробное биоразложение
- Биодеградация
- Биоремедиация
- антиоксидант
- SPORCalc, пример процесса изучения баз данных ксенобиотиков и метаболизма лекарств. [17]
Ссылки [ править ]
- ↑ Перейти обратно: Перейти обратно: а б с Якоби В.Б., Зиглер DM (5 декабря 1990 г.). «Ферменты детоксикации» . Ж. Биол. Хим . 265 (34): 20715–8. дои : 10.1016/S0021-9258(17)45272-0 . ПМИД 2249981 .
- ^ Мизуно Н., Нива Т., Ёцумото Ю., Сугияма Ю. (2003). «Влияние исследований транспортеров лекарств на открытие и разработку лекарств» . Фармакол. Преподобный . 55 (3): 425–61. дои : 10.1124/пр.55.3.1 . ПМИД 12869659 .
- ^ Торнелли П.Дж. (1 января 1990 г.). «Система глиоксалазы: новые разработки в области функциональной характеристики метаболического пути, фундаментального для биологической жизни» . Биохим. Дж . 269 (1): 1–11. дои : 10.1042/bj2690001 . ПМЦ 1131522 . ПМИД 2198020 .
- ^ Сис Х (1997). «Окислительный стресс: оксиданты и антиоксиданты» (PDF) . Опыт Физиол . 82 (2): 291–5. doi : 10.1113/expphysicalol.1997.sp004024 . ПМИД 9129943 .
- ^ Гюнгерих Ф.П. (2001). «Распространенные и необычные реакции цитохрома P450, связанные с метаболизмом и химической токсичностью». хим. Рез. Токсикол . 14 (6): 611–50. дои : 10.1021/tx0002583 . ПМИД 11409933 .
- ^ Шлихтинг И., Берендзен Дж., Чу К. и др. (2000). «Каталитический путь цитохрома p450cam при атомном разрешении». Наука . 287 (5458): 1615–22. Бибкод : 2000Sci...287.1615S . дои : 10.1126/science.287.5458.1615 . ПМИД 10698731 .
- ^ Бойланд Э., Шассо Л.Ф. (1969). «Роль глутатиона и глутатион S-трансфераз в биосинтезе меркаптуровой кислоты». Достижения энзимологии и смежных областей молекулярной биологии . Достижения в энзимологии и смежных областях молекулярной биологии. Том. 32. стр. 173–219. дои : 10.1002/9780470122778.ch5 . ISBN 978-0-470-64961-9 . ПМИД 4892500 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Гомоля Л., Варади А., Саркади Б. (2003). «Белки, связанные с множественной лекарственной устойчивостью: экспортные насосы для конъюгатов с глутатионом, глюкуронатом или сульфатом». Биофакторы . 17 (1–4): 103–14. дои : 10.1002/biof.5520170111 . ПМИД 12897433 .
- ^ Кениг Дж., Нис А.Т., Куи Ю., Лейер И., Кепплер Д. (1999). «Конъюгатные экспортные насосы семейства белков множественной лекарственной устойчивости (MRP): локализация, субстратная специфичность и MRP2-опосредованная лекарственная устойчивость» . Биохим. Биофиз. Акта . 1461 (2): 377–94. дои : 10.1016/S0005-2736(99)00169-8 . ПМИД 10581368 .
- ^ Коммандер Дж. Н., Стейнтьес Г. Дж., Вермюлен Н. П. (1995). «Ферменты и транспортные системы, участвующие в образовании и утилизации S-конъюгатов глутатиона. Роль в механизмах биоактивации и детоксикации ксенобиотиков». Фармакол. Преподобный . 47 (2): 271–330. PMID 7568330 .
- ^ Мерфи Пи Джей (1 июня 2001 г.). «Метаболизм ксенобиотиков: взгляд из прошлого в будущее» . Метаб. препарата. Диспос . 29 (6): 779–80. ПМИД 11353742 .
- ^ Ричард Теквин Уильямс. 20 февраля 1909 г. - 29 декабря 1979 г. А. Нойбергер, Р. Л. Смит. Биографические мемуары членов Королевского общества, Vol. 28 ноября 1982 г. (ноябрь 1982 г.), стр. 685-717.
- ^ Бут Дж., Бойленд Э., Симс П. (1 июня 1961 г.). «Фермент из печени крысы, катализирующий конъюгацию с глутатионом» . Биохим. Дж . 79 (3): 516–24. дои : 10.1042/bj0790516 . ПМК 1205680 . ПМИД 16748905 .
- ^ Омура Т., Сато Р. (1 апреля 1962 г.). «Новый цитохром в микросомах печени» . Ж. Биол. Хим . 237 (4): 1375–6. дои : 10.1016/S0021-9258(18)60338-2 . ПМИД 14482007 .
- ^ Эстабрук Р.В. (2003). «Страсть к P450 (воспоминания о ранней истории исследований цитохрома P450)» . Метаб. препарата. Диспос . 31 (12): 1461–73. дои : 10.1124/dmd.31.12.1461 . ПМИД 14625342 .
- ^ Эстабрук Р.В., Купер Д.Ю., Розенталь О. (1963). «Легкое обратимое ингибирование угарным газом системы стероидной C-21-гидроксилазы в коре надпочечников». Биохим. З. 338 : 741–55. ПМИД 14087340 .
- ^ Смит Дж., Штейн В. (2009). «SPORCalc: разработка анализа базы данных, которая обеспечивает предполагаемые метаболические ферментативные реакции для разработки лекарств на основе лигандов». Вычислительная биология и химия . 33 (2): 149–159. doi : 10.1016/j.compbiolchem.2008.11.002 . ПМИД 19157988 .
Дальнейшее чтение [ править ]
- Х. Парвез и К. Рейсс (2001). Молекулярные реакции на ксенобиотики . Эльзевир. ISBN 0-345-42277-5 .
- К. Иоаннидес (2001). Ферментные системы, метаболизирующие лекарства и другие ксенобиотики . Джон Уайли и сыновья. ISBN 0-471-89466-4 .
- М. Ричардсон (1996). Экологические ксенобиотики . Тейлора и Фрэнсиса Лтд. ISBN 0-7484-0399-Х .
- К. Иоаннидес (1996). Цитохромы P450: метаболические и токсикологические аспекты . CRC Press Inc. ISBN 0-8493-9224-1 .
- YC Авасти (2006). Токсикология S-переносов глутатиона . CRC Press Inc. ISBN 0-8493-2983-3 .
Внешние ссылки [ править ]
Базы данных
- База данных метаболизма лекарств
- Справочник систем, содержащих P450
- База данных Университета Миннесоты по биокатализу/биодеградации
Метаболизм лекарств
Микробное биоразложение
История
