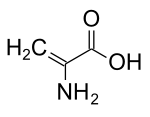
Дегидроаланин
| |
| |
| Имена | |
|---|---|
| Предпочтительное имя IUPAC
2-аминопроп-2-лечебная кислота | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| Чеби | |
| Chemspider | |
| Наркоман | |
| Кегг | |
PubChem CID
|
|
| НЕКОТОРЫЙ | |
Comptox Dashboard ( EPA )
|
|
| Характеристики | |
| C 3 H 5 № 2 | |
| Молярная масса | 87.08 g/mol |
За исключением случаев, когда отмечены, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа).
| |
Дегидроаланин ( Cα, β-дидегидроаланин , α, β-Di-дегидроаланин , 2-аминоакрилат или 2,3-дидегидроалнин ) является дегидроаминокислотой . Он не существует в своей свободной форме, но он встречается естественным образом как остаток, обнаруженный в микробного происхождения пептидах . [ 1 ] Как аминокислотный остаток, это необычно, потому что он имеет ненасыщенную основу. [ 2 ]
Структура и реактивность
[ редактировать ]Как и большинство первичных эмаминов , дегидроаланин нестабилен. Дегидроаланиновые гидролизу в пируват .
N -ацилированные производные дегидроаланина, таких как пептиды и связанные с ними соединения, являются стабильными. Например, метил 2-ацетамидоакрилат является N-ацетилированным производным эфира. В качестве остатка в пептиде он генерируется посте -трансляционной модификацией . Необходимыми предшественниками являются остатки серина или цистеина , которые подвергаются ферментам, опосредованной потерей воды и сероводорода , соответственно.
Большинство аминокислотных остатков нереактивны в сторону нуклеофилов , но те, которые содержат дегидроаланин или некоторые другие дегидроаминокислоты, являются исключениями. Они электрофильные из-за α, β-безсыщенного карбонила , [ 2 ] и может, например, алкилат другие аминокислоты. Эта деятельность сделала DHA полезным синтетически для подготовки лантионина .
Возникновение
[ редактировать ]Остаток дегидроаланина был впервые обнаружен в низине , циклическом пептиде с антимикробной активностью. [ 2 ] Дегидроаланин также присутствует в некоторых лантибиотиках и микроцистинах .
DHA может быть образован из цистеина или серина с помощью простого базового катализа без необходимости в ферменте, который может произойти во время приготовления пищи и щелочной приготовления пищи. Затем он может алкилазировать другие аминокислотные остатки, такие как лизин , образуя лизиноаланиновые поперечные связи и ракотизацию оригинального аланина. Полученные белки имеют более низкое качество питания для некоторых видов, но более высокое качество питания для других. Некоторые лисиноаланины могут также вызвать увеличение почек у крыс. [ 3 ]
Многие дегидроланиносодержащие пептиды токсичны. [ 2 ]

Дегидроаланиновый остаток, как долго, как считалось, является важным электрофильным каталитическим остатком в ферментах гистидина аммиак-линиазы и фенилаланино-аммиак-линиазы , но впоследствии был обнаружен активным остатком, вместо этого является другим ненасыщенным производным аланина- 3,5-дигидро-5-летиденойен. -4 ч -имидазол-4-один -это еще более электрофильно. [ 4 ] [ 5 ]
Химический синтез
[ редактировать ]Дегидроланиновые производные N -ацил были синтезированы путем обезвоживания серин с использованием группы по уходу за трет -бутоксикарбонатом , [ 6 ] или путем преобразования производных цистеина с использованием различных реагентов для устранения тиоловой группы. [ 7 ]
Новейшие методы допускают синтез грамма масштаба различных защищенных дегидроаминокислот путем электрохимического окисления соответствующего производного аминокислот в метаноле, за которым с последующей кислотой катализируемой элиминацией метанола. [ 8 ]
Ссылки
[ редактировать ]- ^ Даунс, DM; Эрнст, округ Колумбия (апрель 2015 г.). «От микробиологии до биологии рака: семейство белков RID предотвращает повреждение клеток, вызванное эндогенно генерируемыми реактивными видами азота» . Молекулярная микробиология . 96 (2): 211–9. doi : 10.1111/mmi.12945 . PMC 4974816 . PMID 25620221 .
- ^ Jump up to: а беременный в дюймовый Siodłak, Dawid (2015). «α, β-дегидроаминокислоты в природных пептидах» . Аминокислоты . 47 (1): 1–17. doi : 10.1007/s00726-014-1846-4 . PMC 4282715 . PMID 25323736 .
- ^ Фридман, Мендель (1999). «Лисиноаланин в пище и в антимикробных белках». В Джексоне, Лорен с.; Neize, Mark G.; Морган, Джеффри Н. (ред.). Влияние обработки на безопасность пищевых продуктов . Достижения в области экспериментальной медицины и биологии. Тол. 459. Springer. С. 145–159. doi : 10.1007/978-1-4615-4853-9_10 . ISBN 978-1-4615-4853-9 Полем PMID 10335374 .
- ^ Rétey, János (2003). «Открытие и роль метилденового имидазолона, высоко электрофильной протезной группы». Biochimica et Biophysica Acta (BBA) - белки и протеомика . 1647 (1–2): 179–184. doi : 10.1016/s1570-9639 (03) 00091-8 . PMID 12686130 .
- ^ Calabrese JC, Jordan DB, Boodhoo A, Sariaslani S, Vannelli T (сентябрь 2004 г.). «Кристаллическая структура фенилаланина аммиачной лиазы: множественные спиральные диполи, участвующие в катализе». Биохимия . 43 (36): 11403–16. doi : 10.1021/bi049053+ . PMID 15350127 .
- ^ Ferreirira, Poulling Mt; Майя, Эрнани Л.С.; Монтейро, Луис с.; Причастие, Джоана (1999). 3 ... Хик и 11930 лет Переходы 1 (24: 3697–3 doi : 10.1039/a90470a . HDL : 1822/2188 .
- ^ Chalker, Джастин М.; Gunnoo, Smita B.; Бутурера, Омар; Gerstberger, Stefanie C.; Фернандес-Гонсалес, Марта; Бернардес, Гонсало Дж.Л.; Гриффин, Лора; Хайлу, Ханна; Шофилд, Кристофер Дж.; Дэвис, Бенджамин Г. (2011). «Методы преобразования цистеина в дегидроаланин на пептидах и белках» . Химическая наука . 2 (9): 1666. doi : 10.1039/c1sc00185j . ISSN 2041-6520 .
- ^ Гаусманн, Марсель; Крейдт, Надин; Кристманн, Матиас (2023-04-07). «Электросинтез защищенных дегидроаминокислот» . Органические буквы . 25 (13): 2228–2232. doi : 10.1021/acs.orglett.3c00403 . ISSN 1523-7060 . PMID 36952622 . S2CID 257716096 .