Реакция Пикте-Шпенглера
| Реакция Пикте-Шпенглера | |
|---|---|
| Назван в честь | Мне понравился Пикте Теодор Шпенглер |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| RSC Идентификатор онтологии | RXNO: 0000059 |
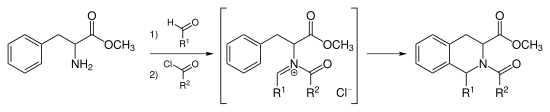
Реакция Пикте-Шпенглера представляет собой химическую реакцию , в которой β-ариэтиламин подвергается конденсации с альдегидом или кетоном с последующим замыканием кольца. Реакция была впервые обнаружена в 1911 году Аме Пикте и Теодором Шпенглером (22 февраля 1886 г. - 18 августа 1965 г.). [ 1 ] Традиционно кислотный катализатор в протонном растворителе при нагревании; использовали [ 2 ] однако было показано, что реакция протекает в апротонной среде с превосходными выходами, а иногда и без кислотного катализа . [ 3 ] Реакцию Пикте-Шпенглера можно считать частным случаем реакции Манниха , которая следует по аналогичному пути реакции. Движущей силой этой реакции является электрофильность иона иминия, образующегося в результате конденсации альдегида и амина в кислых условиях. Это объясняет необходимость в кислотном катализаторе в большинстве случаев, поскольку имин недостаточно электрофилен для замыкания кольца, но ион иминия способен вступать в реакцию.

Реакция Пикте-Шпенглера широко распространена как в промышленности, так и в биосинтезе. С момента своего создания он оставался важной реакцией в области алкалоидного и органического синтеза , где его использовали при разработке многих бета-карболинов . В естественной реакции Пикте-Шпенглера обычно используется фермент , такой как стриктозидинсинтаза . Продукты Пикте-Шпенглера можно выделить из многих продуктов, изначально полученных из природы, включая такие продукты питания, как соевый соус и кетчуп . обычно используют аминокислоту триптофан и различные альдозы В таких случаях в качестве биологического сырья .
Нуклеофильные ароматические кольца, такие как индол или пиррол, дают продукты с высокими выходами и в мягких условиях, тогда как менее нуклеофильные ароматические кольца, такие как фенильная группа, дают меньшие выходы или требуют более высоких температур и сильной кислоты. Первоначальная реакция Пикте-Шпенглера представляла собой реакцию фенэтиламина и диметоксиметана , катализируемую соляной кислотой с образованием тетрагидроизохинолина .
Реакция Пикте-Шпенглера с большим успехом применяется в твердофазной комбинаторной химии . [ 4 ] [ 5 ]
Аналогичная реакция с арил-β-этанолом называется реакцией окса-Пикте-Шпенглера . [ 6 ]
Механизм реакции
[ редактировать ]Механизм реакции происходит путем первоначального образования иминиевого иона ( 2 ) с последующим электрофильным присоединением в положении 3, в соответствии с ожидаемой нуклеофильностью индолов , с образованием спироцикла 3 . После миграции лучшей мигрирующей группы депротонирование дает продукт ( 5 ).

Вариации
[ редактировать ]Синтез тетрагидроизохинолина Пикте-Шпенглера
[ редактировать ]Замена индола на 3,4-диметоксифенильную группу дает реакцию, названную синтезом тетрагидроизохинолина Пикте-Шпенглера. Условия реакции обычно более суровы, чем в индольном варианте, и требуют условий кипячения с сильными кислотами, такими как соляная кислота , трифторуксусная кислота или суперкислоты . [ 7 ] [ 8 ]

Ион N -ацилиминия Реакция Пикте – Шпенглера
[ редактировать ]Вместо катализа циклизации Пикте-Шпенглера сильной кислотой можно ацилировать ион иминия с образованием промежуточного иона N -ацилиминия. Ион N -ацилиминия является очень мощным электрофилом , и большинство ароматических кольцевых систем циклизуются в мягких условиях с хорошими выходами. [ 9 ]
Тадалафил синтезируется по реакции N -ацилиминия Пикте-Шпенглера. [ 10 ] Эту реакцию также могут катализировать AuCl 3 и AgOTf . [ 11 ]
Асимметричная реакция Пикте – Шпенглера
[ редактировать ]Когда реакция Пикте-Шпенглера проводится с альдегидом, отличным от формальдегида , создается новый хиральный центр. реакций Пикте-Шпенглера, контролируемых субстратом или вспомогательными веществами . несколько диастереоселективных Было разработано [ 12 ] [ 13 ] Кроме того, Лист и др. опубликовали хиральную кислоту Бренстеда , которая катализирует асимметричные реакции Пикте-Шпенглера. [ 14 ]
Триптофаны: диастереоконтролируемая реакция
Реакция энантиочистого триптофана или его короткоцепочечных алкиловых эфиров приводит к образованию 1,2,3,4-тетрагидро- β -карболинов, в которых новый хиральный центр при С-1 принимает либо цис- , либо транс- конфигурацию С-3. по отношению к карбоксилу группа. Цис - проводимость контролируется кинетически , т.е. осуществляется при более низких температурах. При более высоких температурах реакция становится обратимой и обычно приводит к рацемизации . 1,3- транс- доминированные продукты можно получить с помощью - Nb бензилированных триптофанов , доступных путем восстановительного аминирования . Бензильную группу впоследствии можно удалить гидрогенолитически . Как грубое правило, 13 Сигналы C ЯМР для C1 и C3 смещены в слабое поле в цис- продуктах относительно транс - продуктов (см. Эффект стерического сжатия ). [ 3 ] [ 15 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Пикте, А.; Шпенглер, Т. (1911). «Об образовании производных изохинолина действием метилаля на фенилэтиламин, фенилаланин и тирозин» . Отчеты Немецкого химического общества . 44 (3): 2030–2036. дои : 10.1002/cber.19110440309 .
- ^ Уэйли, WM; Говиндачири, Т.Р. (1951). «Синтет Пикте-Шпенглера тетрагидроизохинолинов и родственных соединений». Орг. Реагируйте . 6:74 .
- ^ Перейти обратно: а б Кокс, Эд; Кук, Дж. М. (1995). «Конденсация Пикте-Шпенглера: новое направление старой реакции». Химические обзоры . 95 (6): 1797–1842. дои : 10.1021/cr00038a004 .
- ^ Нильсен, ТЭ; Динесс, Ф.; Мелдал, М. (2003). «Твердофазный синтез пирролоизохинолинов посредством внутримолекулярной реакции N-ацилиминия Пикте-Шпенглера». Курс. Мнение. Препарат Дисков. Дев . 6 (6): 801–814. ПМИД 14758752 .
- ^ Нильсен, ТЭ; Мелдал, М. (2005). «Твердофазный синтез пирролоизохинолинов посредством внутримолекулярной реакции N-ацилиминия Пикте-Шпенглера». Дж. Комб. хим. 7 (4): 599–610. дои : 10.1021/cc050008a . ПМИД 16004504 .
- ^ Ларги, Эль; Кауфман, Т.С. (2006). «Циклизация окса-Пикте-Шпенглера. Синтез изохроманов и родственных гетероциклов пиранового типа». Синтез (2): 187–210. дои : 10.1055/s-2005-918502 .
- ^ Ёкояма, Акихиро; Овада, Томохико; Шудо, Коичи (1999). «Прототип реакций Пикте-Шпенглера, катализируемых суперкислотами. Участие дикатионных суперэлектрофилов». Дж. Орг. хим. 64 (2): 611–617. дои : 10.1021/jo982019e .
- ^ Кеведо, Р.; Бакеро, Э.; Родригес, М. (2010). «Региоселективность в синтезе изохинолиновых алкалоидов». Буквы тетраэдра . 51 (13): 1774–1778. дои : 10.1016/j.tetlet.2010.01.115 .
- ^ Марьянов, BE; Чжан, Х.-К.; Коэн, Дж. Х.; Турчи, Эй Джей; Марьянов, Калифорния (2004). «Циклизации ионов N-ацилиминия». хим. Откр. 104 (3): 1431–1628. дои : 10.1021/cr0306182 . ПМИД 15008627 .
- ^ Бонне, Д.; Ганесан, А. (2002). «Твердофазный синтез тетрагидро-β-карболингидантоинов посредством реакции N-ацилиминия Пикте-Шпенглера и циклического расщепления». Дж. Комб. хим. 4 (6): 546–548. дои : 10.1021/cc020026h . ПМИД 12425597 .
- ^ Юн, SW (2006). «Развитие реакции Пикте-Шпенглера, катализируемой AuCl 3 /AgOTf». Дж. Орг. хим. 71 (6): 2521–2523. дои : 10.1021/jo0524775 . ПМИД 16526809 .
- ^ Греммен, К.; Виллемс, Б.; Ваннер, MJ; Кумен, Г.-Ж. (2000). «Энантиочистые тетрагидро-β-карболины посредством реакций Пикте-Шпенглера с N-сульфинилтриптаминами». Орг. Летт. 2 (13): 1955–1958. дои : 10.1021/ol006034t . ПМИД 10891200 .
- ^ а) Межмолекулярная конденсация Пикте-Шпенглера с хиральными карбонильными производными в стереоселективном синтезе оптически активных изохинолиновых и индольных алкалоидов Энрике Л. Ларги, Марсела Средиро, Андреа Б. Дж. Бракка и Теодоро С. Кауфман Аркивок (RL-1554K), стр. 98 –153 2005 ( Интернет-обзор) [ постоянная мертвая ссылка ] ); б) Теодоро С. Кауфман «Синтез оптически активных изохинолиновых и индольных алкалоидов с использованием конденсации Пикте-Шпенглера с удаляемыми хиральными вспомогательными веществами, связанными с азотом». в «Новых методах асимметричного синтеза азотных гетероциклов»; Ред.: Дж. Л. Викарио. ISBN 81-7736-278-X . Research SignPost, Тривандрам, Индия. 2005. Глава 4, стр. 99–147.
- ^ Сияд, Дж.; Сияд, AM; Лист, Б. (2006). «Каталитическая асимметричная реакция Пикте-Шпенглера». Дж. Ам. хим. Соц. 128 (4): 1086–1087. дои : 10.1021/ja057444l . ПМИД 16433519 .
- ^ Унгемах, Ф.; Серенс, Д.; Вебер, Р.; Дипьерро, М.; Кампос, О.; Мокры, П.; Кук, Дж. М.; Сильвертон, СП (1980). «Общий метод определения стереохимии 1,3-дизамещенных 1,2,3,4-тетрагидро-β-карболинов методом спектроскопии углерода-13». Дж. Ам. хим. Соц. 102 (23): 6976–6984. дои : 10.1021/ja00543a012 .