Множественность (химия)
В спектроскопии и квантовой химии кратность уровня энергетического S определяется как 2S+1 , где — это полный спиновый угловой момент . [1] [2] [3] Состояния с кратностью 1, 2, 3, 4, 5 называются соответственно синглетами , дублетами , триплетами , квартетами и квинтетами. [2]
В основном состоянии атома или молекулы неспаренные электроны обычно имеют параллельный спин. В этом случае множественность также равна числу неспаренных электронов плюс один. [4]
Атомы
[ редактировать ]Множественность часто равна числу возможных ориентаций полного спина. [3] по отношению к полному орбитальному угловому моменту L и, следовательно, к числу околовырожденных уровней , различающихся только энергией спин-орбитального взаимодействия .
Например, основное состояние атома углерода : 3 P ( символ термина ). Верхний индекс три (читается как триплет ) указывает, что множественность 2S+1 = 3, так что общий спин S = 1. Этот спин обусловлен двумя неспаренными электронами в результате правила Хунда , которое благоприятствует однократному заполнению вырожденных орбиталей. . Триплет состоит из трех состояний со спиновыми компонентами +1, 0 и –1 вдоль направления полного орбитального углового момента, который также равен 1, что обозначено буквой P. Квантовое число полного углового момента J может варьироваться от L+S. = 2 до L–S = 0 целыми шагами, так что J = 2, 1 или 0. [1] [2]
Однако множественность равна количеству ориентаций спина только в том случае, если S ≤ L. Когда S > L, возможны только 2L+1 ориентации полного углового момента в диапазоне от S+L до SL. [2] [3] Основное состояние атома азота – это 4 S-состояние, для которого 2S+1 =4, в квартетном состоянии S =3/2 за счет трех неспаренных электронов. Для состояния S L = 0, так что J может быть только 3/2 и существует только один уровень, даже если кратность равна 4.
Молекулы
[ редактировать ]Большинство стабильных органических молекул имеют полную электронную оболочку без неспаренных электронов и, следовательно, имеют синглетные основные состояния. Это справедливо и для неорганических молекул, содержащих только элементы основной группы . Важными исключениями являются дикислород (O 2 ), а также метилен (CH 2 ) и другие карбены .
Однако основные состояния с более высокими спинами очень распространены в координационных комплексах металлов переходных . Простое объяснение спиновых состояний таких комплексов дает теория кристаллического поля .
Дикислород
[ редактировать ]Самый высокий занятый орбитальный энергетический уровень дикислорода представляет собой пару разрыхляющих π* -орбиталей. В основном состоянии дикислорода этот энергетический уровень занят двумя электронами одного и того же спина, как показано на диаграмме молекулярных орбиталей . Молекула, следовательно, имеет два неспаренных электрона и находится в триплетном состоянии.
Напротив, первое и второе возбужденные состояния дикислорода являются состояниями синглетного кислорода . Каждый из них имеет два электрона с противоположным спином на уровне π*, так что S = 0 и, как следствие, множественность равна 2S + 1 = 1.
В первом возбужденном состоянии два π*-электрона спарены на одной орбитали, так что неспаренных электронов нет. Однако во втором возбужденном состоянии два π*-электрона занимают разные орбитали с противоположным спином. Таким образом, каждый из них представляет собой неспаренный электрон, но общий спин равен нулю, а множественность равна 2S + 1 = 1, несмотря на наличие двух неспаренных электронов. Поэтому множественность второго возбужденного состояния не равна числу его неспаренных электронов плюс один, и правило, которое обычно справедливо для основных состояний, для этого возбужденного состояния недействительно.
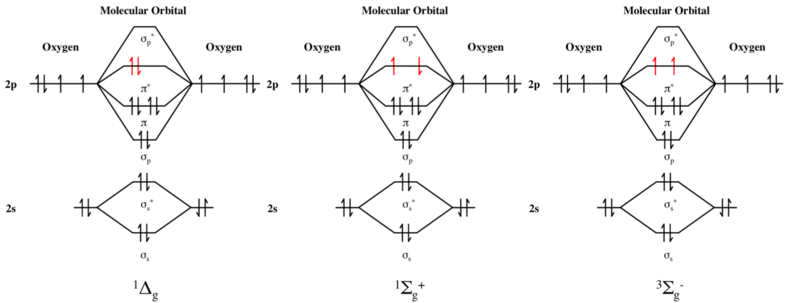
g синглетный кислород (второе возбужденное состояние) и 3 С −
g триплетный кислород (основное состояние).
Карбены
[ редактировать ]В органической химии карбены — это молекулы, которые имеют атомы углерода только с шестью электронами в валентных оболочках и поэтому не подчиняются правилу октетов . [5] Карбены обычно распадаются на синглетные и триплетные карбены, названные в честь их спиновой кратности. Оба имеют два несвязывающих электрона; в синглетных карбенах они существуют в виде неподеленной пары и имеют противоположные спины, так что суммарного спина нет, тогда как в триплетных карбенах эти электроны имеют параллельные спины. [6]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Аткинс и де Паула 2006 , с. 353.
- ^ Jump up to: а б с д Левин 1991 , с. 308.
- ^ Jump up to: а б с «множественность (спиновая множественность)» . Сборник химической терминологии ИЮПАК . ИЮПАК ( Международный союз теоретической и прикладной химии ). 2006. doi : 10.1351/goldbook.M04062 . ISBN 0-9678550-9-8 . Проверено 30 марта 2018 г.
- ^ Мисслер и Тарр 1999 , с. 33.
- ^ Клейден и др. 2001 , с. 1055.
- ^ Клейден и др. 2001 , с. 1061.
Библиография
[ редактировать ]- Аткинс, Питер; де Паула, Хулио (2006). Физическая химия Аткинса (8-е изд.). США: Издательство Оксфордского университета . ISBN 0-7167-8759-8 .
- Клейден, Джонатан; Гривз, Ник; Уоррен, Стюарт; Уотерс, Питер (2001). Органическая химия . США: Издательство Оксфордского университета . ISBN 0-19-850346-6 .
- Левин, Ира Н. (1991). Квантовая химия (4-е изд.). США: Прентис-Холл . ISBN 0-205-12770-3 .
- Мисслер, Гэри Л.; Тарр, Дональд А. (1999). Неорганическая химия (2-е изд.). Прентис-Холл. ISBN 0-13-841891-8 .