Двухгибридный скрининг
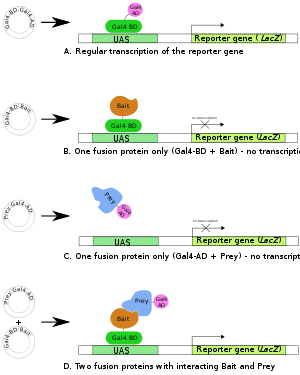
А. Ген транскрипционного фактора Gal4 продуцирует двухдоменный белок ( BD и AD ), необходимый для транскрипции репортерного гена ( LacZ ).
Б , С. Готовят два слитых белка: Gal4BD+Bait и Gal4AD+Prey . Ни одного из них обычно недостаточно для инициации транскрипции (гена-репортера) в одиночку.
Д. Когда образуются оба слитых белка и часть Bait первого слитого белка взаимодействует с частью Prey второго, происходит транскрипция репортерного гена.
Двухгибридный скрининг (первоначально известный как дрожжевая двухгибридная система или Y2H ) — это метод молекулярной биологии, используемый для обнаружения белок-белковых взаимодействий (PPI). [1] и взаимодействие белок-ДНК [2] [3] путем тестирования физических взаимодействий (например, связывания) между двумя белками или одним белком и молекулой ДНК соответственно.
Предпосылкой теста является активация нижестоящих репортерных генов путем связывания транскрипционного фактора с вышестоящей активирующей последовательностью (UAS). Для двухгибридного скрининга фактор транскрипции разделяется на два отдельных фрагмента, называемых ДНК-связывающим доменом (DBD или часто также сокращенно BD) и активирующим доменом (AD). BD — это домен , ответственный за связывание с UAS, а AD — это домен, ответственный за активацию транскрипции . [1] [2] Таким образом, Y2H представляет собой анализ комплементации белковых фрагментов .
История
[ редактировать ]впервые разработанный Стэнли Филдсом Этот метод, и Ок-Кю Сонгом в 1989 году, первоначально был разработан для обнаружения белок-белковых взаимодействий с использованием активатора транскрипции Gal4 дрожжей Saccharomyces cerevisiae . Белок Gal4 активировал транскрипцию гена, участвующего в утилизации галактозы, что легло в основу селекции. [4] С тех пор тот же принцип был адаптирован для описания многих альтернативных методов, в том числе тех, которые обнаруживают взаимодействия белок-ДНК или взаимодействия ДНК-ДНК , а также методов, в которых вместо дрожжей используются различные организмы-хозяева, такие как Escherichia coli или клетки млекопитающих. [3] [5]
Основная предпосылка
[ редактировать ]Ключом к двухгибридному скринингу является то, что в большинстве эукариотических транскрипционных факторов активирующий и связывающий домены являются модульными и могут функционировать вблизи друг друга без прямого связывания. [6] Это означает, что даже несмотря на то, что транскрипционный фактор разделен на два фрагмента, он все равно может активировать транскрипцию, когда два фрагмента связаны косвенно.
Наиболее распространенным методом скрининга является двухгибридный дрожжевой анализ. При таком подходе исследователь знает, где находится каждая жертва на используемой среде (чашках с агаром). (часто с использованием роботов) были проверены миллионы потенциальных взаимодействий в нескольких организмах За последнее десятилетие с использованием высокопроизводительных систем скрининга , а более тысячи взаимодействий были обнаружены и классифицированы в базах данных как BioGRID . [7] [8] В этой системе часто используется генетически модифицированный штамм дрожжей, в котором биосинтез определенных питательных веществ (обычно аминокислот или нуклеиновых кислот отсутствует ). При выращивании на среде, в которой отсутствуют эти питательные вещества, дрожжи не выживают. Этот мутантный штамм дрожжей можно заставить включать чужеродную ДНК в форме плазмид . При двухгибридном скрининге дрожжей отдельные плазмиды-приманки и жертвы одновременно вводятся в мутантный штамм дрожжей или используется стратегия спаривания для получения обеих плазмид в одной клетке-хозяине. [9]
Второй высокопроизводительный подход — это подход к проверке библиотек. В этой схеме клетки, содержащие приманку и добычу, спариваются в случайном порядке. После спаривания и отбора выживших клеток на селективной среде ученый секвенирует выделенные плазмиды, чтобы увидеть, какая добыча (последовательность ДНК) взаимодействует с использованной приманкой. Этот подход имеет более низкую воспроизводимость и имеет тенденцию давать большее количество ложноположительных результатов по сравнению с матричным подходом. [9]
Плазмиды сконструированы для производства белкового продукта, в котором фрагмент ДНК-связывающего домена (BD) слит с белком, в то время как другая плазмида сконструирована для производства белкового продукта, в котором фрагмент домена активации (AD) слит с другим белком. Белок, слитый с BD, можно назвать белком-приманкой, и обычно он представляет собой известный белок, который исследователь использует для идентификации новых партнеров по связыванию. Белок, слитый с AD, может называться белком-жертвой и может представлять собой либо один известный белок, либо библиотеку известных или неизвестных белков. В этом контексте библиотека может состоять из набора последовательностей, кодирующих белки, которые представляют все белки, экспрессируемые в конкретном организме или ткани, или может быть создана путем синтеза случайных последовательностей ДНК. [3] Независимо от источника, они впоследствии включаются в кодирующую белок последовательность плазмиды, которую затем трансфицируют в клетки, выбранные для метода скрининга. [3] Этот метод при использовании библиотеки предполагает, что каждая клетка трансфицируется не более чем одной плазмидой и, следовательно, каждая клетка в конечном итоге экспрессирует не более одного члена белковой библиотеки.
Если белки-приманки и жертвы взаимодействуют (т.е. связываются), то AD и BD транскрипционного фактора связаны косвенно, в результате чего AD приближается к месту начала транскрипции, и может произойти транскрипция репортерного гена(ов). Если два белка не взаимодействуют, транскрипция репортерного гена отсутствует. Таким образом, успешное взаимодействие слитых белков связано с изменением фенотипа клетки. [1]
Проблема отделения клеток, экспрессирующих белки, которые взаимодействуют со своими аналогами слитых белков, от тех, которые этого не делают, рассматривается в следующем разделе.
Фиксированные домены
[ редактировать ]В любом исследовании некоторые из исследуемых белковых доменов будут варьироваться в зависимости от целей исследования, тогда как другие домены, которые сами по себе не исследуются, останутся постоянными. Например, в двухгибридном исследовании по выбору ДНК-связывающих доменов ДНК-связывающий домен, BD, будет варьироваться, в то время как два взаимодействующих белка, приманка и жертва, должны оставаться постоянными, чтобы поддерживать прочное связывание между BD. и АД. Существует ряд доменов, из которых можно выбрать BD, приманку и добычу и AD, если они хотят, чтобы они оставались постоянными. В исследованиях белок-белковых взаимодействий BD может быть выбран из любого из многих сильных ДНК-связывающих доменов, таких как Zif268 . [2] Частым выбором доменов-приманок и жертв являются остатки 263–352 дрожжевого Gal11P с мутацией N342V. [2] и остатки 58–97 дрожжевого Gal4, [2] соответственно. Эти домены можно использовать как в дрожжевых, так и в бактериальных методах селекции, и известно, что они прочно связываются друг с другом. [1] [2]
Выбранный AD должен быть способен активировать транскрипцию репортерного гена, используя собственный транскрипционный аппарат клетки. Таким образом, разнообразие АД, доступных для использования в дрожжевых методах, может оказаться непригодным для использования в их бактериальных аналогах. AD, VP16 и дрожжевой Gal4 AD, полученные из вируса простого герпеса, с успехом использовались при дрожжевых инфекциях. [1] в то время как часть α-субъединицы РНК-полимеразы E. coli использовалась в методах, основанных на E. coli . [2] [3]
В то время как мощные активирующие домены могут обеспечить большую чувствительность к более слабым взаимодействиям, и наоборот, более слабый AD может обеспечить большую строгость.
Создание экспрессирующих плазмид
[ редактировать ]Для проведения двухгибридного анализа или одного из его производных методов в клетку-хозяина необходимо включить ряд сконструированных генетических последовательностей. Соображения и методы, используемые при построении и доставке этих последовательностей, различаются в зависимости от потребностей анализа и организма, выбранного в качестве экспериментального фона.
Существует две широкие категории гибридных библиотек: случайные библиотеки и библиотеки на основе кДНК. Библиотека кДНК состоит из кДНК, полученной посредством обратной транскрипции мРНК, собранной из клеток определенных типов клеток. Эту библиотеку можно лигировать в конструкцию, чтобы она была прикреплена к BD или AD, используемым в анализе. [1] Случайная библиотека использует участки ДНК случайной последовательности вместо этих участков кДНК. Существует ряд методов получения этих случайных последовательностей, включая кассетный мутагенез . [2] Независимо от источника библиотеки ДНК ее лигируют в подходящее место соответствующей плазмиды/фагемиды с использованием соответствующих эндонуклеаз рестрикции . [2]
E. coli Особенности
[ редактировать ]Поместив гибридные белки под контроль IPTG -индуцируемых lac -промоторов , они экспрессируются только на средах, дополненных IPTG. Кроме того, за счет включения различных генов устойчивости к антибиотикам в каждую генетическую конструкцию можно легко предотвратить рост нетрансформированных клеток посредством культивирования на средах, содержащих соответствующие антибиотики. Это особенно важно для методов встречной селекции, в которых отсутствие взаимодействия. для выживания клеток необходимо [2]
Репортерный ген может быть вставлен в геном E. coli , сначала вставив его в эписому , тип плазмиды, способной встраиваться в геном бактериальной клетки. [2] с количеством копий примерно одна на ячейку. [10]
Гибридные экспрессирующие фагмиды можно электропорировать в клетки E. coli XL-1 Blue, которые после амплификации и инфицирования фагом-хелпером VCS-M13 дадут запас библиотечного фага. Каждый из этих фагов будет содержать по одному одноцепочечному члену библиотеки фагмид. [2]
Восстановление информации о белках
[ редактировать ]После проведения отбора необходимо определить первичную структуру белков, обладающих соответствующими характеристиками. Это достигается путем извлечения последовательностей, кодирующих белок (в том виде, в котором они были первоначально вставлены), из клеток, демонстрирующих соответствующий фенотип.
кишечная палочка
[ редактировать ]Фагемиду, используемую для трансформации клеток E. coli , можно «спасти» из выбранных клеток путем инфицирования их фагом-хелпером VCS-M13. Полученные в результате фаговые частицы содержат одноцепочечные фагмиды и используются для заражения клеток XL-1 Blue. [2] Двухцепочечные фагмиды впоследствии собираются из этих клеток XL-1 Blue, по существу обращая процесс, используемый для производства исходного библиотечного фага. Наконец, последовательности ДНК определяются посредством дидезоксисеквенирования . [2]
Управление чувствительностью
[ редактировать ]Репрессор Escherichia coli, полученный из Tet-R, можно использовать вместе с обычным репортерным геном, и его можно контролировать с помощью тетрациклина или доксициклина (ингибиторы Tet-R). Таким образом, экспрессия Tet-R контролируется стандартной двухгибридной системой, но Tet-R, в свою очередь, контролирует (репрессирует) экспрессию ранее упомянутого репортера, такого как HIS3 , через его промотор Tet-R. Тетрациклин или его производные затем можно использовать для регулирования чувствительности системы, использующей Tet-R. [1]
Чувствительность также можно контролировать, варьируя зависимость клеток от их репортерных генов. Например, на это можно повлиять изменением концентрации гистидина в ростовой среде для his3 -зависимых клеток и изменением концентрации стрептомицина для aadA- зависимых клеток. [2] [3] Зависимость от гена селекции также можно контролировать путем применения ингибитора гена селекции в подходящей концентрации. 3-амино-1,2,4-триазол Например, (3-АТ) является конкурентным ингибитором продукта гена HIS3 и может использоваться для титрования минимального уровня экспрессии HIS3, необходимого для роста на среде с дефицитом гистидина. [2]
Чувствительность также можно модулировать путем изменения количества операторных последовательностей в репортерной ДНК.
Неслитые белки
[ редактировать ]Третий, неслитый белок может экспрессироваться совместно с двумя слитыми белками. В зависимости от исследования третий белок может модифицировать один из слитых белков или опосредовать или мешать их взаимодействию. [1]
Совместная экспрессия третьего белка может быть необходима для модификации или активации одного или обоих слитых белков. Например, S. cerevisiae не обладает эндогенной тирозинкиназой. Если в исследовании участвует белок, требующий фосфорилирования тирозина, киназа должна быть предоставлена в виде гена тирозинкиназы. [1]
Неслитый белок может опосредовать взаимодействие, связывая оба слитых белка одновременно, как в случае лиганд-зависимой димеризации рецептора. [1]
Для белка с взаимодействующим партнером его функциональную гомологию с другими белками можно оценить путем поставки третьего белка в неслитой форме, который затем может или не может конкурировать со слитым белком за своего партнера по связыванию. Связывание между третьим белком и другим слитым белком прервет образование комплекса активации экспрессии репортера и, таким образом, уменьшит экспрессию репортера, что приведет к характерному изменению фенотипа. [1]
Сплит-убиквитиновые дрожжи двугибридные
[ редактировать ]Одним из ограничений классических двухгибридных скринингов дрожжей является то, что они ограничены растворимыми белками. Поэтому их невозможно использовать для изучения белок-белковых взаимодействий между нерастворимыми интегральными мембранными белками . Система сплит-убиквитин обеспечивает метод преодоления этого ограничения. [11] В системе расщепленного убиквитина два изучаемых интегральных мембранных белка слиты с двумя разными фрагментами убиквитина : C-концевым фрагментом убиквитина («Cub», остатки 35–76) и N-концевым фрагментом убиквитина («Nub», остатки 1–34). Эти слитые белки называются приманкой и добычей соответственно. Помимо слияния с интегральным мембранным белком, фрагмент Cub также слит с фактором транскрипции (TF), который может быть отщеплен убиквитин-специфичными протеазами . При взаимодействии приманки и добычи фрагменты Nub и Cub собираются, восстанавливая расщепленный убиквитин. Восстановленная молекула расщепленного убиквитина распознается специфичными для убиквитина протеазами, которые отщепляют фактор транскрипции, позволяя ему индуцировать транскрипцию репортерных генов . [12]
Флуоресцентный двухгибридный анализ
[ редактировать ]Золгадр и его коллеги представили флуоресцентную двухгибридную систему, в которой используются два гибридных белка, слитые с различными флуоресцентными белками, а также LacI, lac-репрессором . Структура слитых белков выглядит следующим образом: FP2-LacI-приманка и FP1-жертва, где белки-приманка и жертва взаимодействуют и приводят флуоресцентные белки (FP1 = GFP , FP2 = mCherry ) в непосредственной близости к сайту связывания LacI. белок в геноме клетки-хозяина. [13] Систему также можно использовать для скрининга ингибиторов белок-белковых взаимодействий. [14]
Ферментативные двугибридные системы: KISS.
[ редактировать ]В то время как исходная система Y2H использовала восстановленный фактор транскрипции, другие системы создают ферментативную активность для обнаружения ИПП. Например, датчик субстрата киназы («KISS») представляет собой двухгибридный подход млекопитающих, разработанный для картирования внутриклеточных ИПП. Здесь белок-приманка сливается с киназной частью TYK2 , а добыча соединяется с gp130 фрагментом рецептора цитокина . Когда приманка и жертва взаимодействуют, TYK2 фосфорилирует сайты стыковки STAT3 на химере жертвы, что в конечном итоге приводит к активации репортерного гена . [15]
Одно-, трех- и одно-двухгибридные варианты.
[ редактировать ]Одногибридный
[ редактировать ]Одногибридный вариант этого метода предназначен для исследования взаимодействий белок-ДНК и использует один слитый белок, в котором AD связан непосредственно со связывающим доменом. Однако связывающий домен в этом случае не обязательно имеет фиксированную последовательность, как в двухгибридном белок-белковом анализе, а может состоять из библиотеки. Эту библиотеку можно выбрать по желаемой целевой последовательности, которая вставлена в промоторную область конструкции репортерного гена. Таким образом, в системе положительного отбора выбирается связывающий домен, который успешно связывает UAS и обеспечивает транскрипцию. [1]
Обратите внимание, что отбор ДНК-связывающих доменов не обязательно осуществляется с использованием одногибридной системы, но также может осуществляться с использованием двухгибридной системы, в которой связывающий домен варьируется, а белки-приманки и жертвы остаются постоянными. [2] [3]
Трехгибридный
[ редактировать ]
Взаимодействия РНК-белок были исследованы с помощью трехгибридной вариации двухгибридного метода. В этом случае гибридная молекула РНК служит для соединения двух доменов слияния белков, которые предназначены для взаимодействия не друг с другом, а с промежуточной молекулой РНК (через свои РНК-связывающие домены). [1] Методы с использованием неслитых белков, выполняющих аналогичную функцию, как описано выше в разделе «неслитые белки», также можно назвать трехгибридными методами.
Один-два-гибрид
[ редактировать ]Одновременное использование одно- и двухгибридных методов (то есть одновременное взаимодействие белок-белок и белок-ДНК) известно как одно-два-гибридный подход и, как ожидается, повысит строгость скрининга. [1]
Организм-хозяин
[ редактировать ]Хотя теоретически любая живая клетка может быть использована в качестве основы для двухгибридного анализа, существуют практические соображения, которые определяют выбор. Выбранная клеточная линия должна быть относительно дешевой, простой в культивировании и достаточно устойчивой, чтобы выдерживать применение исследовательских методов и реагентов. [1] Последнее особенно важно для проведения высокопроизводительных исследований . Поэтому дрожжи S. cerevisiae были основным организмом-хозяином в исследованиях двухгибридов. Однако это не всегда идеальная система для изучения взаимодействующих белков других организмов. [16] Дрожжевые клетки часто не имеют одинаковых посттрансляционных модификаций, используют другое использование кодонов или не имеют определенных белков, которые важны для правильной экспрессии белков. Чтобы справиться с этими проблемами, было разработано несколько новых двухгибридных систем. В зависимости от используемой системы для выращивания клеток и обеспечения отбора для взаимодействия используются чашки с агаром или конкретная питательная среда. Наиболее распространенным методом является посев на агар, при котором клетки помещают на селективную среду, чтобы увидеть, как происходит взаимодействие. Клетки, не имеющие белков взаимодействия, не должны выжить на этой селективной среде. [7] [17]
S. cerevisiae (дрожжи)
[ редактировать ]Дрожжи S. cerevisiae были модельным организмом, использованным во время создания двухгибридной технологии. Она широко известна как система Y2H. Он имеет несколько характеристик, которые делают его устойчивым организмом для взаимодействия, включая способность образовывать третичные белковые структуры, нейтральный внутренний pH, повышенную способность образовывать дисульфидные связи и глутатион в восстановленном состоянии среди других цитозольных буферных факторов, чтобы поддерживать гостеприимный внутренний среда. [1] Моделью дрожжей можно манипулировать с помощью немолекулярных методов, и известна полная последовательность ее генома. [1] Дрожжевые системы устойчивы к различным условиям культивирования и агрессивным химическим веществам, которые невозможно применять к культурам тканей млекопитающих. [1]
Специально для скрининга Y2H был создан ряд штаммов дрожжей, например Y187. [18] и АН109 , [19] оба произведены Clontech . Также использовались штаммы дрожжей R2HMet и BK100. [20]
Кандида альбиканс
[ редактировать ]C. albicans — дрожжи с особой особенностью: они переводят кодон CUG в серин, а не в лейцин. Из-за различного использования кодонов трудно использовать модельную систему S. cerevisiae в качестве Y2H для проверки белок-белковых взаимодействий с использованием генов C. albicans . Чтобы обеспечить более естественную среду, C. albicans была разработана двухгибридная система (C2H). С помощью этой системы белок-белковые взаимодействия можно изучать у самого C. albicans . [21] [22] Недавним дополнением стало создание системы с высокой пропускной способностью. [23] [24] [25]
кишечная палочка
[ редактировать ]Двухгибридные бактериальные методы (B2H или BTH) обычно проводятся на E. coli и имеют некоторые преимущества перед системами на основе дрожжей. Например, более высокая эффективность трансформации и более высокие темпы роста позволяют E. coli использовать более крупные библиотеки (более 10 библиотек). 8 ). [2] Отсутствие требований к включению сигнала ядерной локализации в последовательность белка и возможность изучения белков, которые были бы токсичны для дрожжей, также могут быть основными факторами, которые следует учитывать при выборе экспериментального фонового организма. [2]
Активность метилирования некоторых E. coli белков ДНК-метилтрансферазы может мешать выбору некоторых ДНК-связывающих белков. Если это предполагается, очевидным решением может стать использование штамма E. coli , дефектного по определенной метилтрансферазе. [2] B2H может быть не идеальным при изучении межбелковых взаимодействий эукариот (например, белков человека), поскольку белки могут не сворачиваться, как в эукариотических клетках, или могут отсутствовать другие процессы обработки.
Клетки млекопитающих
[ редактировать ]В последние годы была разработана двухгибридная система млекопитающих (M2H) для изучения белок-белковых взаимодействий млекопитающих в клеточной среде, которая близко имитирует нативную белковую среду. [26] В этой системе для обнаружения белок-белковых взаимодействий используются временно трансфицированные клетки млекопитающих. [27] [28] Использование линии клеток млекопитающих для изучения белок-белковых взаимодействий млекопитающих дает преимущество работы в более естественном контексте. [5] Посттрансляционные модификации, фосфорилирование, ацилирование и гликозилирование аналогичны. Внутриклеточная локализация белков также более правильна по сравнению с использованием дрожжевой двухгибридной системы. [29] [30] С помощью двухгибридной системы млекопитающих также возможно изучить входные сигналы. [31] Еще одним большим преимуществом является то, что результаты можно получить в течение 48 часов после трансфекции. [5]
Арабидопсис Талиана
[ редактировать ]В 2005 году была разработана двухгибридная система растений. С помощью протопластов A. thaliana можно изучать белок-белковые взаимодействия на растениях. Таким образом, взаимодействия можно изучать в их родном контексте. В этой системе GAL4 AD и BD находятся под контролем сильного промотора 35S. Взаимодействие измеряется с помощью репортера GUS. Чтобы обеспечить высокопроизводительный скрининг, векторы были совместимы со шлюзами. Эта система известна как двухгибридная система протопластов (P2H). [32]
Аплизия калифорнийская
[ редактировать ]Морской заяц Калифорнийский является модельным организмом в нейробиологии, изучающим, среди прочего, молекулярные механизмы долговременной памяти. Для изучения важных в неврологии взаимодействий в более естественной среде была разработана двугибридная система в нейронах Acalifornica . В этой системе используются GAL4 AD и BD. [33] [34]
Бомбикс мори
[ редактировать ]Двугибридная система насекомых (I2H) была разработана в линии клеток тутового шелкопряда из личинки или гусеницы одомашненного шелкопряда Bombyx mori (клетки BmN4). Эта система использует GAL4 BD и домен активации мышиного NF-κB P65. Оба находятся под контролем промотора OpIE2. [35]
Приложения
[ редактировать ]Определение последовательностей, имеющих решающее значение для взаимодействия
[ редактировать ]Изменяя определенные аминокислоты путем мутации соответствующих пар оснований ДНК в используемых плазмидах, можно определить важность этих аминокислотных остатков в поддержании взаимодействия. [1]
После использования метода на основе бактериальных клеток для отбора ДНК-связывающих белков необходимо проверить специфичность этих доменов, поскольку существует предел того, в какой степени геном бактериальной клетки может выступать в качестве стока для доменов, обладающих сродством к другим. последовательности (или, по сути, общее сродство к ДНК). [2]
Открытие наркотиков и ядов
[ редактировать ]Межбелковые сигнальные взаимодействия представляют собой подходящие терапевтические цели из-за их специфичности и распространенности. Подход к поиску случайных лекарств использует банки соединений, которые содержат случайные химические структуры, и требует высокопроизводительного метода для тестирования этих структур на их намеченной цели. [1] [17]
Клетка, выбранная для исследования, может быть специально сконструирована так, чтобы отражать молекулярный аспект, который исследователь намеревается изучить, а затем использоваться для идентификации новых терапевтических средств для людей или животных или средств против вредителей. [1] [17]
Определение функции белка
[ редактировать ]Определив партнеров по взаимодействию неизвестных белков, можно сделать выводы о возможных функциях этих новых белков. [1] Это можно сделать, используя один известный белок в сравнении с библиотекой неизвестных белков или, наоборот, путем выбора из библиотеки известных белков, используя один белок с неизвестной функцией. [1]
Выбор белка с цинковым пальцем
[ редактировать ]Для отбора белков цинковых пальцев (ZFP) для белковой инженерии с успехом использовались методы, адаптированные на основе метода двухгибридного скрининга. [2] [3] ZFP сам по себе является ДНК-связывающим белком, используемым при создании индивидуальных ДНК-связывающих доменов, которые связываются с желаемой последовательностью ДНК. [36]
Используя ген селекции с желаемой целевой последовательностью, включенной в UAS, и рандомизируя соответствующие аминокислотные последовательности для создания библиотеки ZFP, можно выбрать клетки, в которых происходит взаимодействие ДНК-ZFP с необходимыми характеристиками. Каждый ZFP обычно распознает только 3–4 пары оснований, поэтому, чтобы предотвратить распознавание сайтов за пределами UAS, рандомизированный ZFP преобразуется в «каркас», состоящий из еще двух ZFP с постоянной последовательностью. Таким образом, UAS спроектирован таким образом, чтобы включать целевую последовательность константного каркаса в дополнение к последовательности, для которой выбран ZFP. [2] [3]
С помощью этой системы можно также исследовать ряд других ДНК-связывающих доменов. [2]
Сильные стороны
[ редактировать ]- Двухгибридные экраны нетехнологичны; их можно провести в любой лаборатории без сложного оборудования.
- Двухгибридные экраны могут дать важную первую подсказку для идентификации партнеров по взаимодействию.
- Анализ является масштабируемым, что позволяет проверять взаимодействия между многими белками. Более того, его можно автоматизировать, а с помощью роботов многие белки можно проверить на предмет тысяч потенциально взаимодействующих белков за относительно короткое время. Используются два типа больших экранов: библиотечный подход и матричный подход.
- Данные о двухгибридных дрожжах могут быть такого же качества, что и данные, полученные с помощью альтернативного подхода коаффинной очистки с последующей масс-спектрометрией (AP/MS). [37] [9]
Слабые стороны
[ редактировать ]- Основной критикой дрожжевого двухгибридного скрининга белок-белковых взаимодействий является возможность большого количества ложноположительных (и ложноотрицательных) идентификаций. Точная частота ложноположительных результатов неизвестна, но более ранние оценки достигали 70%. Это также частично объясняет часто встречающееся очень небольшое совпадение результатов при использовании (высокопроизводительного) двухгибридного скрининга, особенно при использовании разных экспериментальных систем. [9] [28]
Причина такого высокого процента ошибок кроется в характеристиках экрана:
- Некоторые варианты анализа сверхэкспрессируют слитые белки, что может вызвать неестественные концентрации белка, приводящие к неспецифическим (ложноположительным) результатам.
- Гибридные белки представляют собой слитые белки; то есть слитые части могут ингибировать определенные взаимодействия, особенно если взаимодействие происходит на N-конце тестируемого белка (куда обычно прикрепляется ДНК-связывающий или активационный домен).
- Взаимодействие может не происходить у дрожжей, типичного организма-хозяина Y2H. Например, если бактериальный белок тестируется на дрожжах, у него может отсутствовать шаперон для правильного сворачивания, который присутствует только у его бактериального хозяина. Более того, белок млекопитающих иногда неправильно модифицируется у дрожжей (например, отсутствует фосфорилирование ), что также может привести к ложным результатам.
- Y2H происходит в ядре. Если тестируемые белки не локализованы в ядре (поскольку они имеют другие сигналы локализации), два взаимодействующих белка могут оказаться невзаимодействующими.
- Некоторые белки могут специфически взаимодействовать, когда они совместно экспрессируются в дрожжах, хотя на самом деле они никогда не присутствуют в одной и той же клетке одновременно. Однако в большинстве случаев нельзя исключать, что такие белки действительно экспрессируются в определенных клетках или при определенных обстоятельствах.
Каждый из этих пунктов сам по себе может привести к ложным результатам. Из-за совокупного воздействия всех источников ошибок двугибридные дрожжи следует интерпретировать с осторожностью. Вероятность получения ложноположительных результатов означает, что все взаимодействия должны быть подтверждены анализом с высокой достоверностью, например, коиммунопреципитацией эндогенных белков, что сложно для крупномасштабных данных межбелковых взаимодействий. В качестве альтернативы данные Y2H можно проверить с использованием нескольких вариантов Y2H. [38] или методы биоинформатики. Последний проверяет, экспрессируются ли взаимодействующие белки одновременно, имеют ли они некоторые общие черты (например, аннотации генной онтологии или определенные топологии сети ), имеют ли гомологичные взаимодействия у других видов. [39]
См. также
[ редактировать ]- Фаговый дисплей — альтернативный метод выявления белок-белковых и белок-ДНК-взаимодействий.
- Белковый массив — метод обнаружения белок-белковых взаимодействий на основе чипов.
- Анализ синтетического генетического массива - дрожжевой метод изучения взаимодействий генов.
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В Молодой К.Х. (февраль 1998 г.). «Двугибридные дрожжи: так много взаимодействий, (за) так мало времени» . Биология размножения . 58 (2): 302–11. дои : 10.1095/biolreprod58.2.302 . ПМИД 9475380 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В х Йонг Дж.К., Рамм Э.И., Пабо Кол.О. (июнь 2000 г.). «Бактериальная двухгибридная система селекции для изучения белок-ДНК и белок-белковых взаимодействий» . Труды Национальной академии наук Соединенных Штатов Америки . 97 (13): 7382–7. Бибкод : 2000PNAS...97.7382J . дои : 10.1073/pnas.110149297 . ПМК 16554 . ПМИД 10852947 .
- ^ Перейти обратно: а б с д и ж г час я Хёрт Дж.А., Тибодо С.А., Хирш А.С., Пабо К.О., Йонг Дж.К. (октябрь 2003 г.). «Высокоспецифичные белки с цинковыми пальцами, полученные путем направленной перетасовки доменов и клеточной селекции» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (21): 12271–6. Бибкод : 2003PNAS..10012271H . дои : 10.1073/pnas.2135381100 . ПМК 218748 . ПМИД 14527993 .
- ^ Филдс С., Сонг О (июль 1989 г.). «Новая генетическая система для обнаружения белок-белковых взаимодействий». Природа . 340 (6230): 245–6. Бибкод : 1989Natur.340..245F . дои : 10.1038/340245a0 . ПМИД 2547163 . S2CID 4320733 . Аннотация бесплатна; полнотекстовой статьи нет.
- ^ Перейти обратно: а б с Ло И, Баталао А, Чжоу Х, Чжу Л (февраль 1997 г.). «Двугибридная система млекопитающих: дополнительный подход к двухгибридной системе дрожжей» . БиоТехники . 22 (2): 350–2. дои : 10.2144/97222pf02 . ПМИД 9043710 .
- ^ Вершуре П.Дж., Виссер А.Е., Ротс М.Г. (2006). Выйдите из колеи: эпигенетические системы контроля генов и инженерные факторы транскрипции . Достижения генетики. Том. 56. стр. 163–204. дои : 10.1016/S0065-2660(06)56005-5 . ISBN 9780120176564 . ПМИД 16735158 . [ мертвая ссылка ]
- ^ Перейти обратно: а б Брюкнер А., Польге С., Ленце Н., Ауэрбах Д., Шлаттнер У. (июнь 2009 г.). «Двугибридные дрожжи — мощный инструмент системной биологии» . Международный журнал молекулярных наук . 10 (6): 2763–88. дои : 10.3390/ijms10062763 . ПМК 2705515 . ПМИД 19582228 .
- ^ Гитц Р.Д., Триггс-Рейн Б., Роббинс А., Грэм К.К., Вудс Р.А. (июль 1997 г.). «Идентификация белков, которые взаимодействуют с интересующим белком: применение дрожжевой двухгибридной системы». Молекулярная и клеточная биохимия . 172 (1–2): 67–79. дои : 10.1023/А:1006859319926 . ПМИД 9278233 . S2CID 32413316 .
- ^ Перейти обратно: а б с д Ауэрбах Д., Стагляр I (2005). «Дрожжевые двухгибридные сети белок-белкового взаимодействия». Протеомика и белок-белковые взаимодействия . Обзоры протеинов. Том. 3. С. 19–31. дои : 10.1007/0-387-24532-4_2 . ISBN 978-0-387-24531-7 . S2CID 82470771 .
- ^ Уиппл FW (август 1998 г.). «Генетический анализ прокариотических и эукариотических ДНК-связывающих белков Escherichia coli» . Исследования нуклеиновых кислот . 26 (16): 3700–6. дои : 10.1093/нар/26.16.3700 . ПМК 147751 . ПМИД 9685485 .
- ^ Стагляр И., Коростенский С., Джонссон Н., те Хисен С. (апрель 1998 г.). «Генетическая система на основе сплит-убиквитина для анализа взаимодействий между мембранными белками in vivo» . Труды Национальной академии наук Соединенных Штатов Америки . 95 (9): 5187–92. Бибкод : 1998PNAS...95.5187S . дои : 10.1073/pnas.95.9.5187 . ЧВК 20236 . ПМИД 9560251 .
- ^ Снайдер Дж., Киттанаком С., Курак Дж., Стагляр И. (февраль 2010 г.). «Двугибридная система дрожжей (МИФ) на основе мембранного убиквитина: мощный инструмент для выявления белок-белковых взаимодействий» . Журнал визуализированных экспериментов (36). дои : 10.3791/1698 . ПМК 2818708 . ПМИД 20125081 .
- ^ Золгадр К., Мортусевич О., Ротбауэр У., Кляйнханс Р., Гёлер Х., Ванкер Э.Э., Кардосо М.К., Леонхардт Х. (ноябрь 2008 г.). «Флуоресцентный двухгибридный анализ для прямой визуализации белковых взаимодействий в живых клетках» . Молекулярная и клеточная протеомика . 7 (11): 2279–87. дои : 10.1074/mcp.M700548-MCP200 . ПМИД 18622019 .
- ^ Юрлова Л., Деркс М., Бухфеллнер А., Хиксон И., Янссен М., Моррисон Д., Стэнсфилд И., Браун С.Дж., Гадесси Ф.Дж., Лейн Д.П., Ротбауэр Ю., Золгадр К., Крауш Э. (апрель 2014 г.). «Флуоресцентный двухгибридный анализ для скрининга ингибиторов белок-белкового взаимодействия в живых клетках: нацеливание на взаимодействие p53 с Mdm2 и Mdm4» . Журнал биомолекулярного скрининга . 19 (4): 516–25. дои : 10.1177/1087057113518067 . ПМИД 24476585 .
- ^ Ливенс С., Герло С., Лемменс И., Де Клерк Д.Д., Риссеу М.Д., Вандеррост Н., Де Смет А.С., Рюйсинк Е., Шевет Е., Ван Каленберг С., Тавернье Дж. (декабрь 2014 г.). «Сенсор киназного субстрата (KISS), датчик взаимодействия белков in situ млекопитающих» . Молекулярная и клеточная протеомика . 13 (12): 3332–42. дои : 10.1074/mcp.M114.041087 . ПМК 4256487 . ПМИД 25154561 .
- ^ Стайнен Б., Турню Х., Тавернье Дж., Ван Дейк П. (июнь 2012 г.). «Разнообразие генетических методов in vivo для изучения белок-белковых взаимодействий: от двугибридной системы дрожжей до системы сплит-люциферазы млекопитающих» . Обзоры микробиологии и молекулярной биологии . 76 (2): 331–82. дои : 10.1128/MMBR.05021-11 . ПМЦ 3372256 . ПМИД 22688816 .
- ^ Перейти обратно: а б с Хамди А., Колас П. (февраль 2012 г.). «Двугибридные дрожжевые методы и их применение в разработке лекарств» . Тенденции в фармакологических науках . 33 (2): 109–18. дои : 10.1016/j.tips.2011.10.008 . ПМИД 22130009 .
- ^ Фромон-Расин М., Рейн Дж.К., Легрен П. (июль 1997 г.). «На пути к функциональному анализу генома дрожжей посредством исчерпывающего двухгибридного скрининга». Природная генетика . 16 (3): 277–82. дои : 10.1038/ng0797-277 . ПМИД 9207794 . S2CID 32591856 .
- ^ Лу Л., Хорстманн Х., Нг К., Хонг В. (декабрь 2001 г.). «Регуляция структуры и функции аппарата Гольджи с помощью ARF-подобного белка 1 (Arl1)». Журнал клеточной науки . 114 (Часть 24): 4543–55. дои : 10.1242/jcs.114.24.4543 . ПМИД 11792819 .
- ^ Хадка С., Вангелофф А.Д., Чжан С., Сиддаватам П., Хитон Н.С., Ван Л., Сенгупта Р., Сахасрабуде С., Рэндалл Г., Грибсков М., Кун Р.Дж., Перера Р., LaCount DJ (декабрь 2011 г.). «Сеть физического взаимодействия вируса денге и белков человека» . Молекулярная и клеточная протеомика . 10 (12):М111.012187. дои : 10.1074/mcp.M111.012187 . ПМК 3237087 . ПМИД 21911577 .
- ^ Шотерс, Флорис; Ван Дейк, Патрик (7 августа 2019 г.). «Белко-белковые взаимодействия у Candida albicans» . Границы микробиологии . 10 :1792 дои : 10.3389/fmicb.2019.01792 . ПМК 6693483 . ПМИД 31440220 .
- ^ Стайнен Б., Ван Дейк П., Турню Х. (октябрь 2010 г.). «Кодон CUG адаптирован к двухгибридной системе патогенного гриба Candida albicans» . Исследования нуклеиновых кислот . 38 (19): e184. дои : 10.1093/нар/gkq725 . ПМЦ 2965261 . ПМИД 20719741 .
- ^ Шотерс, Флорис; Манро, Кэрол А.; д'Энфер, Кристоф; Ван Дейк, Патрик; Митчелл, Аарон П. (22 августа 2018 г.). «Высокопроизводительная двухгибридная система» . мСфера . 3 (4). дои : 10.1128/mSphere.00391-18 . ПМК 6106057 . ПМИД 30135223 .
- ^ Легран, Мелани; Башелье-Басси, Софи; Ли, Кеунсук К.; Чаудхари, Йогеш; Турню, Элен; Арбогаст, Лоуренс; Бойер, Элен; Шовель, Мюриэль; Кабрал, Витор; Мофрэ, Коринн; Нессейр, Одри; Масланка, Ирена; Пермаль, Эммануэль; Найтингейл, Тристан; Уокер, Луиза А; Зейдлер, Юте; Знайди, Садри; Шотерс, Флорис; Мажье, Шарлотта; Жюльен, Рено А; Ма, Лоуренс; Тичит, Магали; Бушье, Кристиана; Ван Дейк, Патрик; Манро, Кэрол А; д'Энфер, Кристоф (10 августа 2018 г.). «Создание геномных платформ для изучения патогенеза Candida albicans» (PDF) . Исследования нуклеиновых кислот . 46 (16): 8664. doi : 10.1093/nar/gky747 . ПМК 6144791 . ПМИД 30107554 .
- ^ Шотерс, Флорис; Ван Дейк, Патрик (2019). «Белко-белковые взаимодействия у Candida albicans» . Границы микробиологии . 10 :1792 дои : 10.3389/fmicb.2019.01792 . ISSN 1664-302X . ПМК 6693483 . ПМИД 31440220 .
- ^ Двухгибридная система CheckMateTM для млекопитающих promega.com
- ^ Фэн XH, Деринк Р. (2001). «Двугибридные анализы млекопитающих: анализ белок-белковых взаимодействий в трансформации сигнального пути фактора роста-β». Двухгибридные системы . Том. 177. С. 221–239. дои : 10.1385/1-59259-210-4:221 . ISBN 978-1-59259-210-4 . ПМИД 11530609 .
- ^ Перейти обратно: а б Дин CM, Салвински Ł, Ксенариос I, Айзенберг Д (май 2002 г.). «Белковые взаимодействия: два метода оценки надежности высокопроизводительных наблюдений» . Молекулярная и клеточная протеомика . 1 (5): 349–56. дои : 10.1074/mcp.M100037-MCP200 . ПМИД 12118076 .
- ^ Бакхольц Р.Г., Глисон М.А. (ноябрь 1991 г.). «Дрожжевые системы для коммерческого производства гетерологичных белков». Био/Технологии . 9 (11): 1067–72. дои : 10.1038/nbt1191-1067 . ПМИД 1367623 . S2CID 31597609 .
- ^ Фэган Р., Флинт К.Дж., Джонс Н. (сентябрь 1994 г.). «Фосфорилирование E2F-1 модулирует его взаимодействие с продуктом гена ретинобластомы и аденовирусным белком E4 19 кДа». Клетка . 78 (5): 799–811. дои : 10.1016/s0092-8674(94)90522-3 . ПМИД 8087847 . S2CID 22888513 .
- ^ Лю, Цзюнь О. (1998). «Все, что вам нужно знать о дрожжевой бигибридной системе». Структурная биология природы . 5 (7): 535–536. дои : 10.1038/788 . S2CID 37127696 .
- ^ Элерт А., Вельтмайер Ф., Ван Х., Майер К.С., Смикенс С., Висенте-Карбахоса Дж., Дрёге-Лазер В. (июнь 2006 г.). «Анализ двухгибридного белок-белкового взаимодействия в протопластах Arabidopsis: установление карты гетеродимеризации транскрипционных факторов bZIP группы C и группы S» . Заводской журнал . 46 (5): 890–900. дои : 10.1111/j.1365-313X.2006.02731.x . ПМИД 16709202 .
- ^ Чой Дж. Х., Ли Дж. А., Йим С.В., Лим К.С., Ли Ч., Ли Ю.Д., Барч Д., Кандел Э.Р., Каанг Б.К. (2003). «Использование двухгибридной системы аплизии для изучения взаимодействий между факторами транскрипции, участвующими в долгосрочном облегчении аплизии в нервной системе» . Обучение и память . 10 (1): 40–3. дои : 10.1101/lm.55303 . ЧВК 196654 . ПМИД 12551962 .
- ^ Ли Дж.А., Ли Ш., Ли С., Чанг DJ, Ли Й., Ким Х., Чеанг Й.Х., Ко Х.Г., Ли Й.С., Джун Х., Барч Д., Кандел Э.Р., Каанг Б.К. (сентябрь 2006 г.). «РКА-активируемый гетеродимер ApAF-ApC/EBP является ключевым нижестоящим эффектором ApCREB и необходим и достаточен для консолидации долгосрочного облегчения» . Журнал клеточной биологии . 174 (6): 827–38. дои : 10.1083/jcb.200512066 . ПМК 2064337 . ПМИД 16966424 .
- ^ Мон Х., Сугахара Р., Хонг С.М., Ли Дж.М., Камачи Ю., Кавагути Ю., Кусакабе Т. (сентябрь 2009 г.). «Анализ белковых взаимодействий с двугибридной системой в культивируемых клетках насекомых». Аналитическая биохимия . 392 (2): 180–2. дои : 10.1016/j.ab.2009.05.033 . ПМИД 19481053 .
- ^ Гомманс В.М., Хайсма Х.Дж., Ротс М.Г. (декабрь 2005 г.). «Разработка факторов транскрипции белка цинковых пальцев: терапевтическая значимость включения или выключения экспрессии эндогенных генов по команде» . Журнал молекулярной биологии . 354 (3): 507–19. дои : 10.1016/j.jmb.2005.06.082 . ПМИД 16253273 . [ постоянная мертвая ссылка ]
- ^ Ю Х, Браун П., Йилдирим М.А., Лемменс И., Венкатесан К., Сахали Дж., Хирозан-Кишикава Т., Гебреаб Ф., Ли Н., Симонис Н., Хао Т., Руал Дж.Ф., Дрико А., Васкес А., Мюррей Р.Р., Саймон С., Лат Л, Тэм С, Сврзикапа Н, Фан С, де Смет А.С., Мотиль А, Хадсон М.Э., Парк Дж, Синь Х, Кьюсик М.Э., Мур Т., Бун С., Снайдер М., Рот Ф.П., Барабаси А.Л., Тавернье Дж., Хилл Д.Э., Видал М. (октябрь 2008 г.). «Высококачественная карта взаимодействия бинарных белков сети интерактома дрожжей» . Наука 322 (5898): 104–10. Бибкод : 2008Sci...322..104Y . дои : 10.1126/science.1158684 . ПМЦ 2746753 . ПМИД 18719252 .
- ^ Чен Ю.К., Раджагопала С.В., Стеллбергер Т., Уетц П. (сентябрь 2010 г.). «Исчерпывающий бенчмаркинг дрожжевой двухгибридной системы» . Природные методы . 7 (9): 667–8, ответ автора 668. doi : 10.1038/nmeth0910-667 . ПМЦ 10332476 . ПМИД 20805792 . S2CID 35834541 .
- ^ Коегль М., Утц П. (декабрь 2007 г.). «Совершенствование дрожжевых двухгибридных скрининговых систем» . Брифинги по функциональной геномике и протеомике . 6 (4): 302–12. дои : 10.1093/bfgp/elm035 . ПМИД 18218650 .
Внешние ссылки
[ редактировать ]- Подробности о родственной двухгибридной системе
- Обзор двухгибридной системы дрожжей от Science Creative Quarterly
- Совместимые с шлюзом дрожжевые одногибридные сита
- Видеоанимация дрожжевой двугибридной системы
- Двухгибридная + система + методы в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Дрожжи двухгибридные
- База данных BioGrid с белок-белковыми взаимодействиями