Фосфид

В химии фосфид - это соединение, содержащее П 3− Ион или его эквивалент. Многие различные фосфиды известны, с широко разными структурами. [ 1 ] Чаще всего встречается на бинарных фосфидах, то есть те материалы, состоящие только из фосфора и менее электроотрицательного элемента. Многочисленные полифосфиды, которые представляют собой твердые тела, состоящие из анионных цепей или кластеров фосфора. Фосфиды известны с большинством менее электроотрицательных элементов, за исключением HG , PB , SB , BI , TE и PO . [ 2 ] Наконец, некоторые фосфиды являются молекулярными.
Бинарные фосфиды
[ редактировать ]Binary phosphides include phosphorus and one other element. An example of a group 1 phosphide is sodium phosphide (NA 3 P ). Другие примечательные примеры включают алюминиевый фосфид ( ALP ) и фосфид кальция ( CA 3 P 2 ), которые используются в качестве пестицидов, используя их тенденцию высвобождать токсический фосфин при гидролизе. Магний фосфид ( Mg 3 P 2 ) также чувствителен к влаге. Фосфид индия ( INP ) и фосфид галлия ( GAP ) используются в качестве полупроводников, часто в сочетании связанных арсенидов . [ 3 ] Медный фосфид ( Cu 3 P ) иллюстрирует редкую стехиометрию для фосфида. Эти виды нерастворимы во всех растворителях - они представляют собой трехмерные твердотельные полимеры. Для тех, у кого есть электропозитивные металлы, материалы гидролизуются:
- Ca3P2 + 6 H2O → 3 Ca(OH)2 + 2 PH3

Polyphosphides
[edit]

Polyphosphides contain P−P bonds. The simplest polyphosphides would be derivatives of P4−
2. The free anions are rarely encountered because they are so basic. Most members follow the octet rule.
Well studied polyphosphides are derivatives of P73-.[4]
The nomenclature for polyphosphides can be deceptive. As confirmed by X-ray crystallography tin triphosphide and germanium triphosphide are not triphosphides, but hexaphosphides. They consist of ruffled cyclo-P66- subunits.[5] Another example of deceptive nomenclature is "thorium pentaphosphide", which consists of a polymeric polyphosphide related to Hittorf's phosphorus.[6]
Several polyphosphides contain the cluster P3−
11 ions and polymeric chain anions (e.g. the helical (P−
)
n ion) and complex sheet or 3-D anions.[7] The range of structures is extensive. Potassium has nine phosphides: K3P, K4P3, K5P4, KP, K4P6, K3P7, K3P11, KP10.3, KP15. Eight mono- and polyphosphides of nickel also exist: (Ni3P, Ni5P2, Ni12P5, Ni2P, Ni5P4, NiP, NiP2, NiP3).[2]
Two polyphosphide ions, P4−
3 found in K
4P
3 and P5−
4 found in K5P4, are radical anions with an odd number of valence electrons.[2]
Preparation of phosphide and polyphosphide materials
[edit]There are many ways to prepare phosphide compounds. One common way involves heating a metal and red phosphorus (P) under inert atmospheric conditions or vacuum. In principle, all metal phosphides and polyphosphides can be synthesized from elemental phosphorus and the respective metal element in stoichiometric forms. However, the synthesis is complicated due to several problems. The exothermic reactions are often explosive due to local overheating. Oxidized metals, or even just an oxidized layer on the exterior of the metal, causes extreme and unacceptably high temperatures for beginning phosphorination.[8] Hydrothermal reactions to generate nickel phosphides have produced pure and well crystallized nickel phosphide compounds, Ni2P and Ni12P5. These compounds were synthesized through a solid-liquid reaction between NiCl2·12H2O and red phosphorus at 200 °C for 24 and 48 hours, respectively.[9]
Metal phosphides are also produced by reaction of tris(trimethylsilyl)phosphine with metal halides. In this method, the halide is liberated as the volatile trimethylsilyl chloride.
A method for the preparation of K2P16 from red phosphorus and potassium ethoxide has been reported.[10]
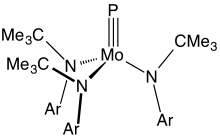
Molecular phosphides
[edit]Compounds with triple bonds between a metal and phosphorus are rare. The main examples have the formula Mo(P)(NR2)3, where R is a bulky organic substituent.[11]
Organic phosphides
[edit]Many organophosphides are known. Common examples have the formula R2PM where R is an organic substituent and M is a metal. One example is lithium diphenylphosphide. The Zintl cluster P3−
7 is obtained with diverse alkali metal derivatives.
Natural examples
[edit]The mineral schreibersite (Fe,Ni)3P is common in some meteorites.
References
[edit]- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Jump up to: a b c Von Schnering, H.G. and Hönle , W. (1994) "Phosphides - Solid-state Chemistry" in Encyclopedia of Inorganic Chemistry. R. Bruce King (ed.). John Wiley & Sons ISBN 0-471-93620-0
- ^ Blackman, C. S.; Carmalt, C. J.; O'Neill, S. A.; Parkin, I. P.; Molloy, K. C.; Apostolico, L. (2003). "Chemical vapour deposition of group Vb metal phosphide thin films" (PDF). Journal of Materials Chemistry. 13 (8): 1930. doi:10.1039/b304084b.
- ^ Meyer, Teodoro; Hönle, Wolfgang; von Schnering, Hans Georg (1987). "Zur Chemie und Strukturchemie von Phosphiden und Polyphosphiden. 44. Tricäsiumheptaphosphid Cs3P7: Darstellung, Struktur und Eigenschaften". Zeitschrift für Anorganische und Allgemeine Chemie. 552 (9): 69–80. doi:10.1002/zaac.19875520907.
- ^ Gullman, Jan; Olofsson, Olle (1 November 1972). "The crystal structure of SnP3 and a note on the crystal structure of GeP3". Journal of Solid State Chemistry. 5 (3): 441–445. doi:10.1016/0022-4596(72)90091-6. ISSN 0022-4596. Retrieved 28 March 2024.
- ^ Olofsson, Olle; Gullman, Jan; Søtofte, Inger; Beronius, P.; Engebretsen, Jan E.; Ehrenberg, L. (1971). "The Crystal Structure of TlP5". Acta Chemica Scandinavica. 25: 1327–1337. doi:10.3891/acta.chem.scand.25-1327.
- ^ Jeitschko, W.; Möller, M. H. (1987). "Phosphides and Polyphosphides of the Transition Metals". Phosphorus and Sulfur and the Related Elements. 30 (1–2): 413–416. doi:10.1080/03086648708080608.
- ^ фон Шеннинг, Ханс-Георг; Hönle, Wolfgang (1988). «Соединение пропасти с фосфидами». Химические обзоры . 88 : 243–273. doi : 10.1021/cr00083a012 .
- ^ Лю, Zongyi; Хуан, Сян; Чжу, Зибин; Dai, Jinhui (2010). «Простой легкий гидротермальный путь для синтеза никелевых фосфидных порошков». Ceramics International . 36 (3): 1155–1158. doi : 10.1016/j.ceramint.2009.12.015 .
- ^ Dragulescu-Andrasi, Alina; Миллер, Л. Зейн; Чен, Бангао; Маккуде, Д. Тайлер; Шатрук, Майкл (14 марта 2016 г.). «Свободное преобразование красного фосфора в растворимые полифосфидные анионы путем реакции с такисидом калия» . Angewandte Chemie International Edition . 55 (12): 3904–3908. doi : 10.1002/anie.201511186 . PMID 26928980 .
- ^ Cossairt, BM; Пиро, На; Cummins, CC (2010). «Передовая метал-опосредованная активация и трансформация белого фосфора». Химические обзоры . 110 (7): 4164–77. Citeseerx 10.1.1.666.8019 . doi : 10.1021/cr9003709 . PMID 20175534 .