Награда за стимуляцию мозга
Награда за стимуляцию мозга ( BSR ) — это приятный феномен, вызываемый прямой стимуляцией определенных областей мозга, первоначально открытый Джеймсом Олдсом и Питером Милнером . BSR может служить надежным оперантным подкреплением. Целенаправленная стимуляция активирует схему системы вознаграждения и формирует привычки реагирования, аналогичные тем, которые возникают при естественных вознаграждениях , таких как еда и секс. [1] Эксперименты с BSR вскоре показали, что стимуляция латерального гипоталамуса , а также других областей мозга, связанных с естественным вознаграждением, приносит как вознаграждение, так и стимулирование мотивации. [2] Электрическая стимуляция мозга и внутричерепные инъекции лекарств вызывают сильное ощущение вознаграждения благодаря относительно прямой активации схемы вознаграждения. Эта активация считается более прямой, чем вознаграждение, вызванное естественными стимулами, поскольку эти сигналы обычно проходят через более опосредованные периферические нервы. [3] BSR был обнаружен у всех протестированных позвоночных, включая людей, и предоставил полезный инструмент для понимания того, как естественные вознаграждения обрабатываются определенными областями и цепями мозга, а также нейротрансмиссия, связанная с системой вознаграждения. [4]
Внутричерепная самостимуляция ( ИКСС ) — это оперантный метод кондиционирования, используемый для создания BSR в экспериментальных условиях. В ICSS обычно участвуют субъекты с постоянными имплантатами электродов в одной из нескольких областей мозга, которые, как известно, производят BSR при стимуляции. Субъектов обучают постоянно реагировать на электрическую стимуляцию этой области мозга. [5] Исследования ICSS оказались особенно полезны для изучения влияния различных фармакологических манипуляций на чувствительность к вознаграждению. ICSS использовался как средство оценки склонности к зависимости от наркотиков многих классов, в том числе тех, которые действуют на моноаминергическую, опиоидную и холинергическую нейротрансмиссию. Эти данные хорошо коррелируют с результатами исследований по самостоятельному приему наркотиков, посвященных аддиктивным свойствам наркотиков. [6]
История
[ редактировать ]В 1953 году Джеймс Олдс и Питер Милнер из Университета Макгилла заметили, что крысы предпочитали возвращаться в ту часть испытательного устройства, где они получали прямую электрическую стимуляцию перегородочной области мозга. [7] Из этой демонстрации Олдс и Милнер сделали вывод, что стимуляция была полезной, и в ходе последующих экспериментов они подтвердили, что могут обучать крыс выполнять новые действия, такие как нажатие на рычаг, чтобы получать короткие серии импульсов стимуляции мозга. [7] Олдс и Милнер открыли механизмы вознаграждения в мозге, участвующие в положительном подкреплении, и их эксперименты привели к выводу, что электрическая стимуляция может служить оперантным подкреплением. [7] [8] По мнению Б. Ф. Скиннера , оперантное подкрепление происходит, когда за поведением следует предъявление стимула, и оно считается важным для обучения навыкам реагирования. [9] Их открытие позволило мотивацию и подкрепление с точки зрения лежащей в их основе физиологии и привело к дальнейшим экспериментам по определению нейронной основы вознаграждения и подкрепления. понять [8] С момента первоначального открытия феномен BSR был продемонстрирован у всех протестированных видов, и Роберт Гэлбрейт Хит аналогичным образом продемонстрировал, что BSR можно применять к людям. [10]
В одном часто цитируемом примере в 1972 году субъект Хита, известный как «Б-19», сообщал о «чувстве удовольствия, бодрости и тепла» и «протестовал каждый раз, когда у него отбирали прибор, умоляя самостимулировать хотя бы несколько больше раз». [11] Среди специалистов по этике ранние эксперименты по «прямой стимуляции мозга» или «психохирургии» подвергались критике как «сомнительные и ненадежные (даже) по вчерашним стандартам». [12] В случае, опубликованном в 1986 году, испытуемая, которой была предоставлена возможность самостимуляции дома, в конечном итоге игнорировала свою семью и личную гигиену и проводила целые дни на электрической самостимуляции. К тому времени, когда вмешалась ее семья, у субъектки на пальце появилась открытая язва из-за неоднократной регулировки тока. [13]
Усиление стимуляции мозга
[ редактировать ]Ранние исследования мотивационного воздействия стимуляции мозга касались двух основных вопросов:
1. Какие участки мозга можно стимулировать, чтобы вызвать ощущение вознаграждения? и
2. Какие препараты влияют на реакцию на стимуляцию и через какой механизм? [1]
Исследование схемы вознаграждения мозга показывает, что она состоит из распределенной мультисинаптической цепи, которая определяет как BSR, так и естественную функцию вознаграждения. [1] Естественные стимулы, которые мотивируют и формируют поведение, достигают схемы вознаграждения транссинаптически через периферические чувства зрения, звука, вкуса, обоняния или осязания. Однако экспериментально индуцированный BSR более непосредственно активирует схему вознаграждения и обходит трансдукцию через периферические сенсорные пути. [2] По этой причине электрическая стимуляция мозга предоставляет инструмент для идентификации схемы вознаграждения в центральной нервной системе с некоторой степенью анатомической и нейрохимической специфичности. [2] Исследования, включающие эти две формы лабораторного вознаграждения, показали, что стимуляция широкого спектра лимбических и диэнцефальных структур может быть полезной, а также вовлекает дофаминсодержащие нейроны мезолимбической дофаминовой системы в мотивационную функцию. [1] Мотивационный эффект внутричерепной самостимуляции существенно варьируется в зависимости от места размещения хирургически имплантированного электрода во время электростимуляции, и животные будут стимулировать различные нервные участки в зависимости от их текущего состояния. [14] Часто животные, которые работают над инициированием стимуляции мозга, также работают над прекращением стимуляции. [1]
Отношение к естественным вознаграждениям и побуждениям
[ редактировать ]Взаимосвязь между РБМ и естественными вознаграждениями (например, пищей, водой и совокуплением) уже давно обсуждается, и большая часть ранних исследований РБМ сосредоточена на их соответствующих сходствах и различиях. BSR обеспечивается посредством того же пути подкрепления, который активируется естественными вознаграждениями. Самостимуляция может вызвать надежную активацию центральных механизмов вознаграждения благодаря более прямому действию, чем естественные вознаграждения, которые первоначально активируют периферические нервы . [3] [2] BSR к медиальному пучку переднего мозга (MFB) электрическим или химическим путем активирует ключевые компоненты пути вознаграждения, также активируемого естественными вознаграждениями. Когда определенные области гипоталамуса подвергаются электрической стимуляции, это вызывает поведение, связанное с вознаграждением, такое как еда, питье или совокупление. [9]
Естественные награды связаны с состоянием лишения неудовлетворенных потребностей или желаний (например, голода). Эти состояния управляют инстинктивным, мотивированным поведением, например, потреблением пищи. Утверждалось, что это не относится к РБМ, поскольку он не отвечает внутренней потребности, основанной на выживании. BSR также не хватает устоявшегося нейронного представления в памяти, которое естественным образом облегчает изучение ожидаемого вознаграждения. Оба эти эффекта приводят к снижению частоты ответа на BSR в ранних исследованиях серии; однако эксперименты также показали, что угасшее поведение можно быстро восстановить с помощью прайминговой стимуляции, которая освежает краткосрочную ассоциацию, связанную с ожиданием вознаграждения. [8] Исследования BSR показывают, что усиление стимуляции мозга может активировать естественные пути, связанные с естественными побуждениями, а также стимулировать пути подкрепления, которые обычно активируются естественными вознаграждениями.
Сила привода
[ редактировать ]Крысы будут нажимать рычаг со скоростью несколько тысяч реакций в час в течение нескольких дней в обмен на прямую электрическую стимуляцию латерального гипоталамуса . [14] Многочисленные исследования показали, что крысы будут проявлять усиленное поведение, исключая все другие виды поведения. Эксперименты показали, что крысы отказываются от еды вплоть до голодания в обмен на стимуляцию мозга или внутривенное введение кокаина , когда и еда, и стимуляция предлагаются одновременно в течение ограниченного времени каждый день. [2] Крысы также будут пересекать электрифицированные сети, чтобы нажать на рычаг, и они готовы выдерживать более сильные удары ради получения электрической стимуляции, чем ради еды. [14]
насыщение
[ редактировать ]Эксперименты по насыщению на крысах показали, что BSR не вызывает насыщения. Олдс продемонстрировал, что отсутствие насыщения, связанное с BSR, позволяет животным самостимулироваться до полного истощения и что насыщение зависит от места электрической стимуляции. [14] В 48-часовом тесте на насыщение крысы с гипоталамическими электродами самостимулировались до истощения и не проявляли внутренней тенденции к насыщению, тогда как телэнцефальные электроды показали радикальное замедление самостимуляции через 4–8 часов. Ненасытность BSR тесно связана с силой влечения. В то время как естественная награда, такая как еда, вызывает чувство сытости (сытости), BSR не имеет сопоставимого коррелята. Это позволяет BSR действовать неопределенно долго или, в случае ICSS, до истощения.
Зависимость
[ редактировать ]Наркомания – это хроническое заболевание головного мозга, состоящее из компульсивного приема наркотиков и поиска, которое сохраняется, несмотря на пагубное воздействие на различные аспекты жизни, включая здоровье, отношения и работу. Лабораторные процедуры могут привести к формированию компульсивных привычек самостоятельного поиска и приема внутрь, которые квалифицируются как аддиктивное поведение. [1] грызуны и приматы, кроме человека, работают в компульсивном режиме, получая внутривенные инъекции стимуляторов, а когда доступ к лекарствам не ограничен, они начинают вводить лекарства самостоятельно, вплоть до серьезной потери веса и смерти. Было показано, что [2] [15] Подобно самоупотреблению, реакция на внутричерепную стимуляцию мозга имеет высококомпульсивный компонент, характерный для состояния зависимости. Предполагается, что BSR настолько эффективен в формировании компульсивных привычек благодаря более прямой активации пути вознаграждения, минуя передачу через сенсорные пути в ответ на естественные вознаграждения. Отсроченное подкрепление после реакции на BSR снижает степень подкрепления такого поведения и степень его продолжения. Например, задержка в одну секунду между нажатием рычага и вручением вознаграждения (стимуляцией) может снизить уровень реакции. [2] BSR предлагает понимание нейронных цепей, участвующих в подкреплении и компульсивном поведении.
Анатомия вознаграждения
[ редактировать ]Картирование и исследования повреждений BSR были разработаны для определения местоположения нейронов, связанных с вознаграждением, а также определения сигнальных путей, на которые напрямую влияет стимуляция мозга. Место внутричерепной самостимуляции приводит к существенно различным поведенческим характеристикам. Участки по длине медиального пучка переднего мозга (MFB) через латеральный и задний гипоталамус , вентральную область покрышки (VTA) и в мост связаны с наиболее сильными эффектами вознаграждения от стимуляции. [1]
Латеральный гипоталамус
[ редактировать ]является Латеральный гипоталамус частью гипоталамуса, и стимуляция этой области на уровне медиального пучка переднего мозга приводит к самой высокой скорости ответа и, следовательно, к самой высокой эффективности вознаграждения у грызунов. Поражения в этой области или вдоль ее границ вызывают потерю позитивного поведения, направленного на вознаграждение, а также всех других оперантных побуждений. [9]
Медиальный пучок переднего мозга
[ редактировать ]Медиальный пучок переднего мозга (MFB) является местом расположения наиболее часто исследуемых участков вознаграждения за стимуляцию мозга и состоит из сложного пучка аксонов, отходящих от базальных обонятельных областей и перегородочных ядер . [3] MFB не является единственным анатомическим субстратом, ответственным за усиление стимуляции мозга; однако это основной путь для восходящих дофаминовых волокон, и он выполняет функцию передачи информации от VTA к прилежащему ядру . Поощрительный эффект стимуляции MFB опосредован активацией мезокортиколимбической дофаминовой системы. [1]
Мезолимбический путь
[ редактировать ]Мезолимбический путь соединяет VTA с прилежащим ядром . Прилежащее ядро расположено в вентральном полосатом теле и объединяет информацию из корковых и лимбических структур мозга, опосредуя поведение, усиливающее вознаграждение. [16] Это основная мишень для дофаминергических проекций VTA, группы нейронов, расположенных близко к средней линии на дне среднего мозга . VTA является источником тел дофаминергических клеток, которые составляют мезокортиколимбическую дофаминовую систему. [3]
Было показано, что BSR приводит к высвобождению дофамина в прилежащем ядре, что также происходит в ответ на естественные вознаграждения, такие как еда или секс. [1]
Косвенная активация
[ редактировать ]Электрофизиологические данные показывают, что стимуляция MFB или VTA не активирует напрямую дофаминергические нейроны мезолимбического пути вознаграждения. Эти данные позволяют предположить, что BSR облегчается начальным возбуждением нисходящих миелинизированных нейронов, которые затем активируют восходящие немиелинизированные нейроны VTA. Считается, что в этой непрямой активации играют роль возбуждающие холинергические входы в ВТА, но нейроанатомические компоненты этой цепи еще полностью не охарактеризованы. [5] [6]
Процедуры внутричерепной самостимуляции (ICSS)
[ редактировать ]Начальное обучение
[ редактировать ]С момента первой демонстрации BSR Олдсом и Милнером эксперименты на грызунах фиксируют реакцию ICSS для количественной оценки мотивации к получению стимуляции. Субъекты подвергаются стереотаксической хирургии для постоянной имплантации монополярного или биполярного электрода в нужную область мозга. Во время эксперимента электроды подключают к стимулирующему аппарату.
Первая часть эксперимента ICSS включает в себя обучение испытуемых реагировать на стимуляцию с использованием схемы подкрепления с фиксированным соотношением 1 (FR-1) (1 ответ = 1 вознаграждение). В экспериментах на крысах испытуемых обучают нажимать на рычаг для стимуляции, а скорость нажатия рычага обычно является зависимой переменной . [1] В исследованиях ICSS с использованием мышей вместо рычага обычно используется колесо реагирования, поскольку мыши не всегда последовательно нажимают на рычаг. [5] Каждая четверть оборота колеса реакции записывается и вознаграждается стимуляцией. Поощрительный стимул в экспериментах BSR обычно представляет собой последовательность коротких импульсов, разделенных интервальными импульсами. [17] которым можно манипулировать экспериментально, используя независимые переменные амплитуды, частоты и длительности импульса стимуляции . [1]
Установление минимального эффективного тока
[ редактировать ]Амплитуда (ток) стимуляции определяет популяцию нейронов, активируемых имплантированным электродом. В некоторых подходах это корректируется для каждого субъекта из-за незначительной вариабельности расположения электродов и, следовательно, несколько различной популяции затронутых нейронов. [8] После тренировки FR1 обычно устанавливается минимальный пороговый ток, который обеспечивает достаточный уровень ответа ICSS (около 40 ответов в минуту). Это называется процедурой дискретного испытания силы тока. [18] [19] Каждое дискретное испытание состоит из необусловленной стимуляции определенной амплитуды, за которой следует короткий период, в течение которого животное может отреагировать на дополнительную стимуляцию. Эффективные токи для BSR вызывают реакцию, превышающую определенную частоту (например, в 3 из 4 исследований). Самый низкий ток, на который животное реагирует в достаточной степени, считается минимальным эффективным током. Это делается на постоянной частоте, обычно на верхнем конце частотного диапазона, используемого в исследованиях ICSS (140–160 Гц). [5] [6]
Внутрисубъектное исследование часто реализуется, чтобы помочь устранить вариабельность, вызванную размещением электродов. Дизайн исследования между субъектами требует тщательной гистологической проверки размещения электродов, чтобы обеспечить согласованность между экспериментальными группами. Субъектам с несовершенным размещением электродов требуется более высокая амплитуда моделирования, чтобы активировать схему вознаграждения и вызвать реакцию ICSS. Субъекты с идеальным анатомическим расположением будут реагировать на меньшую амплитуду стимуляции. Однако этот корректирующий процесс ограничен, поскольку увеличение популяции активированных нейронов может привести к нецелевой активации соседних цепей. Это часто завершается нежелательными двигательными побочными эффектами при стимуляции из-за прилегания MFB к внутренней капсуле — пучку аксонов, передающему нисходящую двигательную информацию к стволу мозга . Непреднамеренная стимуляция этих аксонов может привести к двигательной активности, такой как движение головы или подергивание лапы. [20] [5] [8]
Частотный отклик
[ редактировать ]При постоянном минимальном эффективном токе реакция ICSS регистрируется в серии испытаний, которые различаются по частоте стимуляции. Каждое испытание состоит из короткой начальной фазы необусловленной стимуляции, фазы ответа, когда ответы записываются и вознаграждаются стимуляцией, и короткой фазы тайм-аута, когда ответы не записываются и стимуляция не проводится. Это повторяется для серии из 10-15 различных возрастающих или нисходящих частот с шагом 0,05 логарифмических единиц в диапазоне от 20 до 200 Гц. [5]
Хотя амплитуда стимуляции влияет на то, какие нейроны стимулируются, частота стимуляции определяет частоту возбуждения в этой популяции нейронов. Как правило, увеличение частоты стимуляции увеличивает частоту стрельбы в целевой популяции. Это связано с более высокой скоростью ответа ICSS, в конечном итоге достигающей максимального уровня при максимальной скорости срабатывания, ограниченной рефрактерными свойствами нейронов.
Другие факторы
[ редактировать ]Независимые переменные серии стимуляции и длительности импульса также можно варьировать, чтобы определить, как каждая из них влияет на скорость ответа ICSS. Более длительная длительность поезда приводит к более энергичному реагированию до определенного момента, после чего скорость реагирования меняется обратно пропорционально длине поезда. Это происходит из-за нажатия рычага для дополнительной стимуляции до того, как ранее заработанный поезд закончился. [1]
Графиком подкрепления также можно манипулировать, чтобы определить, насколько животное мотивировано получать стимуляцию, что отражается в том, насколько усердно оно готово работать, чтобы ее заслужить. Это можно сделать, увеличив количество ответов, необходимых для получения вознаграждения (FR-2, FR-3, FR-4 и т. д.) или внедрив график прогрессивного коэффициента, при котором количество требуемых ответов постоянно увеличивается. Количество необходимых ответов увеличивается с каждым испытанием до тех пор, пока животное не перестанет набирать необходимое количество ответов. Это считается «точкой перелома» и является хорошим показателем мотивации, связанной с величиной вознаграждения. [6]
Анализ сдвига кривой
[ редактировать ]Интенсивность стимуляции, длительность импульса или частота импульсов могут варьироваться для определения функций реакции на дозу, реагирующих ICSS, с использованием анализа сдвига кривой. Этот подход в целом напоминает традиционную фармакологическую кривую «доза-реакция», где исследуется частота стимуляции, а не доза лекарства. [1] Этот метод позволяет провести количественный анализ лечения, модулирующего вознаграждение, на уровень ответа по сравнению с исходными условиями. Более низкие частоты стимуляции не позволяют поддерживать реакцию ICSS с вероятностью, превышающей случайность. Скорость ответа быстро увеличивается в динамическом диапазоне частот стимуляции по мере увеличения частоты, пока не будет достигнута максимальная скорость ответа. [1] [3] Изменения скорости реакции в этом диапазоне отражают изменения величины вознаграждения. [3] Функции частота-частота, частота-интенсивность или частота-длительность делают выводы о силе и эффективности стимуляции, а также объясняют, как лекарства изменяют полезное воздействие стимуляции. [1]
Анализ сдвига кривой часто используется в фармакологических исследованиях для сравнения исходных показателей ответа с показателями после введения лекарства. Максимальная скорость ответа в базовых условиях обычно используется для нормализации данных на кривой частоты до максимальной скорости управления (MCR). Более конкретно, количество ответов для любого данного испытания делится на наибольшее количество ответов, зарегистрированных в испытании с исходными условиями, которое затем умножается на 100. В экспериментальных условиях, если MCR падает ниже 100% при самых высоких частотах стимуляции. Считается, что это отражает влияние на способность или мотивацию реагировать, потенциально вызванную препаратом с седативными или аверсивными свойствами. Сдвиги MCR выше 100% указывают на улучшение способности или мотивации реагировать, потенциально вызванное препаратом с вознаграждающими или стимулирующими свойствами. [20]
Чувствительность нейронных цепей к полезным свойствам стимуляции оценивается путем анализа сдвигов влево или вправо в M50 или частоты, на которой было зарегистрировано 50% от максимального количества ответов. Достижение 50% MCR на более низкой частоте характерно для сдвига влево кривой частоты и повышения чувствительности схемы вознаграждения к стимуляции. Увеличение M50 указывает на то, что для достижения 50% MCR потребовалась более высокая частота стимуляции, а схема вознаграждения была десенсибилизирована в результате экспериментальных манипуляций. Другой способ анализа кривой частоты между контрольными и экспериментальными условиями — провести линейную регрессию по возрастающим точкам данных на графике необработанных данных (который не был нормализован по MCR). Точка, где y=0, или точка пересечения с x, называется пороговой частотой или тета-нулем (θ 0 ). Это частота, при которой частота ответов ICSS равна 0 (и любая частота выше этой теоретически вызовет реакцию ICSS). [5] [6]
Модуляция с помощью лекарств
[ редактировать ]Несколько основных классов лекарств были тщательно изучены в отношении поведения ICSS: моноаминергические препараты, опиоиды, холинергические препараты, ГАМКергические препараты, а также небольшое количество лекарств из других классов. [6] В этих исследованиях обычно сравнивают реакцию ICSS на исходном уровне и после введения препарата. Обычно для определения изменений M50 или θ 0 используется частотно-скоростной подход.
Наркотики с повышенной склонностью к привыканию обычно снижают порог стимуляции для реакции ICSS, тогда как препараты с аверсивными свойствами обычно повышают порог стимуляции для достижения реакции ICSS. Эти исследования дают представление о конкретных нейрохимических механизмах, участвующих в облегчении BSR, и о том, как восприятие вознаграждения можно модулировать путем фармакологического изменения активности определенных систем нейромедиаторов. Фармакологическое манипулирование этими системами может оказывать прямое или косвенное влияние на активность схемы вознаграждения. Понимание специфического воздействия лекарств на пороги реакции ICSS помогло выяснить, как различные нейромедиаторные системы влияют на схему вознаграждения, усиливая или подавляя чувствительность к стимуляции вознаграждения и влияя на мотивацию к выполнению поведения, связанного с вознаграждением.
BSR и наркотики, вызывающие зависимость, оказывают благоприятное воздействие посредством общих нейроанатомических и нейрохимических механизмов. Исследования с использованием поражений, фармакологического и анатомического картирования головного мозга показали, что многие наркотики, которыми злоупотребляют (например, амфетамин , кокаин , опиоиды , никотин и т. д.), активируют схему вознаграждения MFB, которая аналогичным образом активируется стимуляцией для достижения BSR. Нейрональные аксоны мезолимбической дофаминовой системы, ключевого компонента схемы вознаграждения, обычно имеют высокие пороги стимуляции. Однако эти пороги могут быть увеличены или уменьшены при приеме лекарств, что влияет на чувствительность к внутричерепной стимуляции и поведение ICSS.
Моноаминергические препараты
[ редактировать ]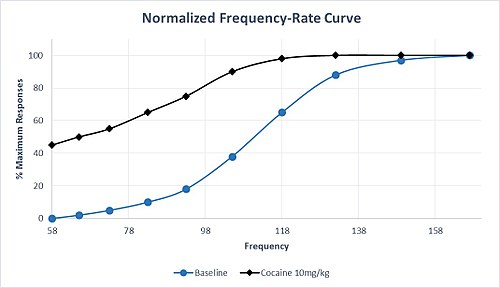
Эффекты препаратов, которые изменяют нейротрансмиссию дофамина, норадреналина и серотонина, широко изучались в отношении BSR. Нейрохимические исследования показали, что BSR приводит к высвобождению дофамина в прилежащем ядре. [21] Этот эффект обычно усиливается после приема препаратов, которые сами по себе увеличивают количество внеклеточного дофамина в прилежащем ядре, таких как кокаин , который ингибирует обратный захват дофамина во внутриклеточное пространство, блокируя его транспортер . И наоборот, эти уровни снижаются, а полезные свойства BSR блокируются после введения препаратов, которые противодействуют рецепторам дофамина или уменьшают количество внеклеточного дофамина, способствуя либо деградации, либо обратному захвату нейромедиатора. Хотя дофамин обычно считается основным нейромедиатором, участвующим в системе вознаграждения, он часто не единственный нейромедиатор, на который влияют вызывающие привыкание моноаминергические препараты. Важно отметить, что схема, задействованная в BSR, является мультисинаптической, а не исключительно дофаминергической. [5] [2] Это открывает возможность модуляции другими нейромедиаторными системами на разных этапах передачи сигнала вознаграждения.
Кроме того, препараты, влияющие на передачу моноаминов, различаются по своей селективности. Например, препараты с высокой селективностью в увеличении передачи дофамина и норадреналина по сравнению с передачей серотонина, как правило, вызывают сильное привыкание. Амфетамин и кокаин разделяют этот профиль селективности, и введение этих наркотиков обычно приводит к сдвигу влево M50 и θ 0, что указывает на сенсибилизацию схемы вознаграждения и высокий потенциал злоупотребления. Этот характерный сдвиг М50 влево в ответ на умеренную дозу кокаина проиллюстрирован набором гипотетических данных на рисунке 1. Обратите внимание, что максимальная скорость ответа достигается при более низкой частоте, чем в исходном состоянии, и существует значительный ответ. частота на самой низкой частоте, которая не привела к ответу в исходных условиях. Даже после хронического приема метамфетамина или кокаина толерантность к облегчению ICSS практически отсутствует. Однако после прекращения хронического лечения возникает вызванная отменой депрессия реакции ICSS, которую можно обратить вспять путем повторного введения препарата. [6]
Препараты с более сбалансированной селективностью в отношении передачи дофамина/норадреналина и серотонина, такие как 3,4-метилендиоксиметамфетамин ( МДМА ), как правило, вызывают меньшее привыкание и оказывают неоднозначное воздействие на реакцию ICSS в зависимости от дозы и частоты стимуляции. Однако селективные серотониновые препараты, как правило, приводят либо к отсутствию потенциирования ICSS, либо к депрессии реакции ICSS (сдвиг вправо кривой частоты), и эти препараты обычно считаются менее вызывающими привыкание. Одним из таких примеров является фенфлурамин, который ранее продавался как средство для подавления аппетита. [6] Антагонисты дофамина обычно приводят к угнетению реакции ICSS и сдвигу вправо кривой частоты. Это предполагает снижение BSR и, возможно, усиление аверсивных свойств стимуляции. После длительного лечения антагонистами дофамина наблюдается облегчение ICSS, вызванное отменой, эффект, противоположный тому, который наблюдается после длительного лечения стимуляторами. [22] [1]
Опиоиды
[ редактировать ]Лекарственные средства, действующие на опиоидную систему, обычно различаются по селективности в отношении мю (μ), дельта (δ) и каппа (κ) опиоидных рецепторов. Их вызывающие привыкание свойства во многом зависят от этой избирательности. Вообще говоря, высокоэффективные агонисты мю-опиоидных рецепторов (MOR) имеют высокий потенциал злоупотребления, тогда как агонисты каппа-опиоидных рецепторов (KOR) обычно вызывают дисфорическое состояние. Морфин, агонист MOR, был одним из первых изученных препаратов на момент появления ICSS и BSR. [23] Высокоэффективные агонисты MOR, такие как морфин, оказывают несколько различное влияние на реакцию ICSS, несмотря на высокий потенциал злоупотребления, что приводит как к потенцированию, так и к депрессии. Было обнаружено, что влияние этих препаратов на реакцию ICSS сильно зависит от дозы, времени предварительного лечения и предыдущего воздействия опиоидов. Различные исследования влияния MOR-селективных препаратов, включая морфин, героин, фентанил, метадон и гидрокодон, выявили неоднозначное влияние на реакцию ICSS. Было обнаружено, что низкие дозы этих препаратов вызывают слабое усиление ICSS, тогда как высокие дозы приводят к двухфазному профилю ICSS, состоящему из более высокого порога ICSS на более низких частотах с последующим усилением ICSS на более высоких частотах. При хроническом применении высокоэффективных агонистов MOR в низких дозах толерантность к облегчению ICSS отсутствует. [6] [24]
Антагонисты опиоидных рецепторов, такие как налоксон , могут обратить вспять влияние как агонистов опиоидных рецепторов на реакцию ICSS, так и потенцирующее действие психостимуляторов, таких как метамфетамин. Налоксон, который является конкурентным антагонистом всех подтипов опиоидных рецепторов, не влияет на реакцию ICSS при монотерапии. [25] Агонизм KOR, обычно связанный с дисфорическими состояниями, чаще всего приводит к депрессии реакции ICSS. Например, агонист KOR сальвинорин-А вызывает общее снижение скорости ответа ICSS при более низких частотах стимуляции. Повторное введение не вызывает толерантности к депрессии ICSS. [5] Влияние агонистов/антагонистов дельта-опиоидных рецепторов (ДОР) на ICSS менее ясно. Было обнаружено, что один агонист DOR, SNC80, вызывает депрессию ICSS, но есть противоположные данные, предполагающие, что некоторые дельта-агонисты могут обладать слабыми свойствами облегчения ICSS. [6]
Холинергические препараты
[ редактировать ]Холинергические препараты изучены менее тщательно, чем моноамины и опиоиды. Наиболее часто изучаемым холинергическим препаратом является никотин , вызывающее сильное привыкание психоактивное вещество, содержащееся в сигаретах. Никотин является агонистом никотиновых ацетилхолиновых рецепторов (nAchR), которые представляют собой лиганд-управляемые ионные каналы. Было обнаружено, что аддиктивные свойства никотина связаны с агонизмом, в частности, подтипа α4β2 . никотиновых рецепторов [26] Многие исследования подтвердили, что низкие дозы никотина приводят к облегчению ICSS, тогда как более высокие дозы приводят к депрессии ICSS. [27] [6] Хроническое лечение никотином не приводит к толерантности к облегчению ICSS в низких дозах, но приводит к толерантности к депрессивным эффектам высоких доз. Также наблюдается депрессия облегчения ICSS, вызванная отменой, при низких дозах, как и у агонистов MOR и стимуляторов моноаминов. Влияние лечения никотином на пороги ответа ICSS и максимальную частоту ответа не так значительно, как в случае многих вызывающих привыкание агонистов MOR и стимуляторов моноаминов. [28] [6]
ГАМКергические препараты
[ редактировать ]двумя основными рецепторами ГАМК являются ГАМК А и ГАМК В. ГАМКергическая передача является тормозной, и Лекарства, действующие на рецепторы ГАМК А , которые представляют собой лиганд-управляемые ионные каналы, изучаются более широко, поскольку они обычно оказывают более сильное воздействие на седативный эффект и тревогу , и их обычно назначают в терапевтических целях. Некоторые из этих препаратов вызывают привыкание, в том числе некоторые бензодиазепины и барбитураты . Низкие дозы этих препаратов обычно приводят к облегчению ICSS, тогда как более высокие дозы могут привести к угнетению ICSS и общему снижению максимальной частоты ответа. Последнее, вероятно, связано с нарушением способности реагировать из-за седативных и снотворных свойств этих препаратов. Этанол влияет на активность рецепторов ГАМК и, как было обнаружено, умеренно облегчает ICSS. [6] несмотря на более ранние публикации, предполагающие, что эти результаты противоречивы. [29]
Было обнаружено, что агонисты рецепторов ГАМК B и положительные аллостерические модуляторы приводят к депрессии ICSS и ингибируют усиливающие эффекты некоторых наркотиков, включая кокаин, метамфетамин и никотин, обращая вспять облегчение ICSS, которое обычно вызывают эти препараты. [30]
Клинические и доклинические данные
[ редактировать ]Механизмы BSR предлагают инструмент, который дает представление о том, как мозг управляет поведением посредством мотивации и подкрепления, особенно в отношении аддиктивного и компульсивного поведения. Исследования BSR, проводимые ICSS, оказались надежным показателем чувствительности к вознаграждению и потенциально могут помочь оценить склонность к злоупотреблению различными будущими терапевтическими средствами. [6] Кроме того, исследования ICSS могут быть использованы для оценки того, как на чувствительность к вознаграждению влияют генетические факторы, связанные с аддиктивными расстройствами. [31] [32] [33] Лекарства, которые, как установлено, предотвращают содействие ICSS, имеют потенциал для разработки и терапевтического применения для снижения риска аддиктивных расстройств в клинических условиях. [34] [18]
См. также
[ редактировать ]- Зависимость
- Аффективная нейробиология
- Глубокая стимуляция мозга
- Опытная машина
- Система вознаграждений
- Wirehead (научная фантастика)
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г час я дж к л м н тот п Мудрый РА (1996). «Наркотики, вызывающие привыкание, и награда за стимуляцию мозга». Ежегодный обзор неврологии . 19 : 319–40. дои : 10.1146/annurev.ne.19.030196.001535 . ПМИД 8833446 .
- ^ Jump up to: а б с д и ж г час Мудрый РА (октябрь 2002 г.). «Схема вознаграждения мозга: выводы из неощутимых стимулов» . Нейрон . 36 (2): 229–40. дои : 10.1016/s0896-6273(02)00965-0 . ПМИД 12383779 .
- ^ Jump up to: а б с д и ж Мудрый Р.А., Ромпре П.П. (1989). «Мозговой дофамин и вознаграждение». Ежегодный обзор психологии . 40 : 191–225. дои : 10.1146/annurev.ps.40.020189.001203 . ПМИД 2648975 .
- ^ Rolls ET (январь 1974 г.). «Нейронная основа вознаграждения за стимуляцию мозга». Прогресс нейробиологии . 3 (2): 71–118. дои : 10.1016/0301-0082(74)90005-7 .
- ^ Jump up to: а б с д и ж г час я Карлесон В.А., Чартофф Э.Х. (2007). «Внутричерепная самостимуляция (ИКСС) у грызунов для изучения нейробиологии мотивации». Протоколы природы . 2 (11): 2987–95. дои : 10.1038/nprot.2007.441 . ПМИД 18007634 . S2CID 13085385 .
- ^ Jump up to: а б с д и ж г час я дж к л м н Негус СС, Миллер Л.Л. (июль 2014 г.). «Внутричерепная самостимуляция для оценки возможности злоупотребления наркотиками» . Фармакологические обзоры . 66 (3): 869–917. дои : 10.1124/пр.112.007419 . ПМК 4081730 . ПМИД 24973197 .
- ^ Jump up to: а б с Олдс Дж., Милнер П. (1954). «Положительное подкрепление, вызываемое электрической стимуляцией области перегородки и других областей мозга крысы». Журнал сравнительной и физиологической психологии . 47 (6): 419–27. дои : 10.1037/h0058775 . ПМИД 13233369 .
- ^ Jump up to: а б с д и Милнер ПМ (1991). «Награда за стимуляцию мозга: обзор». Канадский журнал психологии . 45 (1): 1–36. дои : 10.1037/h0084275 . ПМИД 2044020 .
- ^ Jump up to: а б с Олдс Дж (1975). «Награждайте и стимулируйте нейроны». Награда за стимуляцию мозга . 1 :1–30.
- ^ Хит Р.Г. (декабрь 1963 г.). «Электрическая самостимуляция мозга человека». Американский журнал психиатрии . 120 (6): 571–7. дои : 10.1176/ajp.120.6.571 . PMID 14086435 .
- ^ Берридж, КК (2003). «Удовольствия мозга». Мозг и познание . 52 (1): 106–128. дои : 10.1016/S0278-2626(03)00014-9 . ПМИД 12812810 . S2CID 6640313 .
- ^ «Новая эра нейромодуляции» . Журнал этики АМА . 17 (1): 74–81. 1 января 2015 г. doi : 10.1001/virtualmentor.2015.17.1.oped2-1501 .
- ^ Фрэнк, Одинокий (21 марта 2018 г.). «Может ли электрическая стимуляция мозга сделать вас слишком счастливыми?» . Атлантика . Проверено 19 февраля 2020 г.
- ^ Jump up to: а б с д Олдс Дж (1958). «Самостимуляция мозга; ее использование для изучения местных последствий голода, секса и наркотиков». Наука . 127 (3294): 315–24. дои : 10.1126/science.127.3294.315 . ПМИД 13506579 . S2CID 6411230 .
- ^ Бозарт М.А., Мудрый Р.А. (1985). «Токсичность, связанная с длительным внутривенным введением героина и кокаина крысам». ДЖАМА . 254 (1): 81–3. дои : 10.1001/jama.1985.03360010087032 . ПМИД 4039767 .
- ^ Кокаровцева Л., Яцив-Зуракивски Т., Мендисабаль Арбокко Р., Францева М.В., Перес Веласкес Х.Л. (2009). «Механизмы возбудимости и щелевых соединений в прилежащем ядре регулируют вознаграждение за самостимуляцию у крыс». Нейронаука . 159 (4): 1257–63. doi : 10.1016/j.neuroscience.2009.01.065 . ПМИД 19409225 . S2CID 12059974 .
- ^ Зонненшайн Б., Коновер К., Шизгал П. (2003). «Рост вознаграждения за стимуляцию мозга в зависимости от продолжительности и силы стимуляции». Поведенческая нейронаука . 117 (5): 978–94. дои : 10.1037/0735-7044.117.5.978 . ПМИД 14570548 .
- ^ Jump up to: а б Филлипс Т.Дж., Рид С. (ноябрь 2014 г.). «Нацеливание на рецепторы GABAB для открытия лекарств против злоупотребления». Мнение экспертов об открытии лекарств . 9 (11): 1307–17. дои : 10.1517/17460441.2014.956076 . ПМИД 25195620 . S2CID 2310286 .
- ^ Маркус Р., Корнецкий С. (март 1974 г.). «Пороги отрицательного и положительного внутричерепного подкрепления [так в оригинале]: Эффекты морфия». Психофармакология . 38 (1): 1–13. дои : 10.1007/BF00421282 . S2CID 45059299 .
- ^ Jump up to: а б Либман Дж. М. (1983). «Различие между вознаграждением и производительностью: критический обзор методологии внутричерепной самостимуляции». Неврологические и биоповеденческие обзоры . 7 (1): 45–72. дои : 10.1016/0149-7634(83)90007-6 . ПМИД 6132357 . S2CID 26513856 .
- ^ Phillips AG, Blaha CD, Fibiger HC (1989). «Нейрохимические корреляты вознаграждения за стимуляцию мозга, измеренные с помощью анализа ex vivo и in vivo». Неврологические и биоповеденческие обзоры . 13 (2–3): 99–104. дои : 10.1016/S0149-7634(89)80017-X . ПМИД 2530478 . S2CID 11772466 .
- ^ Барр А.М., Марку А., Филлипс А.Г. (2002). «Ускоренный курс отмены психостимуляторов как модель депрессии». Тенденции в фармакологических науках . 23 (10): 475–82. дои : 10.1016/S0165-6147(02)02086-2 . ПМИД 12368072 .
- ^ Олдс Дж., Трэвис Р.П. (апрель 1960 г.). «Влияние хлорпромазина, мепробамата, пентобарбитала и морфина на самостимуляцию». Журнал фармакологии и экспериментальной терапии . 128 : 397–404. ПМИД 14428622 .
- ^ Эспозито Р.У., Корнецкий С (июнь 1978 г.). «Опиоиды и полезная стимуляция мозга». Неврологические и биоповеденческие обзоры . 2 (2): 115–122. дои : 10.1016/0149-7634(78)90052-0 . S2CID 54232959 .
- ^ Шефер Г.Дж. (1988). «Антагонисты опиатов и полезная стимуляция мозга». Неврологические и биоповеденческие обзоры . 12 (1): 1–17. дои : 10.1016/s0149-7634(88)80068-x . ПМИД 3287237 . S2CID 1075158 .
- ^ Мелрой-Грейф В.Е., Ститцель Дж.А., Эрингер М.А. (январь 2016 г.). «Никотиновые рецепторы ацетилхолина: активация, возрастные эффекты и связь с употреблением наркотиков» . Гены, мозг и поведение . 15 (1): 89–107. дои : 10.1111/gbb.12251 . ПМК 4780670 . ПМИД 26351737 .
- ^ Итасака М., Хиронака Н., Мията Х. (июнь 2015 г.). «[Поведенческие характеристики поиска никотина: роль никотин-обусловленных эффектов и других механизмов]». Нихон Арукору Якубуцу Игаккай Засши = Японский журнал исследований алкоголя и наркозависимости . 50 (3): 135–43. ПМИД 26502572 .
- ^ Баузо Р.М., Брейнзель А.В. (2012). «Животные модели отмены никотина: внутричерепная самостимуляция и соматические признаки отмены». Психические расстройства . Методы молекулярной биологии. Том. 829. стр. 257–68. дои : 10.1007/978-1-61779-458-2_16 . ISBN 978-1-61779-457-5 . ПМИД 22231819 .
- ^ Корнецкий С., Бейн Г.Т., Унтервальд Э.М., Льюис М.Дж. (октябрь 1988 г.). «Награда за стимуляцию мозга: эффекты этанола». Алкоголизм: клинические и экспериментальные исследования . 12 (5): 609–16. дои : 10.1111/j.1530-0277.1988.tb00250.x . ПМИД 2852475 .
- ^ Влаху С., Марку А (2010). «ГАМАБ-рецепторы в процессах вознаграждения». Фармакология ГАМК-рецепторов – дань уважения Норману Бауэри . Достижения фармакологии. Том. 58. стр. 315–71. дои : 10.1016/S1054-3589(10)58013-X . ISBN 9780123786470 . ПМИД 20655488 .
- ^ Ю С., Макклеллан Дж. (июль 2016 г.). «Генетика расстройств, связанных с употреблением психоактивных веществ». Детские и подростковые психиатрические клиники Северной Америки . 25 (3): 377–85. дои : 10.1016/j.chc.2016.02.002 . ПМИД 27338962 .
- ^ Ян Дж, Ли, доктор медицинских наук (август 2016 г.). «Сходящиеся результаты анализа связей и ассоциаций генов восприимчивости к курению и другим зависимостям» . Молекулярная психиатрия . 21 (8): 992–1008. дои : 10.1038/mp.2016.67 . ПМЦ 4956568 . ПМИД 27166759 .
- ^ Чой Х.Д., Шин В.Г. (апрель 2016 г.). «Метаанализ связи между полиморфизмом транспортера серотонина 5-HTTLPR и отказом от курения». Психиатрическая генетика . 26 (2): 87–91. дои : 10.1097/YPG.0000000000000116 . ПМИД 26886943 . S2CID 23494040 .
- ^ Чиамулера С., Падовани Л., Корси М. (август 2017 г.). «Открытие лекарств для лечения расстройств, вызванных употреблением психоактивных веществ: новые цели, перепрофилирование и необходимость в новых парадигмах». Современное мнение в фармакологии . 35 : 120–124. дои : 10.1016/j.coph.2017.08.009 . ПМИД 28874314 . S2CID 3413116 .
Внешние ссылки
[ редактировать ]- Стимуляция мозга: могут ли вам помочь магнитные или электрические импульсы? : Воздействие на неправильно работающие схемы мозга с помощью таких методов лечения, как ЭСТ, DBS и ТМС.
- Глубокая стимуляция мозга : нейрохирургические методы лечения с использованием глубокой стимуляции мозга
- Наркотики и мозг : Наркотики, мозг, поведение - наука о зависимости