1-аминоциклопропан-1-карбоксилат-синтаза
| 1-аминоциклопропан-1-карбоксилат-синтаза | |||
|---|---|---|---|
 Структура ACC Synthase | |||
| Идентификаторы | |||
| ЕС №. | 4.4.1.14 | ||
| CAS №. | 72506-68-4 | ||
| Базы данных | |||
| Intenz | Intenz View | ||
| Бренда | Бренда вход | ||
| Расширение | Вид Nicezyme | ||
| Кегг | Кегг вход | ||
| Метатический | Метаболический путь | ||
| Напрямую | профиль | ||
| PDB Структуры | RCSB PDB PDBE PDBSUM | ||
| Джин Онтология | Друг / Quickgo | ||
| |||
The enzyme aminocyclopropane-1-carboxylic acid synthase (ACC synthase, ACS) (EC 4.4.1.14) catalyzes the synthesis of 1-Aminocyclopropane-1-carboxylic acid (ACC), a precursor for ethylene , from S-Adenosyl methionine (AdoMet, SAM), промежуточный в цикле Ян и активированный метилцикл и полезная молекула для переноса метила:
- S -Аденозил- л -метионин = 1-аминоциклопропан-1-карбоксилат + S -метил-5 ' -Тиоаденозин
Как и другие, зависимые от PLP ферменты, он катализирует реакцию через промежуточное звено хиноноидов и использует кофактор -пиридоксальфосфат (PLP, активная форма витамина B6) для стабилизации. [ 1 ] [ 2 ] [ 3 ]
Этот фермент принадлежит к семейству лияз , в частности, углерод-сальфурские лиазы. Систематическим названием этого класса ферментов является S -аденозил- L -метионин S -метил-5 ' -тиоаденозин-линиза (1-аминоциклопропан-1-карбоксилат-образец) . Other names in common use include 1-aminocyclopropanecarboxylate synthase , 1-aminocyclopropane-1-carboxylic acid synthase , 1-aminocyclopropane-1-carboxylate synthetase , aminocyclopropanecarboxylic acid synthase , aminocyclopropanecarboxylate synthase , ACC synthase , and S -adenosyl- L -methionine methylthioadenosine- Лайаз . Этот фермент участвует в метаболизме пропаноата . В нем используется один кофактор , пиридоксальный фосфат .
Ферментный механизм
[ редактировать ]




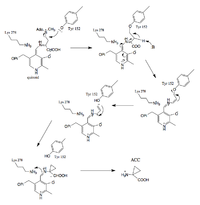
Реакция, катализируемая 1-аминоциклопропан-1-карбоксиловой кислотой синтазой (ACS), представляет собой преданную и скорость стадии биосинтеза ограничивающую этилена [20], газообразного растительного гормона, который отвечает за инициацию созревания плодов, побега и корня Рост и дифференциация, листья и фруктовые , открытие цветов и старение цветов и листьев . (Источник) Это пиридоксальный фосфат (PLP), зависящий от гамма-элиминации (?). В удалении гамма PLP действует как раковина дважды (поглощение электронов из двух депротонаций). [ 4 ] [ 5 ]
Предложенные шаги механизма реакции:
- Формирование базы Schiff ACS-PLP
- Обмен имине
- Образование хиноноидного промежуточного соединения
- Тирозин и PLP стабилизировали 3C-кольцо
- Формирование базы Schiff ACS-PLP
Альдегид Coenzyme PLP реагирует на образование связи имина ( основание SCHIFF каталитического домена ) с остатками лизина (278) AC.
- Обмен имине
Происходит обмен имине, и амин азот субстрата, S-аденозилметионин, заменяет Lys (278) в связи имине. (Стабилизируется H -соединением).
- Образование хиноноидного промежуточного соединения
PLP действует как «электронная раковина», поглощающая делокализованная электронная плотность во время промежуточных продуктов реакции (противодействие избыточной электронной плотности на аглетном углероде). PLP облегчает активность фермента, увеличивая кислотность альфа -углерода за счет стабилизации сопряженного основания. Сформированный PLP-стабилизированный Carbanion Spreadiate является хиноноидным промежуточным.
- Тирозин и PLP стабилизировали 3C-кольцо
PLP и тирозин стабилизируют отрицательные заряды во время депротонирования. Тирозин атакует углерод, связанный с серой, позволяя S (Ch 3 ) (ADO) уйти, а во время образования кольца листья тирозина.
Регулирование
[ редактировать ]ACC Synthase достигает оптимальной активности в условиях pH 8,5 и с KM = 20 мкм по сравнению с его субстратом, Sam.
ACC -синтаза и биосинтез этилена регулируются целым множеством стимулов. Стрессы, такие как ранение, ядовитые химические вещества, ауксин, наводнения и индола-3-уксусная кислота (IAA), способствуют синтезу этилена, создавая положительный цикл обратной связи с ACC-синтазой, что повышает ее активность.
Тем не менее, это также ингибируется рядом соединений. S-аденозилэтионин может связываться в качестве субстрата для ACC-синтазы (с более высокой аффинностью, чем SAM) и, следовательно, ингибирует любую реакцию с SAM. ACC Synthase также конкурентно ингибируется аминоэтоксивинилглицином (AVG) и аминооксиксусной кислотой (AOA), ингибиторами для многих пиридоксальных фосфат-опосредованных ферментативных реакций. Это естественные токсины, которые вызывают медленное ингибирование связывания, мешая коферментному пиридоксальному фосфату. Активность синтаза ACC также ингибируется промежуточными соединениями активированного метилцикала и пути рециклирования метионина: 5' - метилтиоаденозин, α-кето-γ-метилтиобутирическая кислота и S-аденозилгомоцистеин. [ 8 ] [ 9 ] [ 10 ]
Структура
[ редактировать ]ACC Synthase представляет собой 450-516 аминокислотная длинная последовательность в зависимости от видов растений, из которого она извлечена. Хотя он сопоставим у видов, в которых он находится, его терминальный домен COOH более варьируется, что приводит к таким различиям, как олигомеризация . Терминальный домен COOH отвечает за олигомеризацию. В большинстве ACC -синтаза, продуцирующих ячейки, ACC -синтаза существует как димер. Однако в некоторых мы находим мономер («который является более активным и эффективным [чем его димерный аналог»). [ 11 ]
Структура ACS была в значительной степени определена с помощью рентгеновской кристаллографии. [ 12 ] Сохранение остатков в каталитическом домене ACS и гомологии последовательности предполагает, что ACS катализирует синтез ACC аналогичным образом, как и другие ферменты, которые требуют PLP в качестве кофактора. Однако, в отличие от многих других PLP-зависимых ферментов, LYS (278) не единственный остаток, который взаимодействует с субстратом. Близость электроотрицательного кислорода от Tyr (152) к связке C-γ-S предполагает решающую роль в образовании ACC. [ 13 ] Рентгеновская кристаллография с аминетоксивинилглицином (AVG) конкурентный ингибитор подтвердил роль тирозина в элиминации γ. [ 14 ]
В конце 2007 года 6 структур для этого класса ферментов было решено в ПДБ , с кодами вступления 1B8G , 1AX , 1IAY , 1M4N , 1M7Y и 1YNU .

Каталитический домен
[ редактировать ]Основными функциональными группами в каталитических доменах являются азот из остатка LYS 278 и кислород из остатка тирозина 152.
Биологическая функция и применение
[ редактировать ]ACC Synthase является ключевой, ограничивающей скоростью эталона синтеза этилена. Поскольку активация ACC-синтаза-это то, что вызывает созревание плодов и часто портит, проводится больше исследований по регуляторным механизмам и биосинтетическим путям этилена, чтобы избежать порчи. [ 15 ] [ 16 ]
Примечания
[ редактировать ]- ^ Zhang Z, Ren JS, Clifton IJ, Schofield CJ (октябрь 2004 г.). «Кристаллическая структура и механистические последствия 1-аминоциклопропан-1-карбоновой оксидазы кислоты-этилен-образующего фермента» . Химический Биол . 11 (10): 1383–94. doi : 10.1016/j.chembiol.2004.08.012 . PMID 15489165 .
- ^ Capitani G, Hohenester E, Feng L, Storici P, Kirsch JF, Jansonius JN (декабрь 1999 г.). «Структура 1-аминоциклопропанового-1-карбоксилат-синтазы, ключевой фермент в биосинтезе этилена гормона растений». J. Mol. Биол . 294 (3): 745–56. doi : 10.1006/jmbi.1999.3255 . PMID 10610793 .
- ^ Huai Q, Xia Y, Chen Y, Callahan B, Li N, Ke H (октябрь 2001 г.). «Кристаллические структуры 1-аминоциклопропан-1-карбоксилат-синтазы в комплексе с аминоэтоксивинилглицином и пиридоксаль-5'-фосфатом обеспечивают новое понимание каталитических механизмов» . Дж. Биол. Химический 276 (41): 38210–6. doi : 10.1074/jbc.m103840200 . PMID 11431475 .
- ^ Li JF, QU LH, Li N (август 2005 г.). «Tyr152 играет центральную роль в катализе 1-аминоциклопропан-1-карбоксилатсинтазы» . J. Exp. Бот . 56 (418): 2203–10. doi : 10.1093/jxb/eri220 . PMID 15983009 .
- ^ Capitani G, McCarthy DL, Gut H, Grütter MG, Kirsch JF (декабрь 2002 г.). «Apple 1-аминоциклопропан-1-карбоксилат-синтаза в комплексе с ингибитором L-аминотоксивинилглицином. Доказательства кетиминового промежуточного соединения» . Дж. Биол. Химический 277 (51): 49735–42. doi : 10.1074/jbc.m208427200 . PMID 12228256 . S2CID 1019316 .
- ^ Huai Q, Xia Y, Chen Y, Callahan B, Li N, Ke H (октябрь 2001 г.). «Кристаллические структуры 1-аминоциклопропан-1-карбоксилат-синтазы в комплексе с аминоэтоксивинилглицином и пиридоксаль-5'-фосфатом обеспечивают новое понимание каталитических механизмов» . Дж. Биол. Химический 276 (41): 38210–6. doi : 10.1074/jbc.m103840200 . PMID 11431475 .
- ^ Ван К.Л., Ли Х, Экер -младший (2002). «Биосинтез этилена и сигнальные сети» . Растительная ячейка . 14 Suppl (Suppl): S131–51. doi : 10.1105/tpc.001768 . PMC 151252 . PMID 12045274 .
- ^ Yip WK, Moore T, Yang SF (март 1992 г.). «Дифференциальное накопление транскриптов для четырех томата 1-аминоциклопропанового-1-карбоксилат-синтазы в различных условиях» . Прокурор Нат. Академический Наука США . 89 (6): 2475–9. Bibcode : 1992pnas ... 89.2475y . doi : 10.1073/pnas.89.6.2475 . PMC 48681 . PMID 1549612 .
- ^ Acaster MA, Kende H (май 1983 г.). «Свойства и частичная очистка 1-аминоциклопропан-1-карбоксилат-синтазы» . Plant Physiol . 72 (1): 139–45. doi : 10.1104/pp.72.1.139 . PMC 1066183 . PMID 16662947 .
- ^ Льюис Д.Р., Неги С., Сукумар П., Мудай Г.К. (август 2011 г.). «Этилен ингибирует развитие латерального корня, увеличивает транспорт IAA и экспрессию выписки PIN3 и PIN7 Auxin Heflux» . Разработка . 138 (16): 3485–95. doi : 10.1242/dev.065102 . PMID 21771812 . S2CID 7211767 .
- ^ Kathiresan A, Nagarathna KC, Moloney MM, Reid DM, Chinnappa CC (январь 1998 г.). «Дифференциальная регуляция 1-аминоциклопропанового 1-карбоксилат-синтазы семейства генов и его роль в фенотипической пластичности в старинных продольных». Растение мол. Биол . 36 (2): 265–74. doi : 10.1023/a: 1005994118535 . PMID 9484438 . S2CID 9161137 .
- ^ Yip WK, Moore T, Yang SF (март 1992 г.). «Дифференциальное накопление транскриптов для четырех томата 1-аминоциклопропанового-1-карбоксилат-синтазы в различных условиях» . Прокурор Нат. Академический Наука США . 89 (6): 2475–9. Bibcode : 1992pnas ... 89.2475y . doi : 10.1073/pnas.89.6.2475 . PMC 48681 . PMID 1549612 .
- ^ Yip WK, Moore T, Yang SF (март 1992 г.). «Дифференциальное накопление транскриптов для четырех томата 1-аминоциклопропанового-1-карбоксилат-синтазы в различных условиях» . Прокурор Нат. Академический Наука США . 89 (6): 2475–9. Bibcode : 1992pnas ... 89.2475y . doi : 10.1073/pnas.89.6.2475 . PMC 48681 . PMID 1549612 .
- ^ Yip WK, Moore T, Yang SF (март 1992 г.). «Дифференциальное накопление транскриптов для четырех томата 1-аминоциклопропанового-1-карбоксилат-синтазы в различных условиях» . Прокурор Нат. Академический Наука США . 89 (6): 2475–9. Bibcode : 1992pnas ... 89.2475y . doi : 10.1073/pnas.89.6.2475 . PMC 48681 . PMID 1549612 .
- ^ Acaster MA, Kende H (май 1983 г.). «Свойства и частичная очистка 1-аминоциклопропан-1-карбоксилат-синтазы» . Plant Physiol . 72 (1): 139–45. doi : 10.1104/pp.72.1.139 . PMC 1066183 . PMID 16662947 .
- ^ Nakatsuka A, Murachi S, Okunishi H, et al. (Декабрь 1998). «Дифференциальная экспрессия и регуляция внутренней обратной связи 1-аминоциклопропан-1-карбоксилатсинтазы, 1-аминоциклопропан-1-карбоксилат оксидаза и гены рецепторов этилена в плодах томата во время развития и созревания» . Plant Physiol . 118 (4): 1295–305. doi : 10.1104/pp.118.4.1295 . PMC 34745 . PMID 9847103 .
Ссылки
[ редактировать ]- Лин, ECC; Кистлер, WS; Zwaig, N. (июнь 1970 г.). «Глицеринолкиназа, кардиостимулятор для распределения глицерина в Escherichia coli» . Журнал бактериологии . 102 (3): 753–759. doi : 10.1128/jb.102.3.753-759.1970 . PMC 247623 . PMID 4914079 .
- Накацука, Акира; Мурачи, Шихо; Окуниши, Хиронори; Шиоми, Синджиро; Накано, Рёхей; Кубо, Ясутака; Инаба, Акицугу (1998). «Дифференциальная экспрессия и регуляция внутренней обратной связи 1-аминоциклопропан-1-карбоксилатсинтазы, 1-аминоциклопропан-1-карбоксилат оксидаза и гены рецепторов этилена в плодах томата во время развития и созревания» . Физиология растений . 118 (4): 1295–1305. doi : 10.1104/pp.118.4.1295 . PMC 34745 . PMID 9847103 .
- Ван, Х.; Mei, W.; Qin, Y.; Чжу, Ю. (2011). «1-аминоциклопропан-1-карбоновая кислота синтаза 2 фосфорилируется кальциевой кальциевой протеинкиназой 1 во время удлинения хлопкового волокна» . Acta Biochimica et Biophysica Sinica . 43 (8): 654–661. doi : 10.1093/abbs/gmr056 . PMID 21742672 .
- Ван, Лонг-Чи; HSU, Джен-Ханг; Лин, Ли-Чунг (2010-10-22). «Идентификация новых ингибиторов 1-аминоциклопропан-1-карбоновой синтазы кислоты с помощью химического скрининга у Arabidopsis thaliana» . Журнал биологической химии . 285 (43): 33445–33456. doi : 10.1074/jbc.m110.132498 . PMC 2963424 . PMID 20682786 .
- «Биосинтез этилена и сигнальные сети» . Архивировано с оригинала 2012-03-07.
- Гвидо Капитани; Маркус ЦшОПП; Эндрю С. Элиот; Джек Ф. Кирш; Маркус Г. Грюттер. «Структура ACC-синтазы, инактивированная ингибитором на основе механизма L-винилглицина» (PDF) . www.bioc.uzh.ch. Получено 2012-03-15 .
- "jxb.oxfordjournals.org" (pdf) . Архивировано из оригинала (PDF) 2018-10-30.
- Ли, Цзянь-Фенг; Qu, Liang-Hu; Ли, Нин (2005). " Журнал экспериментальной ботаники 56 (418): два 10.1093/jxb/eri220: 15983009PMID
- Кога Ю., Кацуми Р., ты диджей, Мацумура Х., Такано К., Каная С (май 2008 г.). «Кристаллическая структура высоко термостабильной глицеринол киназы из гипертермофильного археона в димерной форме» . Февраль J. 275 (10): 2632–43. doi : 10.1111/j.1742-4658.2008.06410.x . PMID 18422647 . S2CID 205878773 .
- Nakatsuka A, Murachi S, Okunishi H, et al. (Декабрь 1998). «Дифференциальная экспрессия и регуляция внутренней обратной связи 1-аминоциклопропан-1-карбоксилатсинтазы, 1-аминоциклопропан-1-карбоксилат оксидаза и гены рецепторов этилена в плодах томата во время развития и созревания» . Plant Physiol . 118 (4): 1295–305. doi : 10.1104/pp.118.4.1295 . PMC 34745 . PMID 9847103 .
- Ван Х, Мэй В., Цинь Й, Чжу Й (август 2011 г.). «1-аминоциклопропан-1-карбоновая кислота синтаза 2 фосфорилируется кальциевой кальциевой протеинкиназой 1 во время удлинения хлопкового волокна» . Acta Biochim. Биофиз. Грех (Шанхай) . 43 (8): 654–61. doi : 10.1093/abbs/gmr056 . PMID 21742672 .
- Capitani G, Tschopp M, Eliot AC, Kirsch JF, Grütter MG (апрель 2005 г.). «Структура ACC-синтазы, инактивированная ингибитором на основе механизма L-винилглицина» . Фебс Летт . 579 (11): 2458–62. doi : 10.1016/j.febslet.2005.03.048 . PMID 15848188 . S2CID 24574380 .
- Li JF, QU LH, Li N (август 2005 г.). «Tyr152 играет центральную роль в катализе 1-аминоциклопропан-1-карбоксилатсинтазы» . J. Exp. Бот . 56 (418): 2203–10. doi : 10.1093/jxb/eri220 . PMID 15983009 .
- Capitani G, McCarthy DL, Gut H, Grütter MG, Kirsch JF (декабрь 2002 г.). «Apple 1-аминоциклопропан-1-карбоксилат-синтаза в комплексе с ингибитором L-аминотоксивинилглицином. Доказательства кетиминового промежуточного соединения» . Дж. Биол. Химический 277 (51): 49735–42. doi : 10.1074/jbc.m208427200 . PMID 12228256 . S2CID 1019316 .
- Huai Q, Xia Y, Chen Y, Callahan B, Li N, Ke H (октябрь 2001 г.). «Кристаллические структуры 1-аминоциклопропан-1-карбоксилат-синтазы в комплексе с аминоэтоксивинилглицином и пиридоксаль-5'-фосфатом обеспечивают новое понимание каталитических механизмов» . Дж. Биол. Химический 276 (41): 38210–6. doi : 10.1074/jbc.m103840200 . PMID 11431475 .
- Barry CS, Llop-Tous Mi, Grierson D (июль 2000 г.). «Регуляция экспрессии гена гена 1-аминоциклопропан-1-карбоксиловой кислоты при переходе от синтеза этилена-2 в систему-2 в томате» . Plant Physiol . 123 (3): 979–86. doi : 10.1104/pp.123.3.979 . PMC 59060 . PMID 10889246 .
- Zhang Z, Ren JS, Clifton IJ, Schofield CJ (октябрь 2004 г.). «Кристаллическая структура и механистические последствия 1-аминоциклопропан-1-карбоновой оксидазы кислоты-этилен-образующего фермента» . Химический Биол . 11 (10): 1383–94. doi : 10.1016/j.chembiol.2004.08.012 . PMID 15489165 .
- Capitani G, Hohenester E, Feng L, Storici P, Kirsch JF, Jansonius JN (декабрь 1999 г.). «Структура 1-аминоциклопропанового-1-карбоксилат-синтазы, ключевой фермент в биосинтезе этилена гормона растений». J. Mol. Биол . 294 (3): 745–56. doi : 10.1006/jmbi.1999.3255 . PMID 10610793 .
- Голландия Р.Р. (август 1975 г.). «Таблицы решений. Их использование для представления клинических алгоритмов». Джама . 233 (5): 455–7. doi : 10.1001/Jama.1975.03260050061028 . PMID 1080212 .
- Kathiresan A, Nagarathna KC, Moloney MM, Reid DM, Chinnappa CC (январь 1998 г.). «Дифференциальная регуляция 1-аминоциклопропанового 1-карбоксилат-синтазы семейства генов и его роль в фенотипической пластичности в старинных продольных». Растение мол. Биол . 36 (2): 265–74. doi : 10.1023/a: 1005994118535 . PMID 9484438 . S2CID 9161137 .
- Yip WK, Moore T, Yang SF (март 1992 г.). «Дифференциальное накопление транскриптов для четырех томата 1-аминоциклопропанового-1-карбоксилат-синтазы в различных условиях» . Прокурор Нат. Академический Наука США . 89 (6): 2475–9. Bibcode : 1992pnas ... 89.2475y . doi : 10.1073/pnas.89.6.2475 . PMC 48681 . PMID 1549612 .
- Acaster MA, Kende H (май 1983 г.). «Свойства и частичная очистка 1-аминоциклопропан-1-карбоксилат-синтазы» . Plant Physiol . 72 (1): 139–45. doi : 10.1104/pp.72.1.139 . PMC 1066183 . PMID 16662947 .
- Льюис Д.Р., Неги С., Сукумар П., Мудай Г.К. (август 2011 г.). «Этилен ингибирует развитие латерального корня, увеличивает транспорт IAA и экспрессию выписки PIN3 и PIN7 Auxin Heflux» . Разработка . 138 (16): 3485–95. doi : 10.1242/dev.065102 . PMID 21771812 . S2CID 7211767 .
- Clausen T, Huber R, Messerschmidt A, Pohlenz HD, Laber B (октябрь 1997 г.). «Медленное связывающее ингибирование цистатиониновой бета-линизы эскерехии-цистатиона с помощью L-аминоэтоксивинилглицина: кинетическое и рентгеновское исследование». Биохимия . 36 (41): 12633–43. doi : 10.1021/bi970630m . PMID 9376370 .
- Ван К.Л., Ли Х, Экер -младший (2002). «Биосинтез этилена и сигнальные сети» . Растительная ячейка . 14 Suppl (Suppl): S131–51. doi : 10.1105/tpc.001768 . PMC 151252 . PMID 12045274 .
- Boller T, Herner RC, Kende H (1979). «Анализ и ферментативное образование предшественника этилена, 1-аминоциклопропан-1-карбоновая кислота». Планта 145 (3): 293–303. Bibcode : 1979plant.145..293b . doi : 10.1007/bf004544455 . PMID 24317737 . S2CID 27464828 .
- Yu YB, Adams Do, Yang SF (1979). «1-аминоциклопропанекарбоксилатсинтаза, ключевой фермент в биосинтезе этилена». Архи Биохимия. Биофиз . 198 (1): 280–6. doi : 10.1016/0003-9861 (79) 90420-x . PMID 507845 .