3-диметиламиноакролеин
В этой статье может потребоваться редактирование непереведенных немецких химических названий и излишне запутанное написание, в котором можно было бы использовать более простые слова/предложения . ( Август 2024 г. ) |

| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
(2 E )-3-(Диметиламино)проп-2-еналь | |
| Другие имена
3-диметиламинопропеналь
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.011.962 |
| Номер ЕС |
|
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
| Характеристики | |
| С 5 Н 9 Н О | |
| Молярная масса | 99.133 g·mol −1 |
| Появление | Прозрачный, слегка желтый [ 1 ] до темно-коричневой жидкости [ 2 ] |
| Плотность | 0,99 г· см −3 и 25°С [ 1 ] |
| Точка кипения | *91 °C при 0,1 кПа [ 1 ] |
| Растворимый [ 3 ] | |
| Растворимость в метаноле , [ 4 ] 1,2-дихлорэтан [ 5 ] | Растворимый |
| Опасности | |
| СГС Маркировка : | |

| |
| Опасность | |
| H314 | |
| P260 , P264 , P280 , P301+P330+P331 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P321 , P363 , P405 , P501 | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
3-Диметиламиноакролеин представляет собой органическое соединение формулы Me 2 NC(H)=CHCHO. Это бледно-желтая водорастворимая жидкость. Соединение обладает рядом полезных и необычных свойств, например, оно «вызывает отмену снотворного на мышах эффекта морфина » и оказывает «стимулирующее действие на людей». [ 3 ]
Это стабильное химическое вещество, в отличие от исходного соединения 3-аминоакролеина , [ 6 ] и может использоваться в качестве сравнительно нетоксичного предшественника генотоксичного, мутагенного и потенциально канцерогенного малонового диальдегида . [ 7 ] Это соединение можно рассматривать как винилологичный диметилформамид (ДМФ), оно сочетает в себе функциональные возможности ненасыщенного альдегида и енамина. Поэтому 3-диметиламиноакролеин и производные от него винилологи (состоящие из винилологических амидинов) или соли винилиния (замещенные 1,5-диазапентадиены) [ 8 ] могут быть использованы в качестве реакционноспособных молекулярных строительных блоков для образования азотсодержащих гетероциклов, таких как пиридины, пиримидины, пирролы или пиразолы. [ 9 ]
Подготовка
[ редактировать ]Диметиламиноакролеин получают присоединением диметиламина к тройной связи пропиналя 3 - (пропаргилальдегида) посредством винилирования по Реппе . [ 3 ]
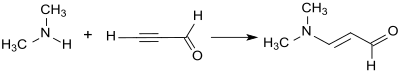
Однако пропинал является неподходящим исходным материалом для промышленного синтеза из-за его склонности к взрыву. [ 10 ] Виниловые эфиры (например, этилвиниловый эфир) подходят больше. [ 11 ] Они реагируют с фосгеном и диметилформамидом (который образует in-situ реагент Вильсмайера) с выходом 68% с образованием хлорида 3-этоксипропенилидендиметиламмония, иминиевой соли енолового эфира. В слабощелочной среде из него образуется 3-диметиламиноакролеин, который ) отщепляет диметиламин с образованием пропандиала при воздействии сильных оснований (например, гидроксида натрия .

Альтернативным путем изобутилвиниловый эфир реагирует с хлоридом иминия, полученным из ДМФ и фосгена . Преобразование может быть реализовано в виде непрерывного процесса. [ 4 ] Иминиевая соль дает 3-диметиламиноакролеин в разбавленном растворе гидроксида натрия с выходом 86%. [ 12 ]

Вместо фосгена соль иминия также можно получить с помощью хлорангидрида неорганической кислоты, такого как трихлорид фосфорила , или хлорангидрида органической кислоты, такого как оксалилхлорид .
Использовать
[ редактировать ]Реакции с 3-диметиламиноакролеином
[ редактировать ]3-Диметиламиноакролеин может быть использован для введения ненасыщенных и реакционноспособных групп С 3 в СН-кислотные и нуклеофильные соединения.
Активированная альдегидная группа 3-диметиламиноакролеина количественно реагирует с диалкилсульфатами, такими как диметилсульфат. Продукты реакционноспособны, но нестабильны. [ 13 ] разлагаются при 110 ° C обратно на исходные материалы. Продукты можно легко превратить с помощью нуклеофилов, таких как алкоксиды или амины, в соответствующие винилологические амид-ацетали или амидины. [ 14 ]

Стабильный диметилацеталь 3-диметиламиноакролеина получают реакцией с метоксидом натрия с выходом 62%. 3-Диметиламиноакролеин может взаимодействовать с CH-кислотными соединениями (такими как малононитрил) с образованием производных 1,3-бутадиена или с циклопентадиеном с образованием аминофульвена.
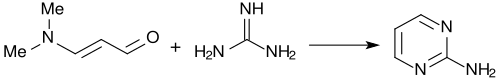
С гуанидином 3-диметиламиноакролеин почти количественно образует 2-аминопиримидин. [ 4 ]
Амидин, образующийся с 2-нафтиламином и аддуктом диметилсульфата, можно циклизовать метоксидом натрия с образованием бензо[f]хинолина (1-азафенантрена). [ 15 ]
![Синтез бензо[f]хинолина с 3-диметиламиноакролеином](http://upload.wikimedia.org/wikipedia/commons/thumb/6/68/Synthese_von_1-Azaphenanthren.svg/400px-Synthese_von_1-Azaphenanthren.svg.png)
N -метилпиррол образует 3-(2- N -метилпиррол)пропеналь с 3-диметиламиноакролеином и POCl 3 с выходом 49%. [ 16 ]

Подобным же образом протекает получение промежуточного продукта для , снижающего уровень холестерина препарата , флувастатина посредством реакции фторарилзамещенного N -изопропилиндола с 3-диметиламиноакролеином и POCl 3 . [ 17 ] [ 18 ]

Иногда для синтеза непосредственно используют иминиевую соль реакции реагента Вильсмайера и винилового эфира (предшественник 3-диметиламинопропеналя), например, для пиразолов. [ 19 ]

При . использовании гидразингидрата исходное тело пиразола образуется с выходом 84%
Реакции на соли винилиния
[ редактировать ]Реакция 3-диметиламиноакролеина с тетрафторборатом диметиламмония практически количественно дает винилидиниевую соль 3-диметиламиноакролеин-диметилиминий-тетрафторборат, которая лучше кристаллизуется в виде перхлоратной соли. Соль также реагирует с циклопентадиеном в присутствии амида натрия в жидком аммиаке с образованием производного аминофульвена. [ 20 ]
Такая же соль винилидиния 1,1,5,5-тетраметил-1,5-диазапентадиенхлорид образуется и при реакции 3-диметиламиноакролеина с гидрохлоридом диметиламина с выходом 70%. [ 21 ] Двухстадийная реакция диметиламина и 70% хлорной кислоты с 3-диметиламиноакролеином образует одну и ту же иминиевую соль (называемую здесь перхлоратом 1,3-бис(диметиламино)триметиния). [ 22 ]

Лактоны (например, γ-бутиролактон) или циклические кетоны (такие как циклопентанон) образуют с виниламидиниевой солью 3-диметиламиноакролеина и гидрохлоридом диметиламина соответствующие диенаминоны с выходами 91% и 88%. [ 23 ]

Винамидиниевая соль 1,1,5,5-тетраметил-1,5-диазапентадиенхлорид реагирует с гетероциклами, несущими CH-кислотные группы, с образованием соответствующих диенаминов, которые могут циклизоваться с основаниями с образованием конденсированных гетероароматических соединений, таких как карбазолы, бензофураны или бензотиофены. . [ 8 ]
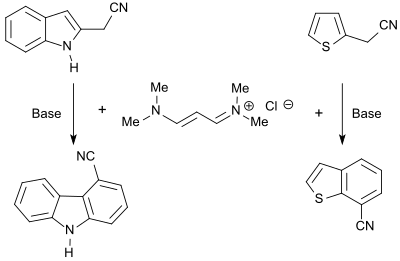
N -алкилпирролы с хорошим выходом (86%) получаются при реакции виниламидиниевой соли с эфирами глицина. [ 24 ] замещенные тиофены (до 87%) в реакции с эфирами меркаптоуксусной кислоты . [ 25 ]

Использование 3-диметиламиноакролеина для синтеза 2-хлорникотиновой кислоты (2-ЦНК) представляет промышленный интерес как важный исходный материал для агрохимикатов и фармацевтических препаратов. Для этого 3-диметиламиноакролеин подвергают реакции с цианессигсауреэтиловым эфиром. [ 26 ] к 2-хлорникотин-этиловому эфиру или с н-бутиловым эфиром цианоуксусной кислоты до 2-хлорникотин-н-бутилового эфира [ 27 ] в реакции Кнёвенагеля.
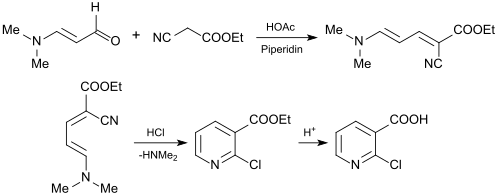
Полученные эфиры 2-хлорпиридинкарбоновой кислоты плавно гидролизуются до 2-хлорникотиновой кислоты.
Другие реакции
[ редактировать ]Реагирует слабощелочно и с хлоридом железа(III) придает темно-красный цвет.
Ссылки
[ редактировать ]- ^ Jump up to: а б с «3-(Диметиламино)акролеин 927-63-9 | TCI Deutschland GmbH» . www.tcichemicals.com (на немецком языке) . Проверено 14 января 2018 г.
- ^ Jump up to: а б Sigma-Aldrich Co. , номер продукта. 305839 .
- ^ Jump up to: а б с д DE 944852 , Ф. Вилле, «Способ производства производных 3-аминоакролеина», опубликован 28 июня 1956 г., передан Badische Anilin- & Soda-Fabrik AG.
- ^ Jump up to: а б с DE 2424373 , М. Декер, В. Шёнлебен, Х. Туссен, Х. Хоффманн, «Способ производства производных малонового диальдегида», опубликовано 11 декабря 1975 г., передано BASF AG.
- ^ US 5780622 , Д. Дельфин, Р. Бойл, «Методы синтеза 5,15-диарилбензохлор-7-она», опубликован 14 июля 1998 г., передан Университету Британской Колумбии.
- ^ Таммел, Рэндольф П. «( Z )-β-аминоакролеин». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.ra087 .
- ^ Л. Дж. Нидерхофер; Дж. С. Дэниелс; CA Роузер; Р.Э. Грин; LJ Marnett (2003), «Малоновый диальдегид, продукт перекисного окисления липидов, является мутагенным в клетках человека», J. Biol. хим. , том. 278, нет. 33, стр. 31426–31433, doi : 10.1074/jbc.M212549200 , PMID 12775726.
- ^ Jump up to: а б Д. Ллойд; Х. Макнаб (1976), «Винамидин и соли винилидиния - примеры стабилизированных двухтактных алкенов», Angew. хим. , вып. 88, № 15, стр. 496–504, номер документа : 10.1002/anie.19760881503.
- ^ С. Махсид; HME Хасанин; М.Х. Эльнагди (2007), «Исследования с 2-(арилгидразоно)альдегидами: синтез и химическая реакционная способность 2-арилгидразонов мезоксалальдегида и этил-2-арилгидразоно-3-оксопропионатов» (PDF) , Z. Naturforsch. , том. 62б, стр. 529–536.
- ^ П. Перлмуттер (2001), «Пропаргиловый альдегид», Энциклопедия реагентов для органического синтеза E-EROS , doi : 10.1002/047084289X.rp262m , ISBN 0471936235
- ^ З. Арнольд; Ф. Сорм (1958), «Реакции синтеза диметилформамида. I. Общий синтез β-диальдегидов», Сборник. Чешский. хим. (на немецком языке), том. 23, № 3, стр. 452–461, doi : 10.1135/cccc19580452.
- ^ DE 19825200 , Д. Гольш, М. Кейл, Х. Исак, «Способ производства производных 3-аминоакролеина», опубликовано 18 ноября 1999 г., передано BASF AG.
- ^ Х. Бредерек; Ф. Эффенбергер; Г. Симхен (1963), «Кислотные амидные реакции, XXXII. О комплексах кислый амид-диалкилсульфат», Chem. Ber. (на немецком языке), том. 96, № 5, стр. 1350–1355, doi : 10.1002/cber.19630960526.
- ^ Х. Бредерек; Ф. Эффенбергер; Д. Зейфанг (1965), «Синтез и реакции винилологических амидов, ацеталей и амидинов» , Angew. Chem (на немецком языке), том. 77, № 5, с. 219, Bibcode : 1965AngCh..77..219B , doi : 10.1002/anie.19650770511
- ^ К. Ютц; К. Ютц; Р. М. Вагнер (1972), «Синхронная шестиэлектронная циклизация гексатриеновых систем как новый синтетический принцип получения ароматических и гетероароматических соединений», Angew. Chem (на немецком языке), том. 84, № 7, стр. 299–302, Бибкод : 1972AngCh..84..299J , doi : 10.1002/anie.19720840714.
- ^ Ф. В. Ульрих; Э. Брейтмайер (1983), «Винилогенное формилирование Вильсмайера с 3-(N,N-диметиламино)-акролейненом», Synthesis (на немецком языке), vol. 1983, № 8, стр. 641–645, номер документа : 10.1055/s-1983-30457 , S2CID 95436195.
- ^ Д. Шрирам; П. Йогесвари (2010), Медицинская химия (2-е изд.), Дели: Пирсон, с. 364, ISBN 978-81-317-3144-4
- ^ Дж. Т. Захария; Т. Танака; М. Хагаши (2010), «Легкий и высоко эненатиоселективный синтез (+)- и (-)-флувастатина и их аналогов», J. Org. хим. , том. 75, нет. 22, стр. 7514–7518, doi : 10.1021/jo101542y , PMID 20939538
- ^ ЕР 0731094 , H.-J. Вробловски, Р. Ланч, «Процесс производства пиразолов», опубликовано 11 сентября 1996 г., передано Bayer AG.
- ^ З. Арнольд; Дж. Землячка (1960), «Реакции солей формамидиния и их винилогов с карбанионами», Сборник. Чешский. хим. (на немецком языке), том. 25, № 5, стр. 1302–1307, номер документа : 10.1135/cccc19601302.
- ^ В. Наир; CS Cooper (1981), «Химия солей 1,5-диазапентадиения (винамидиния): реакции алкилирования с образованием многофункциональных диенаминов и диенаминонов», J. Org. хим. , том. 46, нет. 23, стр. 4759–4765, doi : 10.1021/jo00336a027.
- ^ З. Арнольд; Д. Дворжак; М. Хавранек (1996), «Удобное получение перхлората, тетрафторбората и гексафторфосфата 1,3-бис(диметиламино)триметиния», Сборник. Чешский. хим. Коммун. , том. 61, нет. 11, стр. 1637–1641, doi : 10.1135/cccc19961637.
- ^ В. Наир; CS Cooper (1980), «Реакции селективного алкилирования солями винилидиния», Tetrahedron Lett. , том. 21, нет. 33, стр. 3155–3158, номер документа : 10.1016/S0040-4039(00)77433-8.
- ^ М.Т. Райт; Д. Г. Кэрролл; ТМ Смит; С. К. Смит (2010), «Синтез алкилпирролов с использованием соли винилидиния», Tetrahedron Lett. , том. 51, нет. 31, стр. 4150–4152, номер документа : 10.1016/j.tetlet.2010.06.009.
- ^ РТ Клеменс; С. К. Смит (2005), «Применение солей винамидиния для синтеза 2,4-дизамещенных тиофенов», Tetrahedron Lett. , том. 46, нет. 8, стр. 1319–1320, номер документа : 10.1016/j.tetlet.2004.12.113.
- ^ EP 0372654 , Л. Шредер, «Получение сложных эфиров 2-хлорпиридина и 3-карбоновой кислоты», опубликован 13 июня 1990 г., передан Shell Internationale Research Maatschappij BV.
- ^ WO 0007989 , Д. Гольш, М. Кейл, Х. Исак, Х. Майер, «Способ получения производных 2-галоникотиновой кислоты и н-бутилового эфира 2-галоникотиновой кислоты в качестве промежуточного продукта», опубликовано 17 февраля 2000 г. , передано BASF AG