Оптогенетические методы регистрации клеточной активности
Оптогенетика началась с методов изменения активности нейронов с помощью света, например, с использованием каналородопсинов . В более широком смысле оптогенетические подходы также включают использование генетически закодированных биосенсоров для мониторинга активности нейронов или других типов клеток путем измерения флуоресценции или биолюминесценции . Генетически закодированные индикаторы кальция (GECI) часто используются для мониторинга активности нейронов, но другие клеточные параметры, такие как напряжение мембраны или активность вторичного мессенджера, также могут быть записаны оптически. Использование оптогенетических сенсоров не ограничивается нейробиологией , но играет все более важную роль в иммунологии , кардиологии и исследованиях рака .
История
[ редактировать ]Первые эксперименты по измерению внутриклеточных уровней кальция посредством экспрессии белка были основаны на экворине , биолюминесцентном белке медузы Aequorea . Однако для производства света этому ферменту необходимо «топливное» соединение целентерацин , которое необходимо добавить в препарат. Это непрактично для интактных животных, и, кроме того, временное разрешение биолюминесцентной визуализации относительно низкое (секунды-минуты). Первым генетически кодируемым флуоресцентным индикатором кальция (GECI), который можно было использовать для визуализации активности животного, был камелеон , разработанный Ацуши Мияваки, Роджером Циеном и его коллегами в 1997 году. [1] Cameleon впервые был успешно использован на животных Рексом Керром, Уильямом Шафером и его коллегами для записи данных с нейронов и мышечных клеток нематоды C. elegans . [2] Впоследствии Cameleon использовался для регистрации нейронной активности мух. [3] и рыбка данио. [4] У млекопитающих первым GECI, использованным in vivo, был GCaMP . [5] впервые разработан Джуничи Накаи и его коллегами в 2001 году. [6] GCaMP претерпел многочисленные улучшения, в частности, группой ученых из исследовательского кампуса фермы Джанелия (проект GENIE, HHMI ), а GCaMP6 [7] в частности, стал широко использоваться в нейробиологии. Совсем недавно рецепторы, связанные с G-белком, были использованы для генерации ряда высокоспецифичных индикаторов для различных нейротрансмиттеров . [8] [9]
Принципы проектирования
[ редактировать ]Генетически кодируемые сенсоры представляют собой слитые белки , состоящие из лиганд-связывающего домена (сенсора) и флуоресцентного белка , присоединенного коротким линкером (гибким пептидом). Когда сенсорный домен связывает правильный лиганд, он меняет конформацию. Это движение передается флуоресцентному белку, и возникающая в результате деформация приводит к изменению флуоресценции. Эффективность этого процесса критически зависит от длины линкерной области, которую необходимо оптимизировать в трудоемком процессе. Флуоресцентный белок часто подвергается циркулярной перестановке , т.е. новые С-концевые и N-концевые создаются концы. Одноволновые датчики легко использовать для качественных измерений, но их сложно калибровать для количественных измерений концентрации лигандов.
Второй класс сенсоров основан на резонансной передаче энергии Фёрстера (FRET) между двумя флуоресцентными белками (FP) разного цвета. Более коротковолновый FP (донор) возбуждается синим светом лазера или светодиода. Если второй ФП (акцептор) находится очень близко, энергия передается акцептору, что приводит к желтой или красной флуоресценции. Когда акцепторный ФП отодвигается дальше, донор излучает зеленую флуоресценцию. Сенсорный домен обычно сращивается между двумя FP, что приводит к движению шарнирного типа при связывании лиганда, которое изменяет расстояние между донором и акцептором. Процедура визуализации более сложна для датчиков FRET, но коэффициент флуоресценции можно откалибровать для измерения абсолютной концентрации лиганда. Также возможно считывание флуоресценции донора с помощью визуализации времени жизни флуоресценции (FLIM), поскольку процесс FRET ускоряет затухание флуоресценции.
Преимущества оптогенетических датчиков
[ редактировать ]- могут быть нацелены на определенные классы клеток (например, астроциты или пирамидные клетки ). Это позволяет осуществлять оптическое считывание данных без пространственного разрешения, например, фотометрию по оптоволокну из глубоких областей мозга. [10]
- может быть нацелен на субклеточные компартменты (например, синапсы, органеллы , ядро) путем слияния индикаторного белка со специфическими доменами якоря, сигналами удерживания или внутрительцами .
- работа с различными видами ( нематоды , насекомые, рыбы, млекопитающие) и в клеточных культур системах ( анализ FLIPR )
- может быть доставлен вирусными векторами (например, rAAV )
- может использоваться для одновременной записи активности тысяч нейронов [11]
Недостатки, ограничения
[ редактировать ]- будет буферизовать измеренный ион или белок, потенциально мешая клеточной передаче сигналов
- подвергаются фотообесцвечиванию , что ухудшает долгосрочные измерения
- может быть токсичным при очень высокой концентрации
- требуются высокочувствительные камеры или лазерные сканирующие микроскопы
- некоторые датчики на основе GPCR чувствительны к поляризации [12]
- большинство индикаторов являются зелеными флуоресцентными, что затрудняет одновременное измерение нескольких клеточных параметров ( мультиплексирование ).
Классы генетически закодированных показателей
[ редактировать ]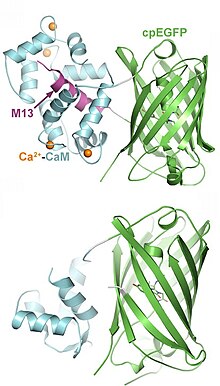
Были разработаны индикаторы для измерения концентраций ионов, мембранного потенциала, нейротрансмиттеров и различных внутриклеточных сигнальных молекул. В следующем списке приведены только примеры для каждого класса; многие другие были опубликованы.
Внутриклеточная передача сигналов
[ редактировать ]- Генетически кодируемые индикаторы кальция (GECI): большой класс инструментов, основанных на природных кальцийсвязывающих белках ( кальмодулин , тропонин ). Доступны различные сродства, кинетики и цвета (зеленый, красный). Считывание по интенсивности флуоресценции (индикаторы с одной длиной волны), FRET или BRET . Были нацелены на различные органеллы. Текущая версия: JGCaMP8. [13]
- Генетически закодированные хлоридные индикаторы: Кломелеон. [14]
- Генетически закодированные калия : GINKO2. индикаторы [15]
- Генетически кодированные индикаторы внутриклеточного pH (GEPHI): CypHer [16]
- Генетически кодированные индикаторы напряжения (GEVI): ArcLight [17]
- Генетически закодированные датчики слияния везикул: синапто-флюорин , синаптофизин-флуорин. [18]
- Генетически закодированные сенсоры цАМФ: EPAC [19]
- Генетически закодированные датчики АТФ : QUEEN-37C [20]
- Генетически закодированные датчики киназной активности: CaMui, [21] СмУРФП
- Генетически закодированные маленькие сенсоры G-белка: FRas [22]
Нейротрансмиттеры и другие внеклеточные сигналы
[ редактировать ]- Генетически закодированные сенсоры глутамата: GluSnFR [23]
- Генетически закодированные ГАМК : iGABASnFR. датчики [24]
- Генетически закодированные датчики дофамина : dLight1, [25] ГРАБ-ДА [26]
- Генетически закодированные серотонина сенсоры : GRAB 5-HT , [27] сДаркен, [28] иСероСнФР [29]
- Генетически закодированные датчики норадреналина : GRAB NE [30]
- Генетически закодированный датчик эндоканнабиноидной активности: GRAB eCB2.0 [31]
- Генетически закодированный сенсор нейропептидов орексина/гипокретина : OxLight1. [32]
- Генетически закодированный датчик лактата : eLACCO1.1 [33]
Дальнейшее чтение
[ редактировать ]Недавний обзор на основе GPCR. генетически кодируемых флуоресцентных индикаторов нейромодуляторов [9]
Внешние ссылки
[ редактировать ]- База данных флуоресцентных биосенсоров , довольно полный список опубликованных датчиков и их основных свойств с возможностью поиска, поддерживаемый лабораторией Цзинь Чжана в Калифорнийском университете в Сан-Франциско. [34]
- Флуоресцентные биосенсоры доступны на Addgene , некоммерческом репозитории плазмид.
Ссылки
[ редактировать ]- ^ Мияваки А., Ллопис Дж., Хайм Р., Маккаффери Дж.М., Адамс Дж.А., Икура М., Цянь Р.Ю. (август 1997 г.). «Флуоресцентные индикаторы Ca2+ на основе зеленых флуоресцентных белков и кальмодулина» . Природа . 388 (6645): 882–887. Бибкод : 1997Natur.388..882M . дои : 10.1038/42264 . ПМИД 9278050 . S2CID 13745050 .
- ^ Керр Р., Лев-Рам В., Бэрд Дж., Винсент П., Цьен Р.Ю., Шафер В.Р. (июнь 2000 г.). «Оптическая визуализация переходных процессов кальция в нейронах и глоточных мышцах C. elegans» . Нейрон . 26 (3): 583–594. дои : 10.1016/s0896-6273(00)81196-4 . ПМИД 10896155 . S2CID 311998 .
- ^ Фиала А., Сполл Т., Дигельманн С., Эйзерманн Б., Саксе С., Дево Дж.М. и др. (октябрь 2002 г.). «Генетически экспрессируемый камелеон у Drosophila melanogaster используется для визуализации обонятельной информации в проекционных нейронах» . Современная биология . 12 (21): 1877–1884. Бибкод : 2002CBio...12.1877F . дои : 10.1016/s0960-9822(02)01239-3 . ПМИД 12419190 . S2CID 6312049 .
- ^ Хигасиджима С., Масино М.А., Мандель Г., Фетчо Дж.Р. (декабрь 2003 г.). «Визуализация активности нейронов во время поведения рыбок данио с помощью генетически закодированного индикатора кальция». Журнал нейрофизиологии . 90 (6): 3986–3997. дои : 10.1152/jn.00576.2003 . ПМИД 12930818 . S2CID 2230173 .
- ^ Джи Дж., Фельдман М.Э., Дэн К.Ю., Грин К.С., Уилсон Дж., Ли Дж.К. и др. (май 2004 г.). «Са2+-чувствительные трансгенные мыши: постсинаптическая передача сигналов в гладких мышцах» . Журнал биологической химии . 279 (20): 21461–21468. дои : 10.1074/jbc.M401084200 . ПМИД 14990564 .
- ^ Накаи Дж., Окура М., Имото К. (февраль 2001 г.). «Зонд Ca (2+) с высоким соотношением сигнал-шум, состоящий из одного зеленого флуоресцентного белка». Природная биотехнология . 19 (2): 137–141. дои : 10.1038/84397 . ПМИД 11175727 . S2CID 30254550 .
- ^ Чен Т.В., Уордилл Т.Дж., Сунь Ю., Пулвер С.Р., Реннингер С.Л., Баохан А. и др. (июль 2013 г.). «Сверхчувствительные флуоресцентные белки для визуализации активности нейронов» . Природа . 499 (7458): 295–300. Бибкод : 2013Natur.499..295C . дои : 10.1038/nature12354 . ПМЦ 3777791 . ПМИД 23868258 .
- ^ Равотто Л., Даффет Л., Чжоу Х, Вебер Б., Патриарх Т. (2020). «Яркое и красочное будущее сенсоров рецепторов, связанных с G-белком» . Границы клеточной нейронауки . 14:67 . дои : 10.3389/fncel.2020.00067 . ПМК 7098945 . PMID 32265667 .
- ^ Jump up to: а б Ронер, Валентин Лу; Ламот-Молина, Пол Дж.; Патриарх, Томмазо (30 января 2024 г.). «Разработка, применение и будущие перспективы генетически кодируемых флуоресцентных индикаторов на основе GPCR для нейромодуляторов» . Журнал нейрохимии . 168 (3): 163–184. дои : 10.1111/jnc.16045 . hdl : 20.500.11850/659388 . ISSN 0022-3042 . ПМИД 38288673 .
- ^ Джонс-Табах Дж., Мохаммад Х., Хадж-Юсеф С., Ким Л.Е., Мартин Р.Д., Беналиуад Ф. и др. (сентябрь 2020 г.). «Передача сигналов рецептора дофамина D1 у крыс с дискинезией Паркинсона, выявленная с помощью волоконной фотометрии с использованием биосенсоров на основе FRET» . Научные отчеты . 10 (1): 14426. Бибкод : 2020NatSR..1014426J . дои : 10.1038/s41598-020-71121-8 . ПМЦ 7468292 . ПМИД 32879346 .
- ^ Софронов, Нью-Джерси (сентябрь 2017 г.). «Вопросы и ответы: Мозг под мезоскопом: лес и деревья» . БМК Биология . 15 (1): 82. дои : 10.1186/s12915-017-0426-y . ПМК 5598035 . ПМИД 28911321 .
- ^ Пулин М., Штокхаузен К.Е., Массек О.А., Кубичке М., Буссе Б., Вигерт Дж.С., Эртнер Т.Г. (февраль 2022 г.). «Ортогонально-поляризованное возбуждение для улучшенной двухфотонной микроскопии и микроскопии с генерацией второй гармоники, применяемой для визуализации нейротрансмиттеров с помощью датчиков на основе GPCR» . Биомедицинская оптика Экспресс . 13 (2): 777–790. дои : 10.1364/BOE.448760 . ПМЦ 8884218 . ПМИД 35284188 .
- ^ Чжан Й., Рожа М., Буши Д., Чжэн Дж., Рип Д., Бруссар Г.Дж., Цанг А., Цегай Г., Патель Р., Нараян С., Лим Дж.Х. (2020). «Быстрые генетически закодированные индикаторы кальция jGCaMP8». Исследовательский кампус Джанелия : 361685. doi : 10.25378/JANELIA.13148243 .
- ^ Берглунд К., Шляйх В., Ван Х., Фэн Г., Холл У.К., Кунер Т., Августин Г.Дж. (август 2008 г.). «Визуализация синаптического торможения по всему мозгу с помощью генетически нацеленного Кломелеона» . Биология клеток мозга . 36 (1–4): 101–118. дои : 10.1007/s11068-008-9031-x . ПМЦ 2674236 . ПМИД 18850274 .
- ^ Ву, Шэн-И; Да, Юронг; Теплица, Нельсон, Британская Колумбия; Лаурсен, Кэтрин Шарлотта Хайде; Дитц, Андреа Гростол; Тейлор, Брайан Р.; Дробыжев Михаил; Молина, Розанна С.; Аггарвал, Абхи; Ранчич, Владимир; Беккер, Майкл; Баллани, Клаус; Подгорский, Каспар; Хирасе, Хадзиме; Недергаард, Майкен (06 сентября 2022 г.). Дутцлер, Раймунд (ред.). «Чувствительный и специфичный генетически закодированный биосенсор ионов калия для применения in vivo на протяжении всего древа жизни» . ПЛОС Биология . 20 (9):e3001772. дои : 10.1371/journal.pbio.3001772 . ISSN 1545-7885 . ПМЦ 9481166 . ПМИД 36067248 .
- ^ Хан Дж., Берджесс К. (май 2010 г.). «Флуоресцентные индикаторы внутриклеточного pH». Химические обзоры . 110 (5): 2709–2728. дои : 10.1021/cr900249z . ПМИД 19831417 .
- ^ Джин Л., Хан З., Платиса Дж., Вултортон Дж.Р., Коэн Л.Б., Пирибоне В.А. (сентябрь 2012 г.). «Одиночные потенциалы действия и подпороговые электрические события, визуализируемые в нейронах с помощью флуоресцентного белкового зонда напряжения» . Нейрон . 75 (5): 779–785. дои : 10.1016/j.neuron.2012.06.040 . ПМЦ 3439164 . ПМИД 22958819 .
- ^ Грансет Б., Одерматт Б., Ройл С.Дж., Лагнадо Л. (сентябрь 2006 г.). «Клатрин-опосредованный эндоцитоз является доминирующим механизмом извлечения пузырьков в синапсах гиппокампа» . Нейрон . 51 (6): 773–786. дои : 10.1016/j.neuron.2006.08.029 . ПМИД 16982422 . S2CID 921124 .
- ^ Кларенбек Дж., Гоедхарт Дж., ван Батенбург А., Гроеневальд Д., Джалинк К. (14 апреля 2015 г.). «Датчики FRET четвертого поколения на базе epac для цАМФ отличаются исключительной яркостью, фотостабильностью и динамическим диапазоном: характеристика специализированных датчиков для FLIM, ратиометрии и высокого сродства» . ПЛОС ОДИН . 10 (4): e0122513. Бибкод : 2015PLoSO..1022513K . дои : 10.1371/journal.pone.0122513 . ПМК 4397040 . ПМИД 25875503 .
- ^ Ягинума Х., Окада Ю. (09.10.2021). «Визуализация метаболической гетерогенности живых клеток с помощью количественного флуоресцентного индикаторного белка АТФ, QUEEN-37C». bioRxiv : 2021.10.08.463131. дои : 10.1101/2021.10.08.463131 . S2CID 238585891 .
- ^ Ли С.Дж., Эскобедо-Лозойя Ю., Сатмари Э.М., Ясуда Р. (март 2009 г.). «Активация CaMKII в одиночных дендритных шипиках во время долгосрочной потенциации» . Природа . 458 (7236): 299–304. Бибкод : 2009Natur.458..299L . дои : 10.1038/nature07842 . ПМЦ 2719773 . ПМИД 19295602 .
- ^ Оливейра А.Ф., Ясуда Р. (14 января 2013 г.). «Улучшенный датчик Ras для высокочувствительной и количественной визуализации FRET-FLIM» . ПЛОС ОДИН . 8 (1): e52874. Бибкод : 2013PLoSO...852874O . дои : 10.1371/journal.pone.0052874 . ПМЦ 3544822 . ПМИД 23349692 .
- ^ Марвин Дж.С., Шолл Б., Уилсон Д.Е., Подгорски К., Каземипур А., Мюллер Дж.А. и др. (ноябрь 2018 г.). «Стабильность, сродство и хроматические варианты глутаматного сенсора iGluSnFR» . Природные методы . 15 (11): 936–939. дои : 10.1038/s41592-018-0171-3 . ПМК 6394230 . ПМИД 30377363 .
- ^ Марвин Дж.С., Симода Й., Маглуар В., Лейте М., Кавасима Т., Дженсен Т.П. и др. (август 2019 г.). «Генетически закодированный флуоресцентный датчик для визуализации ГАМК in vivo». Природные методы . 16 (8): 763–770. дои : 10.1038/s41592-019-0471-2 . ПМИД 31308547 . S2CID 196812412 .
- ^ Патриарх Т., Чо Дж.Р., Мертен К., Хоу М.В., Марли А., Сюн В.Х. и др. (июнь 2018 г.). «Сверхбыстрая нейронная визуализация динамики дофамина с помощью разработанных генетически закодированных датчиков» . Наука . 360 (6396): eaat4422. дои : 10.1126/science.aat4422 . ПМК 6287765 . ПМИД 29853555 .
- ^ Лабуесс М.А., Кола Р.Б., Патриарх Т. (октябрь 2020 г.). «Датчики дофамина на основе GPCR — подробное руководство по выбору датчика для визуализации in vivo» . Международный журнал молекулярных наук . 21 (21): 8048. doi : 10.3390/ijms21218048 . ПМЦ 7672611 . ПМИД 33126757 .
- ^ Ван Дж., Пэн В., Ли Икс, Цянь Т., Сун К., Цзэн Дж. и др. (май 2021 г.). «Генетически закодированный датчик для измерения динамики серотонина» . Природная неврология . 24 (5): 746–752. дои : 10.1038/s41593-021-00823-7 . ПМЦ 8544647 . ПМИД 33821000 .
- ^ Кубичке, Мартин; Мюллер, Моника; Уоллхорн, Лутц; Пулин, Мауро; Полдень, Мануэль; Поллок, Стефан; Зибарт, Тим; Бремши, Свенья; Герди, Джилл; Клауссен, Кристин Кэролин; Ренкен, Ким; Отлично, Джулиана; Гнейсе, Паскаль; Мейер, Никлас; Вигерт, Дж. Саймон (6 декабря 2022 г.). «Генетически закодированные флуоресцентные датчики нового поколения для серотонина» . Природные коммуникации . 13 (1): 7525. Бибкод : 2022NatCo..13.7525K . doi : 10.1038/s41467-022-35200-w . ISSN 2041-1723 . ПМЦ 9726753 . ПМИД 36473867 . S2CID 247454046 .
- ^ Унгер, Элизабет К.; Келлер, Джейкоб П.; Альтерматт, Майкл; Лян, Жуцян; Мацуи, Ая; и др. (декабрь 2020 г.). «Направленная эволюция селективного и чувствительного датчика серотонина посредством машинного обучения» . Клетка . 183 (7): 1986–2002.e26. дои : 10.1016/j.cell.2020.11.040 . ПМЦ 8025677 . ПМИД 33333022 .
- ^ Фэн Дж., Чжан С., Лищинский Дж.Э., Цзин М., Чжоу Дж., Ван Х. и др. (май 2019 г.). «Генетически закодированный флуоресцентный датчик для быстрого и специфического обнаружения норадреналина in vivo» . Нейрон . 102 (4): 745–761.e8. дои : 10.1016/j.neuron.2019.02.037 . ПМК 6533151 . ПМИД 30922875 .
- ^ Донг А., Хе К., Дудок Б., Фаррелл Дж.С., Гуан В., Липут DJ и др. (ноябрь 2021 г.). «Флуоресцентный датчик для визуализации динамики эндоканнабиноидов in vivo с пространственно-временным разрешением» . Природная биотехнология . 40 (5): 787–798. дои : 10.1038/s41587-021-01074-4 . ПМК 9091059 . ПМИД 34764491 . S2CID 244039925 .
- ^ Даффет Л., Косар С., Панниелло М., Виберти Б., Брейси Э., Зих А.Д. и др. (февраль 2022 г.). «Генетически закодированный датчик для визуализации нейропептидов орексина in vivo» . Природные методы . 19 (2): 231–241. дои : 10.1038/s41592-021-01390-2 . ПМЦ 8831244 . ПМИД 35145320 .
- ^ Насу, Юске; Мерфи-Роял, Кьяран; Да, Юронг; Хайди, Джордан Н.; Молина, Розанна С.; Аггарвал, Абхи; Чжан, Шуце; Камидзё, Юки; Пакет, Мари-Ева; Подгорский, Каспар; Дробыжев Михаил; Бэйнс, Джайдип С.; Лемье, М. Жоан; Гордон, Грант Р.; Кэмпбелл, Роберт Э. (06 декабря 2021 г.). «Генетически закодированный флуоресцентный биосенсор внеклеточного L-лактата» . Природные коммуникации . 12 (1): 7058. Бибкод : 2021NatCo..12.7058N . дои : 10.1038/ s41467-021-27332-2 ISSN 2041-1723 . ПМЦ 8648760 . ПМИД 34873165 .
- ^ Гринвальд Э.К., Мехта С., Чжан Дж. (декабрь 2018 г.). «Генетически закодированные флуоресцентные биосенсоры проливают свет на пространственно-временную регуляцию сигнальных сетей» . Химические обзоры . 118 (24): 11707–11794. doi : 10.1021/acs.chemrev.8b00333 . ПМЦ 7462118 . ПМИД 30550275 .