Бис(трифенилфосфин)палладий хлорид
| |
| |

| |
| Идентификаторы | |
|---|---|
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.034.299 |
ПабХим CID
|
|
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
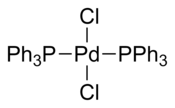
| PdCl 2 (PPh 3 ) 2 | |
| Молярная масса | 701.90 g·mol −1 |
| Появление | желтый порошок |
| Температура плавления | 260 °C (разлагается около 300 °C) |
| нерастворимый | |
| Растворимость | растворим в хлороформе, гексане, толуоле, бензоле, ацетоне [1] |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | 181,7 °С |
| Родственные соединения | |
Родственные соединения
|
Хлорид бис(трифенилфосфин)платины |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Хлорид бис(трифенилфосфин)палладия представляет собой координационное соединение палладия, содержащее два трифенилфосфиновых и два хлоридных лиганда. Это желтое твердое вещество, растворимое в некоторых органических растворителях. Он используется для катализируемых палладием реакций сочетания , например, реакции Соногаширы-Хагихары . Комплекс плоско-квадратный . Известно множество аналогичных комплексов с различными фосфиновыми лигандами.
Препарат и реакции
[ редактировать ]Это соединение можно получить обработкой хлорида палладия (II трифенилфосфином ) : [2] [3]
- PdCl 2 + 2 PPh 3 → PdCl 2 (PPh 3 ) 2
При восстановлении гидразином в присутствии избытка трифенилфосфина комплекс является предшественником тетракис(трифенилфосфин)палладия Pd(PPh 3 ) 4 : [4]
- 2 PdCl 2 (PPh 3 ) 2 + 4 PPh 3 + 5 N 2 H 4 → 2 Pd(PPh 3 ) 4 + N 2 + 4 N 2 H 5 + кл −
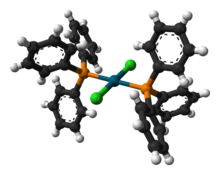
Структура
[ редактировать ]о нескольких кристаллических структурах , содержащих PdCl 2 (PPh 3 ) 2 Сообщалось . Во всех структурах PdCl 2 (PPh 3 ) 2 принимает плоско-квадратную координационную геометрию и транс- изомерную форму . [5] [6] [7] [8]
Приложения
[ редактировать ]Комплекс используется в качестве предварительного катализатора для различных реакций сочетания. [9]

Реакция Сузуки когда-то была ограничена высоким содержанием катализатора и ограниченной доступностью бороновых кислот. Также были найдены замены галогенидам, что также увеличило количество партнеров взаимодействия галогенида или псевдогалогенида. Используя хлорид бис(трифенилфосфин)палладия в качестве катализатора, трифлаты и бороновые кислоты были соединены в масштабе 80 килограммов с хорошим выходом. [10] Тот же катализатор эффективен для реакции Соногашира . [11]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ «PdCl2(PPh3)2» . Химический Паук . Проверено 2 января 2024 г.
- ^ Норио Мияура ; Акира Сузуки (1990). «Катализируемая палладием реакция 1-алкенилборонатов с винилгалогенидами: (1Z,3E)-1-фенил-1,3-октадиен». Органические синтезы . 68 : 130. дои : 10.15227/orgsyn.068.0130 .
- ^ Хироши Итатани; Дж. К. Байлар (1967). «Гомогенный катализ в реакциях олефиновых веществ. V. Гидрирование метилового эфира соевого масла трифенилфосфином и трифениларсин-палладиевым катализатором». Журнал Американского общества нефтехимиков . 44 : 147. дои : 10.1007/BF02558176 . S2CID 93580917 .
- ^ Д. Р. Коулсон (1972). «Тетракис(трифенилфосфин)палладий(0)». Неорганические синтезы . Том. 13. С. 121–124. дои : 10.1002/9780470132449.ch23 . ISBN 978-0-470-13244-9 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Г. Фергюсон; Р. МакКриндл; Эй Джей МакЭлис; М. Парвез (1982). « Транс -дихлорбис(трифенилфосфин)палладий(II)». Акта Кристаллогр . Б38 (10): 2679–2681. дои : 10.1107/S0567740882009583 .
- ^ Г. Стейл (2006). « Транс -дихлорбис(трифенилфосфин)палладий(II) дихлорметановый сольват». Акта Кристаллогр. Э. 62 (6): м1324–м1325. дои : 10.1107/S1600536806017521 .
- ^ Дж. Понс; Х. Гарсиа-Антон; Х. Соланс; М. Фонт-Бардия; Дж. Рос (2008). « Транс -дихлоридобис(трифенилфосфин)палладий(II)» . Акта Кристаллогр. И . 64 (Часть 5): m621. дои : 10.1107/S1600536808008337 . ПМЦ 2961313 . ПМИД 21202176 .
- ^ А. Нагипур; А. Горбани-Чогамарани ; Х. Бабаи; М. Хашеми; Б. Ноташ (2017). «Кристаллическая структура нового полиморфа транс -дихлорбис (трифенилфосфина) палладия (II) и его применение в качестве нового, эффективного и легко извлекаемого катализатора для аминирования арилгалогенидов и реакций кросс-сочетания Стилла». Дж. Органомет. хим. 841 : 31–38. дои : 10.1016/j.jorganchem.2016.10.002 .
- ^ Рене Северен; Джессика Реймер; Свен Дой (2010). «Однореакторный метод синтеза несимметричных диарилалкинов». Дж. Орг. Хим . 75 (10): 3518–352. дои : 10.1021/jo100460v . ПМИД 20420397 .
- ^ Джекс, TE; Бельмонт, Дэниел Т.; Бриггс, Кристофер А.; Хорн, Николь М.; Кантер, Джеральд Д.; Каррик, Грег Л.; Крикке, Джеймс Дж.; Маккейб, Ричард Дж.; Мустакис, Джейсон Г.; Наннинга, Томас Н. (2004). «Разработка масштабируемого процесса для CI-1034, антагониста эндотелина». Исследования и разработки органических процессов . 8 (2): 201–212. дои : 10.1021/op034104g .
- ^ Шиншилла, Р.; Нахера, К. (2007). «Реакция Соногаширы: быстро развивающаяся методология в синтетической органической химии». хим. Преподобный . 107 (3): 874–922. дои : 10.1021/cr050992x . ПМИД 17305399 .
