Ниша стволовых клеток
Эта статья нуждается в дополнительных цитатах для проверки . ( октябрь 2015 г. ) |
Ниша стволовых клеток — это микроокружение в определенном анатомическом месте, где находятся стволовые клетки , которое взаимодействует со стволовыми клетками, регулируя судьбу клеток. [1] Слово «ниша» может относиться к in vivo или in vitro микроокружению стволовых клеток . Во время эмбрионального развития различные нишевые факторы действуют на эмбриональные стволовые клетки, изменяя экспрессию генов и индуцируя их пролиферацию или дифференцировку для развития плода. В человеческом организме ниши стволовых клеток поддерживают взрослые стволовые клетки в состоянии покоя, но после повреждения тканей окружающая микросреда активно сигнализирует стволовым клеткам о необходимости стимулировать либо самообновление, либо дифференцировку для формирования новых тканей. Для регулирования характеристик стволовых клеток внутри ниши важны несколько факторов: межклеточные взаимодействия между стволовыми клетками, а также взаимодействия между стволовыми клетками и соседними дифференцированными клетками, взаимодействия между стволовыми клетками и молекулами адгезии, компоненты внеклеточного матрикса, напряжение кислорода, факторы роста, цитокины и физико-химическая природа окружающей среды, включая pH, ионную силу (например, концентрацию Ca 2+ ) и метаболиты, такие как АТФ также важны. [2] Стволовые клетки и ниша могут индуцировать друг друга во время развития и взаимно сигнализировать о необходимости поддерживать друг друга во взрослом возрасте.
Ученые изучают различные компоненты ниши и пытаются воспроизвести in vivo условия ниши in vitro . [2] Это связано с тем, что для регенеративной терапии необходимо контролировать пролиферацию и дифференцировку клеток в колбах или планшетах, чтобы образовалось достаточное количество клеток соответствующего типа перед их введением обратно пациенту для терапии.
Эмбриональные стволовые клетки человека часто выращивают в средах, содержащих фибростатический фактор роста-2 и дополненных фетальной бычьей сывороткой. Их выращивают на питающем слое клеток, который, как полагают, способствует поддержанию плюрипотентных характеристик эмбриональных стволовых клеток. Однако даже эти условия могут не полностью имитировать in vivo нишевые условия .
Взрослые стволовые клетки остаются в недифференцированном состоянии на протяжении всей взрослой жизни. Однако когда их культивируют in vitro , они часто подвергаются процессу «старения», в ходе которого меняется их морфология и снижается их пролиферативная способность. Считается, что необходимо улучшить правильные условия культивирования взрослых стволовых клеток, чтобы взрослые стволовые клетки могли сохранять свою стволовость с течением времени. [ нужна ссылка ]
Обзор Nature Insight определяет нишу следующим образом:
«Популяции стволовых клеток создаются в «нишах» — определенных анатомических местах, которые регулируют то, как они участвуют в создании, поддержании и восстановлении тканей. Ниша спасает стволовые клетки от истощения, одновременно защищая хозяина от чрезмерного пролиферации стволовых клеток. представляет собой базовую единицу тканевой физиологии, объединяющую сигналы, которые опосредуют сбалансированный ответ стволовых клеток на потребности организмов. Однако ниша может также вызывать патологии, накладывая аберрантную функцию на стволовые клетки или другие мишени. Взаимодействие между стволовыми клетками и их нишами. создает динамическую систему, необходимую для поддержания тканей и для окончательной разработки терапии стволовыми клетками... Простого расположения стволовых клеток недостаточно для определения ниши. Ниша должна иметь как анатомические, так и функциональные размеры». [3]
История
[ редактировать ]Хотя концепция ниши стволовых клеток преобладала у позвоночных, первая характеристика ниши стволовых клеток in vivo была получена при зародышевом развитии дрозофилы . [ нужна ссылка ]
Архитектура ниши стволовых клеток
[ редактировать ]С помощью непрерывной прижизненной визуализации мышей исследователи смогли изучить структуру ниши стволовых клеток и узнать судьбу отдельных стволовых клеток (СК) и их потомства с течением времени in vivo. В частности, в криптах кишечника, [4] были идентифицированы две отдельные группы СК: «пограничные стволовые клетки», расположенные в верхней части ниши на границе с транзитными амплифицирующими клетками (ТА), и «центральные стволовые клетки», расположенные в основании крипт. Пролиферативный потенциал обеих групп был неодинаков и коррелировал с расположением клеток (центральное или пограничное). Было также показано, что два отсека SC действуют согласованно, поддерживая постоянную популяцию клеток и устойчивый клеточный оборот. Аналогичная зависимость потенциала самообновления от близости к границе ниши была обнаружена в контексте волосяного фолликула в исследовании in vivo с использованием живых изображений. [5]
Эта двухкамерная структура ниши стволовых клеток была математически смоделирована для получения оптимальной архитектуры, которая приводит к максимальной задержке производства мутантов с двойным ударом. [6] Они обнаружили, что двухкамерная архитектура SC минимизирует скорость образования двухчастных мутантов по сравнению с моделью с одним отсеком SC. Более того, минимальная вероятность образования двойного мутанта соответствует чисто симметричному делению СК с большой скоростью пролиферации пограничных стволовых клеток наряду с небольшой, но ненулевой скоростью пролиферации центральных стволовых клеток. [ нужна ссылка ]
Ниши стволовых клеток, содержащие непрерывно делящиеся клетки, например те, что расположены у основания кишечной железы , сохраняются при небольшом размере популяции. Это представляет собой проблему для поддержания многоклеточных тканей, поскольку небольшие популяции бесполого деления особей будут накапливать вредные мутации в результате генетического дрейфа и поддаваться мутационному кризису . [7] Математическое моделирование кишечной железы показывает, что небольшой размер популяции в нише стволовых клеток сводит к минимуму вероятность возникновения канцерогенеза где угодно за счет постепенного накопления вредных мутаций на протяжении всей жизни организма — процесса, который способствует деградации и старению тканей . [8] Следовательно, размер популяции ниши стволовых клеток представляет собой эволюционный компромисс между вероятностью образования рака и скоростью старения.
Примеры
[ редактировать ]Зародышевая линия
[ редактировать ]Стволовые клетки зародышевой линии (GSC) обнаруживаются в организмах, которые непрерывно производят сперму и яйцеклетки, пока они не станут стерильными. Эти специализированные стволовые клетки находятся в нише GSC, начальном месте производства гамет, которое состоит из GSC, соматических стволовых клеток и других соматических клеток. В частности, ниша GSC хорошо изучена в генетическом модельном организме Drosophila melanogaster и обеспечила обширное понимание молекулярных основ регуляции стволовых клеток. [ нужна ссылка ]
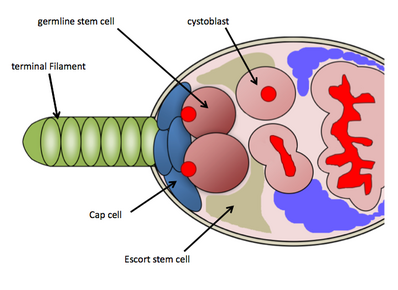
Ниша GSC в дрозофилы яичниках
[ редактировать ]У Drosophila melanogaster ниша GSC расположена в самой передней области каждой овариолы , известной как гермарий. Ниша GSC состоит из необходимых соматических клеток: концевых филаментных клеток, кэп-клеток, эскортных клеток и других стволовых клеток, которые функционируют для поддержания GSC. [9] Ниша ГСК содержит в среднем 2–3 ГСК, которые непосредственно прикреплены к соматическим кэп-клеткам, и стволовым клеткам-эскортам, которые посылают сигналы поддержания непосредственно ГСК. [10] ГСК легко идентифицировать посредством гистологического окрашивания против белка vasa (для идентификации половых клеток) и белка 1B1 (для определения клеточных структур и специфичной для зародышевой линии структуры слияния ). Их физическое прикрепление к колпачковым клеткам необходимо для их поддержания и активности. [10] GSC будет делиться асимметрично, образуя один дочерний цистобласт, который затем подвергается 4 раундам неполного митоза по мере продвижения вниз по овариоле (в процессе оогенеза ), в конечном итоге образуя зрелую яйцеклетку; Фусома, обнаруженная в GSCs, участвует в формировании кист и может регулировать асимметричные клеточные деления GSCs. [11] Благодаря обилию генетических инструментов, доступных для использования у Drosophila melanogaster , и простоте обнаружения GSC с помощью гистологического окрашивания, исследователи открыли несколько молекулярных путей, контролирующих поддержание и активность GSC. [12] [13]
Молекулярные механизмы поддержания и активности GSC
[ редактировать ]Местные сигналы
[ редактировать ]Лиганды костного морфогенетического белка (BMP) декапентаплегический (Dpp) и лиганд «лодочки со стеклянным дном» (Gbb) напрямую передаются в GSC и необходимы для поддержания и самообновления GSC. [14] Передача сигналов BMP в нише напрямую подавляет экспрессию Bag-of-Marbles ( Bam ) в GSCs, которая усиливается в развивающихся клетках цистобластов. [15] Потеря функции dpp в нише приводит к дерепрессии Bam в GSCs, что приводит к быстрой дифференцировке GSCs. [10] Наряду с передачей сигналов BMP, cap-клетки также передают сигналы GSCs другим молекулам: Yb и Piwi . Обе эти молекулы неавтономно необходимы GSCs для пролиферации; piwi также необходим автономно GSCs для пролиферации. [16] В гермарии передача сигналов BMP имеет эффект ближнего действия, поэтому физическое прикрепление GSCs к cap-клеткам важно для поддержания и активности. [ нужна ссылка ]
Физическое прикрепление ГСК к кэп-клеткам
[ редактировать ]GSCs физически прикреплены к клеткам кэпа (DE-кадгерина) дрозофилы с помощью адгезионных соединений E-кадгерина , и если это физическое прикрепление потеряно, GSC дифференцируются и теряют свою идентичность как стволовые клетки. [10] Ген, кодирующий DE-кадгерин, дробовик ( shg ), и ген, кодирующий ортолог бета-катенина, броненосец , контролируют эту физическую привязанность. [17] Молекула ГТФазы rab11 участвует в клеточном транспорте DE-кадгеринов. Нокаут rab11 в GSC приводит к отслоению GSC от cap-клеток и преждевременной дифференцировке GSC. [18] Кроме того, нулевой рост популяции ( zpg ), кодирующий щелевое соединение , специфичное для зародышевой линии. для дифференцировки зародышевых клеток необходим [19]
Системные сигналы, регулирующие GSC
[ редактировать ]И диета, и инсулиноподобная передача сигналов напрямую контролируют пролиферацию GSC у Drosophila melanogaster . Повышение уровня дрозофилы (DILP) с помощью диеты приводит к усилению пролиферации GSC. инсулиноподобного пептида [20] Повышение регуляции DILP в старых GSC и их нишах приводит к усилению поддержания и пролиферации. [21] Также было показано, что DILP регулируют количество кэп-клеток и регулируют физическое прикрепление GSC к кэп-клеткам. [21]
Механизмы обновления
[ редактировать ]Существует два возможных механизма обновления стволовых клеток: симметричное деление GSC или дедифференцировка цистобластов. Обычно GSC делятся асимметрично с образованием одного дочернего цистобласта, но было высказано предположение, что симметричное деление может привести к тому, что две дочерние клетки останутся GSC. [22] [23] Если GSC удаляются с образованием пустой ниши, а кэп-клетки все еще присутствуют и посылают сигналы поддержания, дифференцированные цистобласты могут быть рекрутированы в нишу и дедифференцироваться в функциональные GSC. [24]
Старение стволовых клеток
[ редактировать ]По мере старения самок дрозофилы ниша стволовых клеток подвергается возрастной потере присутствия и активности GSC. Считается, что эти потери частично вызваны деградацией важных сигнальных факторов из ниши, которая поддерживает GSCs и их активность. Прогрессирующее снижение активности ГСК способствует наблюдаемому снижению плодовитости Drosophila melanogaster в пожилом возрасте; это снижение активности GSC можно частично объяснить снижением активности сигнального пути в нише GSC. [25] [26] Было обнаружено, что с возрастом происходит снижение передачи сигналов Dpp и Gbb. Помимо снижения активности сигнального пути ниши, GSCs стареют клеточно-автономно. Помимо изучения снижения сигналов, поступающих из ниши, GSC стареют по своей сути; наблюдается зависящее от возраста снижение адгезии GSC к клеткам покрышки и накопление активных форм кислорода (АФК), что приводит к повреждению клеток, что способствует старению GSC. Наблюдается уменьшение количества кэп-клеток и физического прикрепления ГСК к кэп-клеткам в результате старения. Shg экспрессируется на значительно более низких уровнях в старой нише GSC по сравнению с молодой. [26]
Ниша GSC в дрозофилы семенниках
[ редактировать ]У самцов Drosophila melanogaster есть по два семенника — длинных, трубчатых, спиральных структур — и на переднем конце каждого из них находится ниша GSC. Ниша GSC яичка построена вокруг популяции немитотических узловых клеток (также известных как нишевые клетки), к которым прикрепляются две популяции стволовых клеток: GSC и соматические стволовые клетки (SSC, также известные как стволовые клетки соматической кисты/стволовые клетки кисты). . Каждый GSC окружен парой SSC, хотя каждый тип стволовых клеток все еще находится в контакте с клетками-концентраторами. Таким образом, ниша стволовых клеток состоит из этих трех типов клеток, поскольку не только центральные клетки регулируют поведение GSC и SSC, но и стволовые клетки также регулируют активность друг друга. Ниша GSC семенников Drosophila оказалась ценной модельной системой для изучения широкого спектра клеточных процессов и сигнальных путей. [27]
За пределами ниши GSC яичка
[ редактировать ]Процесс сперматогенеза начинается, когда GSCs делятся асимметрично, образуя GSC, который поддерживает контакт с центром, и гониобласт, который выходит из ниши. SSC делятся со своим партнером GSC, и их немитотическое потомство, соматические клетки кисты (SCC, также известные как клетки кисты), будут окружать гониалбласт. Затем гониобласт подвергается четырем раундам синхронных транзитно-амплификационных делений с неполным цитокинезом, в результате чего образуется шестнадцатиклеточная сперматогониальная киста. Эта сперматогониальная киста затем дифференцируется и превращается в сперматоцит, который в конечном итоге подвергается мейозу и производит сперму. [27]
Молекулярная передача сигналов в нише GSC семенника
[ редактировать ]Двумя основными молекулярными сигнальными путями, регулирующими поведение стволовых клеток в нише GSC семенников, являются сигнальные пути Jak-STAT и BMP. Передача сигналов Jak-STAT происходит в хаб-клетках, где лиганд Upd секретируется в GSC и SSC. [28] [29] Это приводит к активации дрозофилы , который влияет на адгезию GSC к хаб-клеткам. STAT, Stat92E, транскрипционного фактора [30] и самообновление SSC через Zfh-1. [31] Передача сигналов Jak-STAT также влияет на активацию передачи сигналов BMP через лиганды Dpp и Gbb. Эти лиганды секретируются в GSC из SSC и клеток-концентраторов, активируют передачу сигналов BMP и подавляют экспрессию Bam, фактора дифференцировки. [32] За пределами ниши гониобласты больше не получают лиганды BMP и могут начать свою программу дифференциации. Другие важные сигнальные пути включают MAPK и Hedgehog, которые регулируют ограждение зародышевой линии. [33] и самообновление соматических клеток, [34] соответственно.
Ниша GSC в семенниках мышей
[ редактировать ]Ниша GSC мыши у самцов, также называемая нишей сперматогониальных стволовых клеток (SSC), расположена в базальной области семенных канальцев в семенниках. Семенной эпителий состоит из клеток Сертоли, которые контактируют с базальной мембраной канальцев, которая отделяет клетки Сертоли от расположенной ниже интерстициальной ткани. Эта интерстициальная ткань включает клетки Лейдига, макрофаги, мезенхимальные клетки, капиллярные сети и нервы. [35]
Во время развития первичные зародышевые клетки мигрируют в семенные канальцы и вниз к базальной мембране, оставаясь при этом прикрепленными к клеткам Сертоли, где они впоследствии дифференцируются в SSC, также называемые одиночными сперматогониями. [35] [36] Эти SSC могут либо самообновляться, либо дифференцироваться в сперматозоиды при пролиферации Asingle в Apaired сперматогонии. Две клетки аппарных сперматогоний остаются прикрепленными межклеточными мостиками и впоследствии делятся на A-выровненные сперматогонии, которые состоят из 4–16 связанных клеток. Затем выровненные сперматогонии подвергаются мейозу I с образованием сперматоцитов и мейозу II с образованием сперматид, которые созревают в сперматозоиды. [37] [38] Эта дифференцировка происходит вдоль продольной оси клеток Сертоли, от базальной мембраны до апикального просвета семенных канальцев. Однако клетки Сертоли образуют плотные соединения, которые отделяют SSC и сперматогонии, контактирующие с базальной мембраной, от сперматоцитов и сперматид, создавая базальный и адлюминальный компартменты, посредством чего дифференцирующиеся сперматоциты должны пересекать плотные соединения. [35] [39] Эти плотные соединения образуют гемато-семенниковый барьер (BTB) и, как предполагается, играют роль в изоляции дифференцированных клеток в адлюминальном компартменте от факторов, секретируемых интерстициальной тканью и сосудистой сетью, соседствующей с базальным компартментом. [35]
Молекулярные механизмы поддержания и активности SSC
[ редактировать ]Физические сигналы
[ редактировать ]Базальная мембрана семенных канальцев представляет собой модифицированную форму внеклеточного матрикса, состоящего из фибронектина, коллагенов и ламинина. [35] β1-интегрин экспрессируется на поверхности SSC и участвует в их адгезии к ламининовому компоненту базальной мембраны, хотя другие молекулы адгезии, вероятно, также участвуют в прикреплении SSC к базальной мембране. [40] Было показано, что экспрессия E-кадгерина на SSC у мышей, в отличие от Drosophila , необязательна, поскольку трансплантация культивируемых SSC, лишенных E-кадгерина, способна колонизировать семенные канальцы хозяина и подвергаться сперматогенезу. [41] Кроме того, барьер гемато-яичка обеспечивает архитектурную поддержку и состоит из компонентов плотного соединения, таких как окклюдины, клаудины и окклюденсные зоны (ZO), которые демонстрируют динамическую экспрессию во время сперматогенеза. [42] Например, было показано, что клаудин 11 является необходимым компонентом этих плотных контактов, поскольку мыши, лишенные этого гена, имеют дефектный барьер гемато-семенников и не производят зрелые сперматозоиды. [40]
Молекулярные сигналы, регулирующие обновление SSC
[ редактировать ]Известно, что GDNF (нейротрофический фактор глиального происхождения) стимулирует самообновление SSC и секретируется клетками Сертоли под влиянием гонадотропина ФСГ. GDNF является родственным членом суперсемейства факторов роста TGFβ, и при его сверхэкспрессии у мышей наблюдалось увеличение количества недифференцированных сперматогониев, что приводило к образованию зародышевых опухолей. [35] [40] В подтверждение его роли как фактора обновления у гетерозиготных мышей-самцов, нокаутных по GDNF, наблюдается снижение сперматогенеза, что в конечном итоге приводит к бесплодию. [40] Кроме того, было показано, что добавление GDNF увеличивает экспансию мышиных SSC в культуре. Однако рецептор GDNF c-RET и корецептор GFRa1 экспрессируются не только на SSC, но также на Apaired и Aaligned, что показывает, что GDNF является фактором обновления для Asingle до Aaligned в целом, а не специфичен для популяции Asingle SSC. . Также было показано, что FGF2 (фактор роста фибробластов -2), секретируемый клетками Сертоли, влияет на обновление SSC и недифференцированных сперматогониев аналогично GDNF. [35]
Хотя клетки Сертоли, по-видимому, играют важную роль в обновлении, они экспрессируют рецепторы тестостерона, который секретируется клетками Лейдига, тогда как зародышевые клетки не содержат этот рецептор, что указывает на важную роль вышестоящих клеток Лейдига в обеспечении обновления. Клетки Лейдига также продуцируют CSF 1 (колониестимулирующий фактор -1), для которого SSC сильно экспрессируют рецептор CSF1R. [37] Когда CSF 1 добавляли в культуру с GDNF и FGF2, дальнейшего увеличения пролиферации не наблюдалось, однако, чем дольше зародышевые клетки оставались в культуре с CSF-1, тем большую плотность SSC наблюдали, когда эти зародышевые клетки трансплантировали в семенные канальцы хозяина. Это показало, что CSF 1 является специфическим фактором обновления, который склоняет SSC к обновлению, а не к дифференцировке, а не влияет на пролиферацию SSC и сперматогониев. Также было показано, что GDNF, FGF 2 и CSF 1 влияют на самообновление стволовых клеток в других тканях млекопитающих. [35]
Plzf (цинковый палец промиелоцитарной лейкемии) также участвует в регуляции самообновления SSC и экспрессируется сперматогониями Asingle, Apaired и Aaligned. Plzf напрямую ингибирует транскрипцию рецептора c-kit в этих ранних сперматогониях. Однако его отсутствие в поздних сперматогониях делает возможным экспрессию c-kit, которая впоследствии активируется его лигандом SCF (фактором стволовых клеток), секретируемым клетками Сертоли, что приводит к дальнейшей дифференцировке. Кроме того, было показано, что добавление BMP4 и активина-A снижает самообновление SSC в культуре и увеличивает дифференцировку стволовых клеток, при этом BMP4 увеличивает экспрессию c-kit. [37]
Старение ниши SSC
[ редактировать ]Длительный сперматогенез зависит от поддержания SSC, однако это поддержание снижается с возрастом и приводит к бесплодию. У мышей в возрасте от 12 до 14 месяцев наблюдается снижение массы семенников, снижение сперматогенеза и содержания SSC. Хотя считается, что стволовые клетки обладают потенциалом к бесконечному размножению in vitro, факторы, обеспечиваемые нишей, имеют решающее значение in vivo. Действительно, серийная трансплантация SSC от мышей-самцов разного возраста молодым мышам в возрасте 3 месяцев, у которых эндогенный сперматогенез был удален, использовалась для оценки содержания стволовых клеток, учитывая, что каждая стволовая клетка будет генерировать колонию сперматогенеза. [35] [43] Результаты этого эксперимента показали, что трансплантированные SSC могут сохраняться намного дольше, чем их репликативная продолжительность жизни для их возраста. Кроме того, исследование также показало, что SSC от молодых фертильных мышей не могут сохраняться и не подвергаются сперматогенезу при трансплантации в семенники старых бесплодных мышей. В совокупности эти результаты указывают на ухудшение самой ниши SSC с возрастом, а не на потерю внутренних факторов SSC. [43]
Ниши стволовых клеток взрослых позвоночных
[ редактировать ]Ниша гемопоэтических стволовых клеток
[ редактировать ]позвоночных гемопоэтических стволовых клеток Ниша в костном мозге образована клетками субэндостальных остеобластов, синусоидальными эндотелиальными клетками и стромальными клетками костного мозга (также иногда называемыми ретикулярными) клетками, которые включают смесь фибробластоидных , моноцитарных и адипоцитарных клеток (которые составляют жировую ткань костного мозга ). [1]
Ниша стволовых клеток волосяного фолликула
[ редактировать ]Ниша стволовых клеток волосяного фолликула является одной из наиболее тщательно изученных ниш благодаря ее относительной доступности и роли в таких важных заболеваниях, как меланома . область выпуклости в месте соединения мышцы, поднимающей волосы Было показано, что , с оболочкой волосяного фолликула содержит стволовые клетки кожи, которые могут вносить вклад во все эпителиальные слои кожи. Там клетки поддерживаются посредством передачи сигналов совместно с нишевыми клетками – сигналы включают паракринные (например, sonic hedgehog ), аутокринные и юкстакринные сигналы. [44] Выпуклая область волосяного фолликула использует эти сигналы для поддержания стволовости клеток. Картирование судеб или отслеживание клеточных линий показало, что потомство кератин-15- положительных стволовых клеток участвует во всех эпителиальных линиях. [45] Фолликул подвергается циклической регенерации, при которой эти стволовые клетки мигрируют в различные области и дифференцируются в соответствующий тип эпителиальных клеток. Некоторые важные сигналы в нише стволовых клеток волосяного фолликула, продуцируемые мезенхимальным дермальным сосочком или выпуклостью, включают лиганды BMP, TGF-β и фактора роста фибробластов (FGF) и ингибиторы Wnt. [46] Хотя сигнальные пути Wnt и β-катенин важны для поддержания стволовых клеток, [47] сверхэкспрессия β-катенина в волосяных фолликулах вызывает неправильный рост волос. Следовательно, эти сигналы, такие как ингибиторы Wnt, продуцируемые окружающими клетками, важны для поддержания и облегчения ниши стволовых клеток. [48]
Ниша кишечных стволовых клеток
[ редактировать ]Кишечные органоиды использовались для изучения ниш кишечных стволовых клеток. Культуру кишечных органоидов можно использовать для косвенной оценки воздействия манипуляций на стволовые клетки посредством оценки выживаемости и роста органоидов. Исследования с использованием кишечных органоидов показали, что выживаемость кишечных стволовых клеток улучшается за счет присутствия нейронов и фибробластов. [49] и посредством введения IL-22 . [50]
Ниша сердечно-сосудистых стволовых клеток
[ редактировать ]Ниши сердечно-сосудистых стволовых клеток можно найти в свободной стенке правого желудочка, предсердиях и выносящих путях сердца. Они состоят из Isl1+/Flk1+ сердечных клеток-предшественников (CPC), которые локализованы в дискретных кластерах внутри ColIV и внеклеточного матрикса ламинина (ECM). ColI и фибронектин преимущественно обнаруживаются за пределами кластеров CPC внутри миокарда. Иммуногистохимическое окрашивание использовалось, чтобы продемонстрировать, что дифференцирующиеся CPC, которые мигрируют от кластеров-предшественников в ColI и фибронектин ECM, окружающие нишу, подавляют Isl1 и одновременно повышают уровень зрелых сердечных маркеров, таких как тропонин C. [51] В настоящее время ведутся споры о роли клеток Isl1+ в сердечно-сосудистой системе. В то время как основные публикации идентифицировали эти клетки как CPC и обнаружили очень большое их количество в сердце мыши и человека, недавние публикации обнаружили очень мало клеток Isl1+ в сердце плода мыши и связывают их локализацию с синоатриальным узлом. [52] которая известна как область, которая способствует стимуляции сердца. Роль этих клеток и их ниши находятся в стадии интенсивных исследований и дискуссий. [ нужна ссылка ]
Ниша нервных стволовых клеток
[ редактировать ]Ниши нервных стволовых клеток разделены на две части: субэпендимальную зону (СЭЗ) и субгранулярную зону (СГЗ).
SEZ представляет собой тонкую область под слоем эпендимных клеток, которая содержит три типа нейральных стволовых клеток: редко делящиеся нейральные стволовые клетки (НСК), быстро делящиеся транзитно-амплифицирующие предшественники (TaP) и нейробласты (NB). SEZ Внеклеточный матрикс ( ECM ) имеет существенные различия по составу по сравнению с окружающими тканями. Недавно было описано, что клетки-предшественники, НСК, ТаП и НБ прикрепляются к структурам ЕСМ, называемым фрактонами . [53] Эти структуры богаты протеогликанами ламинином, коллагеном и гепарансульфатом . [54] Другие молекулы ЕСМ, такие как тенасцин-С, ММП и различные протеогликаны, также участвуют в нише нервных стволовых клеток. [55]
Ниша раковых стволовых клеток
[ редактировать ]Раковая ткань морфологически неоднородна не только из-за разнообразия присутствующих типов клеток, эндотелиальных, фибробластов и различных иммунных клеток, но и сами раковые клетки не являются гомогенной популяцией. [ нужна ссылка ]
В соответствии с иерархической моделью опухолей, раковые стволовые клетки (РСК) поддерживаются биохимическими и физическими контекстуальными сигналами, исходящими из микроокружения, называемого нишей раковых стволовых клеток. [56] Ниша РСК очень похожа на нишу нормальных стволовых клеток ( эмбриональных стволовых клеток (ESC), ASC взрослых стволовых клеток) по функциям (поддержание самообновления, недифференцированного состояния и способности к дифференцировке) и сигнальным путям (Activin/Noda, Akt /PTEN, JAK/STAT, PI3-K, TGF-β, Wnt и BMP). [57] Предполагается, что РСК возникают из-за аберрантной передачи сигналов микроокружения и участвуют не только в обеспечении сигналов выживания для РСК, но и в метастазировании путем индукции эпителиально-мезенхимального перехода (ЕМТ). [ нужна ссылка ]
Гипоксия
[ редактировать ]Гипоксическое состояние ниш стволовых клеток (ЭСК, АСК или РСК) необходимо для поддержания стволовых клеток в недифференцированном состоянии, а также для минимизации повреждения ДНК вследствие окисления. Поддержание гипоксического состояния находится под контролем факторов транскрипции, индуцируемых гипоксией (HIF). [58] HIF способствуют прогрессированию опухоли, выживанию клеток и метастазированию путем регуляции генов-мишеней, таких как VEGF, GLUT-1, ADAM-1, Oct4 и Notch. [57]
Гипоксия в нише РСК
[ редактировать ]Гипоксия играет важную роль в регуляции ниш раковых стволовых клеток и ЕМТ посредством продвижения HIF . [59] Эти HIF помогают поддерживать ниши раковых стволовых клеток, регулируя важные стволовости гены , такие как Oct4 , Nanog , SOX2 , Klf4 и cMyc . [60] [61] HIF также регулируют важные гены-супрессоры опухолей, такие как р53 , и гены, способствующие метастазированию . [62] [63] Хотя HIF увеличивают выживаемость клеток за счет уменьшения воздействия окислительного стресса , также было показано, что они уменьшают такие факторы, как RAD51 и H2AX, которые поддерживают стабильность генома. [64] В гипоксическом состоянии происходит увеличение внутриклеточных активных форм кислорода (АФК), которые также способствуют выживанию РСК посредством реакции на стресс. [65] [66] АФК стабилизирует HIF-1α, который способствует образованию протоонкогена Met , который способствует метастазированию или мотогенному бегству в клетках меланомы . [67] Все эти факторы способствуют фенотипу раковых стволовых клеток, поэтому его часто называют нишей гипоксических стволовых клеток. Гипоксическая среда часто встречается в опухолях, где клетки делятся быстрее, чем может произойти ангиогенез . Важно изучать гипоксию как аспект рака, поскольку было показано, что гипоксическая среда устойчива к лучевой терапии . [68] Было показано, что радиация увеличивает количество HIF-1 . [69] Индукция ЕМТ посредством гипоксии посредством взаимодействия между HIF-1α и АФК имеет решающее значение для метастазирования при раке, таком как меланома . Было обнаружено, что многие гены, связанные с меланомой, регулируются гипоксией, такие как MXI1, FN1 и NME1. [70]
Эпителиально-мезенхимальный переход
[ редактировать ]Эпителиально-мезенхимальный переход — морфогенетический процесс, обычно возникающий в эмбриогенезе, который «захватывается» раковыми стволовыми клетками, отрываясь от своего первичного места и мигрируя в другое. За диссеминацией следует обратный переход, так называемый эпителиально-мезенхимальный переход (ЕМТ). Этот процесс регулируется микроокружением РСК посредством тех же сигнальных путей, что и в эмбриогенезе, с использованием факторов роста ( TGF-β , PDGF , EGF), цитокина IL-8 и компонентов внеклеточного матрикса. взаимодействие этих факторов роста через внутриклеточные преобразователи сигналов, такие как β-катенин, индуцирует метастатический потенциал. Было показано, что [71] [72] Характерной чертой ЭМТ является потеря эпителиальных маркеров (Е-кадгерина, цитокератинов, клаудина, окклюзионного, десмоглеина, десмоколина) и увеличение мезенхимальных маркеров (N-кадгерина, виментина, фибронектина). [73]
Существует также определенная степень сходства в хоминг-мобилизации нормальных стволовых клеток и метастазировании раковых стволовых клеток. Важную роль играют матриксные металлопротеиназы (ММП), основные ферменты, разрушающие внеклеточный матрикс, например, матриксные металлопротеиназы-2 и -9 индуцируются к экспрессии и секреции стромальными клетками во время метастазирования рака толстой кишки посредством прямого контакта или паракринной регуляции. Следующей общей молекулой является фактор-1, полученный из стромальных клеток (SDF-1). [73] [74]
Воспаление
[ редактировать ]ЭМП и прогрессирование рака также могут быть спровоцированы хроническим воспалением . Главную роль играют молекулы (IL-6, IL-8, TNF-α, NFκB, TGF-β, HIF-1α), которые могут регулировать оба процесса посредством регуляции последующей передачи сигналов, которая перекрывается между ЕМТ и воспалением. [57] Нижестоящими путями, участвующими в регуляции CSC, являются Wnt, SHH, Notch, TGF-β, RTKs-EGF, FGF, IGF, HGF.
NFκB регулирует EMT, миграцию и инвазию CSC через Slug, Snail и Twist. Активация NFκB приводит не только к увеличению продукции IL-6, TNF-α и SDF-1, но и к доставке факторов роста.
Источником продукции цитокинов являются лимфоциты (TNF-α), мезенхимальные стволовые клетки (SDF-1, IL-6, IL8).
Интерлейкин 6 опосредует активацию STAT3. Высокий уровень STAT3 был описан в изолированных РСК печени, костей, шейки матки и головного мозга. Ингибирование STAT3 приводит к резкому снижению их образования. Обычно IL-6 обеспечивает преимущество выживания локальным стволовым клеткам и, таким образом, облегчает онкогенез. [57]
SDF-1α, секретируемый мезенхимальными стволовыми клетками (МСК), играет важную роль в хоминге и поддержании гемопоэтических стволовых клеток (ГСК) в нише костного мозга, а также в хоминге и диссеминации РСК. [74]
Ангиогенез
[ редактировать ]Гипоксия является основным стимулятором ангиогенеза , при этом HIF-1α является основным медиатором. Ангиогенез, индуцированный гипоксическими состояниями, называется «ангиогенным переключателем». HIF-1 способствует экспрессии нескольких ангиогенных факторов: фактора роста эндотелия сосудов (VEGF), основного фактора роста фибробластов (bFGF), плацентарноподобного фактора роста (PLGF), фактора роста тромбоцитов (PDGF) и эпидермального фактора роста. Но есть доказательства того, что экспрессия ангиогенных агентов раковыми клетками также может быть независимой от HIF-1. Похоже, что белок Ras играет важную роль и что внутриклеточные уровни кальция регулируют экспрессию ангиогенных генов в ответ на гипоксию. [73]
Ангиогенный переключатель подавляет белки-супрессоры ангиогенеза, такие как тромбоспондин, ангиостатин, эндостатин и тумстатин. Ангиогенез необходим для роста первичной опухоли. [ нужна ссылка ]
Травма, вызванная
[ редактировать ]Во время травмы поддерживающие клетки способны активировать программу восстановления, повторяя аспекты развития в области повреждения. Эти области становятся благоприятными для обновления, миграции и дифференцировки стволовых клеток. Например, в ЦНС травма способна активировать программу развития астроцитов, которая позволяет им экспрессировать молекулы, поддерживающие стволовые клетки, такие как хемокины, т.е. SDF-1. [75] и морфогены, такие как sonic hedgehog. [76]
Стратегии имитации внеклеточного матрикса для ниши стволовых клеток
[ редактировать ]Очевидно, что биофизико-химические характеристики ЕСМ, такие как состав, форма, топография, жесткость и механическая прочность, могут контролировать поведение стволовых клеток. Эти факторы ЕСМ одинаково важны при выращивании стволовых клеток in vitro. Учитывая выбор между взаимодействием нишевых клеток и стволовых клеток и взаимодействием ЕСМ со стволовыми клетками, имитация ЕСМ является предпочтительной, поскольку ее можно точно контролировать с помощью методов изготовления каркаса, параметров обработки или модификаций после изготовления. Для имитации важно понимать естественные свойства ЕСМ и их роль в процессах судьбы стволовых клеток. Были проведены различные исследования с участием различных типов каркасов, которые регулируют судьбу стволовых клеток, имитируя свойства ЕСМ. [2] )
Ссылки
[ редактировать ]- ^ Jump up to: а б Бирбрайр А., Френетт П.С. (апрель 2016 г.). «Неоднородность ниш в костном мозге» . Анналы Нью-Йоркской академии наук . 1370 (1): 82–96. Бибкод : 2016NYASA1370...82B . дои : 10.1111/nyas.13016 . ПМЦ 4938003 . ПМИД 27015419 .
- ^ Jump up to: а б с Джала Д. (2015). «Обзор стратегий имитации внеклеточного матрикса для ниши искусственных стволовых клеток». Обзоры полимеров . 55 (4): 561–595. дои : 10.1080/15583724.2015.1040552 . S2CID 94588894 .
- ^ Scadden DT (июнь 2006 г.). «Ниша стволовых клеток как объект действия». Природа . 441 (7097): 1075–1079. Бибкод : 2006Natur.441.1075S . дои : 10.1038/nature04957 . ПМИД 16810242 . S2CID 4418385 .
- ^ Ритсма Л., Элленбрук С.И., Зомер А., Снипперт Х.Дж., де Соваж Ф.Дж., Саймонс Б.Д. и др. (март 2014 г.). «Гомеостаз кишечных крипт, выявленный на уровне отдельных стволовых клеток с помощью живых изображений in vivo» . Природа . 507 (7492): 362–365. Бибкод : 2014Natur.507..362R . дои : 10.1038/nature12972 . ПМЦ 3964820 . ПМИД 24531760 .
- ^ Ромполас П., Меса КР, Греко V (октябрь 2013 г.). «Пространственная организация внутри ниши как детерминант судьбы стволовых клеток» . Природа . 502 (7472): 513–518. Бибкод : 2013Natur.502..513R . дои : 10.1038/nature12602 . ПМЦ 3895444 . ПМИД 24097351 .
- ^ Шахрияри Л., Комарова Н.Л. (июль 2015 г.). «Роль двухкамерной ниши стволовых клеток в замедлении рака». Физическая биология . 12 (5): 055001. Бибкод : 2015PhBio..12e5001S . дои : 10.1088/1478-3975/12/5/055001 . ПМИД 26228740 . S2CID 7171931 .
- ^ Каннатаро В.Л., МакКинли С.А., Сент-Мэри CM (апрель 2016 г.). «Последствия небольших размеров ниш стволовых клеток и распределение фитнес-эффектов новых мутаций при старении и онкогенезе» . Эволюционные приложения . 9 (4): 565–582. Бибкод : 2016EvApp...9..565C . дои : 10.1111/eva.12361 . ПМЦ 4831459 . ПМИД 27099622 .
- ^ Каннатаро В.Л., МакКинли С.А., Сент-Мэри CM (июль 2017 г.). «Эволюционный компромисс между размером ниши стволовых клеток, старением и онкогенезом» . Эволюционные приложения . 10 (6): 590–602. Бибкод : 2017EvApp..10..590C . дои : 10.1111/eva.12476 . ПМК 5469181 . ПМИД 28616066 .
- ^ Ли Л, Се Т (2005). «Ниша стволовых клеток: структура и функции». Ежегодный обзор клеточной биологии и биологии развития . 21 : 605–631. doi : 10.1146/annurev.cellbio.21.012704.131525 . ПМИД 16212509 .
- ^ Jump up to: а б с д Се Т., Spradling AC (октябрь 2000 г.). «Ниша, поддерживающая стволовые клетки зародышевой линии в яичнике дрозофилы». Наука . 290 (5490): 328–330. Бибкод : 2000Sci...290..328X . дои : 10.1126/science.290.5490.328 . ПМИД 11030649 .
- ^ Лин Х., Юэ Л., Спрэдлинг AC (апрель 1994 г.). «Фусома дрозофилы, специфичная для зародышевой линии органелла, содержит мембранные скелетные белки и участвует в формировании кист». Разработка . 120 (4): 947–956. дои : 10.1242/dev.120.4.947 . ПМИД 7600970 .
- ^ Тинг, X., 2013. Контроль самообновления и дифференцировки зародышевых стволовых клеток в яичниках дрозофилы: согласованные действия нишевых сигналов и внутренних факторов. Междисциплинарные обзоры Wiley: биология развития, 2 (2), стр. 261–273.
- ^ Чжан Х. и Цай Ю., 2020. Пути передачи сигнала, регулирующие стволовые клетки зародышевой линии яичников дрозофилы. Современное мнение в науке об насекомых, 37, стр. 1-7.
- ^ Сонг X, Вонг МД, Кавасе Э, Си Р, Дин BC, Маккарти Джей Джей, Се Т (март 2004 г.). «Сигналы Bmp из нишевых клеток напрямую подавляют транскрипцию гена, способствующего дифференцировке, в стволовых клетках зародышевой линии яичника дрозофилы» . Разработка . 131 (6): 1353–1364. дои : 10.1242/dev.01026 . ПМИД 14973291 .
- ^ Чен Д., Маккирин Д. (октябрь 2003 г.). «Передача сигналов Dpp непосредственно подавляет транскрипцию bam, чтобы установить асимметричные деления стволовых клеток зародышевой линии» . Современная биология . 13 (20): 1786–1791. Бибкод : 2003CBio...13.1786C . дои : 10.1016/j.cub.2003.09.033 . ПМИД 14561403 .
- ^ Кокс Д.Н., Чао А., Лин Х. (февраль 2000 г.). «piwi кодирует нуклеоплазматический фактор, активность которого модулирует количество и скорость деления стволовых клеток зародышевой линии». Разработка . 127 (3): 503–514. дои : 10.1242/dev.127.3.503 . ПМИД 10631171 .
- ^ Сун X, Чжу Ч, Доан С, Се Т (июнь 2002 г.). «Стволовые клетки зародышевой линии, закрепленные адгезионными соединениями в нишах яичников дрозофилы». Наука . 296 (5574): 1855–1857. Бибкод : 2002Sci...296.1855S . дои : 10.1126/science.1069871 . ПМИД 12052957 . S2CID 25830121 .
- ^ Богард Н., Лан Л., Сюй Дж., Коэн Р.С. (октябрь 2007 г.). «Rab11 поддерживает связи между стволовыми клетками зародышевой линии и клетками ниши яичника дрозофилы» . Разработка . 134 (19): 3413–3418. дои : 10.1242/dev.008466 . ПМИД 17715175 .
- ^ Гильбоа Л., Форбс А., Тазуке С.И., Фуллер М.Т., Леманн Р. (декабрь 2003 г.). «Дифференцировка стволовых клеток зародышевой линии у дрозофилы требует наличия щелевых соединений и протекает через промежуточное состояние» . Разработка . 130 (26): 6625–6634. дои : 10.1242/dev.00853 . PMID 14660550 .
- ^ Драммонд-Барбоса Д. , Спрэдлинг AC (март 2001 г.). «Стволовые клетки и их потомство реагируют на изменения питания во время оогенеза дрозофилы» . Биология развития . 231 (1): 265–278. дои : 10.1006/dbio.2000.0135 . ПМИД 11180967 .
- ^ Jump up to: а б Сюй Х.Дж., Драммонд-Барбоса Д. (январь 2009 г.). «Уровни инсулина контролируют сохранение женских зародышевых стволовых клеток через нишу дрозофилы» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (4): 1117–1121. Бибкод : 2009PNAS..106.1117H . дои : 10.1073/pnas.0809144106 . ПМЦ 2633547 . ПМИД 19136634 .
- ^ Марголис Дж., Спрэдлинг А. (ноябрь 1995 г.). «Идентификация и поведение эпителиальных стволовых клеток в яичнике дрозофилы». Разработка . 121 (11): 3797–3807. дои : 10.1242/dev.121.11.3797 . ПМИД 8582289 .
- ^ Се Т., Spradling AC (июль 1998 г.). «Декапентаплегия необходима для поддержания и деления зародышевых стволовых клеток в яичниках дрозофилы» . Клетка . 94 (2): 251–260. дои : 10.1016/s0092-8674(00)81424-5 . ПМИД 9695953 .
- ^ Кай Т., Спрэдлинг А. (апрель 2003 г.). «Пустая ниша стволовых клеток дрозофилы реактивирует пролиферацию эктопических клеток» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (8): 4633–4638. Бибкод : 2003PNAS..100.4633K . дои : 10.1073/pnas.0830856100 . ПМК 153607 . ПМИД 12676994 .
- ^ Чжао Р., Сюань Ю, Ли Х, Си Р (июнь 2008 г.). «Возрастные изменения активности стволовых клеток зародышевой линии, сигнальной активности ниши и производства яиц у дрозофилы» . Стареющая клетка . 7 (3): 344–354. дои : 10.1111/j.1474-9726.2008.00379.x . ПМИД 18267001 .
- ^ Jump up to: а б Пан Л., Чен С., Венг С., Колл Г., Чжу Д., Тан Х. и др. (октябрь 2007 г.). «Старение стволовых клеток контролируется как внутренне, так и внешне в яичнике дрозофилы» . Клеточная стволовая клетка . 1 (4): 458–469. дои : 10.1016/j.stem.2007.09.010 . ПМИД 18371381 .
- ^ Jump up to: а б Ла Марка Дж. Э., Somers WG (2014). « Гонады дрозофилы : модели пролиферации, самообновления и дифференцировки стволовых клеток» . АИМС Генетика . 1 (1): 55–80. дои : 10.3934/genet.2014.1.55 .
- ^ Кигер А.А., Джонс Д.Л., Шульц С., Роджерс М.Б., Фуллер М.Т. (декабрь 2001 г.). «Самообновление стволовых клеток, определяемое активацией JAK-STAT в ответ на сигнал поддерживающей клетки». Наука . 294 (5551): 2542–2545. Бибкод : 2001Sci...294.2542K . дои : 10.1126/science.1066707 . ПМИД 11752574 . S2CID 206506814 .
- ^ Тулина Н., Матунис Э. (декабрь 2001 г.). «Контроль самообновления стволовых клеток в сперматогенезе дрозофилы с помощью передачи сигналов JAK-STAT». Наука . 294 (5551): 2546–2549. Бибкод : 2001Sci...294.2546T . дои : 10.1126/science.1066700 . ПМИД 11752575 . S2CID 43266825 .
- ^ Лезерман Дж.Л., Динардо С. (август 2010 г.). «Для самообновления зародышевой линии необходимы стволовые клетки кисты, а стат регулирует адгезию ниш в семенниках дрозофилы» . Природная клеточная биология . 12 (8): 806–811. дои : 10.1038/ncb2086 . ПМЦ 2917891 . ПМИД 20622868 .
- ^ Лезерман Дж.Л., Динардо С. (июль 2008 г.). «Zfh-1 контролирует самообновление соматических стволовых клеток в семенниках дрозофилы и неавтономно влияет на самообновление зародышевых стволовых клеток» . Клеточная стволовая клетка . 3 (1): 44–54. дои : 10.1016/j.stem.2008.05.001 . ПМК 2601693 . ПМИД 18593558 .
- ^ Кавасе Э., Вонг, доктор медицины, Дин BC, Се Т (март 2004 г.). «Передача сигналов Gbb/Bmp необходима для поддержания стволовых клеток зародышевой линии и для подавления транскрипции bam в семенниках дрозофилы» . Разработка . 131 (6): 1365–1375. дои : 10.1242/dev.01025 . ПМИД 14973292 .
- ^ Саркар А., Парих Н., Хирн С.А., Фуллер М.Т., Тазуке С.И., Шульц К. (июль 2007 г.). «Антагонистические роли Rac и Rho в организации микроокружения зародышевых клеток» . Современная биология . 17 (14): 1253–1258. Бибкод : 2007CBio...17.1253S . дои : 10.1016/j.cub.2007.06.048 . ПМИД 17629483 .
- ^ Мишель М., Купинский А.П., Раабе И., Бёкель С. (август 2012 г.). «Передача сигналов Hh необходима для поддержания соматических стволовых клеток в нише семенников дрозофилы» . Разработка . 139 (15): 2663–2669. дои : 10.1242/dev.075242 . ПМИД 22745310 .
- ^ Jump up to: а б с д и ж г час я Оатли Дж. М., Бринстер Р. Л. (апрель 2012 г.). «Единица ниши зародышевых стволовых клеток в семенниках млекопитающих» . Физиологические обзоры . 92 (2): 577–595. doi : 10.1152/physrev.00025.2011 . ПМЦ 3970841 . ПМИД 22535892 .
- ^ Грисволд, доктор медицинских наук, Оатли Дж. М. (январь 2013 г.). «Краткий обзор: Определение характеристик сперматогенных стволовых клеток млекопитающих» . Стволовые клетки . 31 (1): 8–11. дои : 10.1002/stem.1253 . ПМЦ 5312674 . ПМИД 23074087 .
- ^ Jump up to: а б с де Рой Д.Г. (август 2009 г.). «Ниша сперматогониальных стволовых клеток» . Микроскопические исследования и техника . 72 (8): 580–585. дои : 10.1002/jemt.20699 . ПМИД 19263493 .
- ^ Боулз Дж., Купман П. (октябрь 2007 г.). «Ретиноевая кислота, мейоз и судьба зародышевых клеток у млекопитающих» . Разработка . 134 (19): 3401–3411. дои : 10.1242/dev.001107 . ПМИД 17715177 .
- ^ Гесс Р.А., де Франка ЛР (2009). «Сперматогенез и цикл семенного эпителия». В Ченг CY (ред.). Молекулярные механизмы сперматогенеза . Достижения экспериментальной медицины и биологии. Том. 636. С. 1–15 . дои : 10.1007/978-0-387-09597-4_1 . ISBN 978-0-387-09597-4 . ПМИД 19856159 .
- ^ Jump up to: а б с д Канацу-Синохара М., Синохара Т. (2013). «Самообновление и развитие сперматогониальных стволовых клеток». Ежегодный обзор клеточной биологии и биологии развития . 29 : 163–187. doi : 10.1146/annurev-cellbio-101512-122353 . ПМИД 24099084 .
- ^ Ёсида С (2011). «Система ниш стволовых клеток в сперматогенезе мышей». Стволовые клетки мужской зародышевой линии: развивающий и регенеративный потенциал . Том. 2011. стр. 159–175. дои : 10.1007/978-1-61737-973-4_8 . ISBN 978-1-61737-972-7 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Чихара М, Оцука С, Ичи О, Хашимото Ю, Кон Ю (июль 2010 г.). «Молекулярная динамика компонентов гемато-тестикулярного барьера в процессе сперматогенеза мышей». Молекулярное воспроизводство и развитие . 77 (7): 630–639. дои : 10.1002/mrd.21200 . ПМИД 20578065 . S2CID 21630147 .
- ^ Jump up to: а б Рю БАЙ, Орвиг К.Е., Оатли Дж.М., Аварбок М.Р., Бринстер Р.Л. (июнь 2006 г.). «Влияние старения и микроокружения ниш на самообновление сперматогониальных стволовых клеток» . Стволовые клетки . 24 (6): 1505–1511. doi : 10.1634/stemcells.2005-0580 . ПМК 5501308 . ПМИД 16456131 .
- ^ Алони-Гринштейн Р., Шетцер Ю., Кауфман Т., Роттер В. (август 2014 г.). «p53: барьер на пути образования раковых стволовых клеток» . Письма ФЭБС . 588 (16): 2580–2589. Бибкод : 2014FEBSL.588.2580A . дои : 10.1016/j.febslet.2014.02.011 . ПМИД 24560790 .
- ^ Моррис Р.Дж., Лю Ю., Марлес Л., Ян З., Тремпус С., Ли С. и др. (апрель 2004 г.). «Захват и профилирование стволовых клеток взрослого волосяного фолликула». Природная биотехнология . 22 (4): 411–417. дои : 10.1038/nbt950 . ПМИД 15024388 . S2CID 9257482 .
- ^ Ромполас П., Греко V (2014). «Динамика стволовых клеток в нише волосяного фолликула» . Семинары по клеточной биологии и биологии развития . 25–26: 34–42. дои : 10.1016/j.semcdb.2013.12.005 . ПМЦ 3988239 . ПМИД 24361866 .
- ^ Хоссейни В., Калантари-Чарваде А., Хаджикарами М., Файязпур П., Рахбаргази Р., Тотончи М., Дараби М. (октябрь 2021 г.). «Небольшая молекула, модулирующая мононенасыщенные жирные кислоты и передачу сигналов Wnt, обеспечивает поддержание индуцированных плюрипотентных стволовых клеток против энтодермальной дифференцировки» . Исследования и терапия стволовыми клетками . 12 (1): 550. дои : 10.1186/s13287-021-02617-x . ПМЦ 8532309 . ПМИД 34674740 .
- ^ Дешен Э.Р., Мьюнг П., Ромполас П., Зито Дж., Сан Т.И., Такето М.М. и др. (март 2014 г.). «Активация β-катенина регулирует неклеточный рост тканей автономно в нише стволовых клеток волоса» . Наука . 343 (6177): 1353–1356. Бибкод : 2014Sci...343.1353D . дои : 10.1126/science.1248373 . ПМК 4096864 . ПМИД 24653033 .
- ^ Пастула А., Миддельхофф М., Брандтнер А., Тобиаш М., Хёль Б., Нубер А.Х. и др. (2016). «Трехмерная культура желудочно-кишечных органоидов в сочетании с нервами или фибробластами: метод характеристики ниши желудочно-кишечных стволовых клеток» . Стволовые клетки Интернешнл . 2016 : 3710836. doi : 10.1155/2016/3710836 . ПМЦ 4677245 . ПМИД 26697073 .
- ^ Линдеманс С., Мертельсманн А., Дудаков Дж.А., Веларди Е., Хуа Г., О'Коннор М. и др. (2014). «Введение IL-22 защищает кишечные стволовые клетки от РТГП» . Биология трансплантации крови и костного мозга . 20 (2): С53–С54. дои : 10.1016/j.bbmt.2013.12.056 .
- ^ Шенке-Лейланд К., Нсаир А., Ван Хандель Б., Анжелис Е., Глюк Дж.М., Воттелер М. и др. (апрель 2011 г.). «Рекапитуляция ниши эмбриональных сердечно-сосудистых клеток-предшественников» . Биоматериалы . 32 (11): 2748–2756. doi : 10.1016/j.bimaterials.2010.12.046 . ПМЦ 3414535 . ПМИД 21257198 .
- ^ Вайнбергер Ф., Меркенс Д., Фридрих Ф.В., Штуббендорф М., Хуа Х., Мюллер Дж.К. и др. (май 2012 г.). «Локализация Islet-1-положительных клеток в здоровом и перенесшем инфаркт сердце взрослой мыши» . Исследование кровообращения . 110 (10): 1303–1310. дои : 10.1161/CIRCRESAHA.111.259630 . ПМК 5559221 . ПМИД 22427341 .
- ^ Ло, Пифу; Моритани, Масаюки; Дессем, Дин (2 июля 2001 г.). «Афферентные пути челюстно-мышечного веретена к двигательному ядру тройничного нерва у крысы» . Журнал сравнительной неврологии . 435 (3): 341–353. дои : 10.1002/cne.1034 . ISSN 0021-9967 . ПМИД 11406816 . S2CID 36398505 .
- ^ Мерсье, Фредерик (2016). «Фрактоны: ниша внеклеточного матрикса, контролирующая судьбу стволовых клеток и активность факторов роста в мозге в норме и при заболеваниях» . Клеточные и молекулярные науки о жизни . 73 (24): 4661–4674. дои : 10.1007/s00018-016-2314-y . ISSN 1420-682X . ПМЦ 11108427 . ПМИД 27475964 . S2CID 28119663 .
- ^ «Микроокружение нервных стволовых клеток | StemBook» . www.stembook.org . Проверено 29 апреля 2022 г.
- ^ ван де Столпе А (2013). «О происхождении и назначении раковых стволовых клеток: концептуальная оценка» . Американский журнал исследований рака . 3 (1): 107–116. ПМЦ 3555199 . ПМИД 23359140 .
- ^ Jump up to: а б с д Кабаркас С.М., Мэтьюз Л.А., Фаррар В.Л. (ноябрь 2011 г.). «Ниша раковых стволовых клеток – куда идет этот район?» . Международный журнал рака . 129 (10): 2315–2327. дои : 10.1002/ijc.26312 . ПМК 6953416 . ПМИД 21792897 .
- ^ Боровски Т., Де Соуза Э., Мело Ф., Вермюлен Л., Медема Ж.П. (февраль 2011 г.). «Ниша раковых стволовых клеток: место, где стоит быть» . Исследования рака . 71 (3): 634–639. дои : 10.1158/0008-5472.CAN-10-3220 . ПМИД 21266356 .
- ^ Пейтч С., Перрин Р., Хилл Р.П., Дубровска А., Курт И. (август 2014 г.). «Гипоксия как биомаркер радиорезистентных раковых стволовых клеток». Международный журнал радиационной биологии . 90 (8): 636–652. дои : 10.3109/09553002.2014.916841 . ПМИД 24844374 . S2CID 25813277 .
- ^ Ковелло К.Л., Келер Дж., Ю.Х., Гордан Дж.Д., Аршам А.М., Ху С.Дж. и др. (март 2006 г.). «HIF-2альфа регулирует Oct-4: влияние гипоксии на функцию стволовых клеток, эмбриональное развитие и рост опухоли» . Гены и развитие . 20 (5): 557–570. дои : 10.1101/gad.1399906 . ПМК 1410808 . ПМИД 16510872 .
- ^ Кейт Б., Саймон MC (май 2007 г.). «Факторы, индуцирующие гипоксию, стволовые клетки и рак» . Клетка . 129 (3): 465–472. дои : 10.1016/j.cell.2007.04.019 . ПМК 3150586 . ПМИД 17482542 .
- ^ Берту Дж.А., Маймундар А.Дж., Гордан Дж.Д., Лам Дж.К., Дитсворт Д., Кейт Б. и др. (август 2009 г.). «Ингибирование HIF2-альфа способствует активности пути p53, гибели опухолевых клеток и реакции на радиацию» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (34): 14391–14396. Бибкод : 2009PNAS..10614391B . дои : 10.1073/pnas.0907357106 . ПМК 2726037 . ПМИД 19706526 .
- ^ Лю Л., Чжу XD, Ван WQ, Шен Ю, Цинь Ю, Жэнь ЗГ и др. (май 2010 г.). «Активация бета-катенина гипоксией при гепатоцеллюлярной карциноме способствует усилению метастатического потенциала и плохому прогнозу» . Клинические исследования рака . 16 (10): 2740–2750. дои : 10.1158/1078-0432.CCR-09-2610 . ПМИД 20460486 .
- ^ Биндра Р.С., Шаффер П.Дж., Мэн А., Ву Дж., Мосейде К., Рот М.Э. и др. (октябрь 2004 г.). «Снижение уровня регуляции Rad51 и снижение гомологичной рекомбинации в гипоксических раковых клетках» . Молекулярная и клеточная биология . 24 (19): 8504–8518. дои : 10.1128/MCB.24.19.8504-8518.2004 . ПМК 516750 . ПМИД 15367671 .
- ^ Сингх С., Брокер С., Коппака В., Чен Ю., Джексон BC, Мацумото А. и др. (март 2013 г.). «Альдегиддегидрогеназы в клеточных реакциях на окислительный/электрофильный стресс» . Свободно-радикальная биология и медицина . 56 : 89–101. doi : 10.1016/j.freeradbiomed.2012.11.010 . ПМЦ 3631350 . ПМИД 23195683 .
- ^ Дин М., Чо Р.В., Лобо Н.А., Калиски Т., Дори М.Дж., Кулп А.Н. и др. (апрель 2009 г.). «Связь уровней активных форм кислорода и радиорезистентности раковых стволовых клеток» . Природа . 458 (7239): 780–783. Бибкод : 2009Natur.458..780D . дои : 10.1038/nature07733 . ПМЦ 2778612 . ПМИД 19194462 .
- ^ Комито Дж., Кальвани М., Джаннони Э., Бьянкини Ф., Калорини Л., Торре Э. и др. (август 2011 г.). «Стабилизация HIF-1α с помощью митохондриальных АФК способствует Met-зависимому инвазивному росту и васкулогенной мимикрии в клетках меланомы». Свободно-радикальная биология и медицина . 51 (4): 893–904. doi : 10.1016/j.freeradbiomed.2011.05.042 . hdl : 2158/496457 . ПМИД 21703345 .
- ^ Браун Дж. М. (2007). «Опухолевая гипоксия в терапии рака». Кислородная биология и гипоксия . Методы энзимологии. Том. 435. стр. 297–321. дои : 10.1016/S0076-6879(07)35015-5 . ISBN 9780123739704 . ПМИД 17998060 .
- ^ Мёллер Б.Дж., Цао Ю., Ли С.И., Дьюхерст М.В. (май 2004 г.). «Радиация активирует HIF-1 для регулирования сосудистой радиочувствительности в опухолях: роль реоксигенации, свободных радикалов и стрессовых гранул» . Раковая клетка . 5 (5): 429–441. дои : 10.1016/s1535-6108(04)00115-1 . ПМИД 15144951 .
- ^ Олбрит М, Хабрика А, Тышкевич Т, Русин А, Чихонь Т, Ярзоб М, Кравчик З (октябрь 2011 г.). «Связанные с меланомой гены, MXI1, FN1 и NME1, чувствительны к гипоксии в клетках меланомы мыши и человека». Исследования меланомы . 21 (5): 417–425. дои : 10.1097/CMR.0b013e328348db2f . ПМИД 21912348 . S2CID 33171556 .
- ^ Мустакас А., Хелдин CH (октябрь 2007 г.). «Сигнальные сети, управляющие эпителиально-мезенхимальными переходами во время эмбриогенеза и прогрессирования рака» . Раковая наука . 98 (10): 1512–1520. дои : 10.1111/j.1349-7006.2007.00550.x . ПМЦ 11158989 . ПМИД 17645776 . S2CID 23032956 .
- ^ Чжоу Б., Лю Ю., Кан М., Энн Д.К., Хан А., Ван Х. и др. (март 2012 г.). «Взаимодействия между β-катенином и сигнальными путями трансформирующего фактора роста-β опосредуют эпителиально-мезенхимальный переход и зависят от белка, связывающего элемент-связывающий элемент ответа на транскрипционный коактиватор цАМФ (CREB) (CBP)» . Журнал биологической химии . 287 (10): 7026–7038. дои : 10.1074/jbc.M111.276311 . ПМЦ 3293544 . ПМИД 22241478 .
- ^ Jump up to: а б с Подагра С., Хуот Дж. (декабрь 2008 г.). «Роль микроокружения рака в метастазировании: фокус на раке толстой кишки» . Микроокружение рака . 1 (1): 69–83. дои : 10.1007/s12307-008-0007-2 . ПМЦ 2654352 . ПМИД 19308686 .
- ^ Jump up to: а б Ли Л., Нивз В.Б. (май 2006 г.). «Нормальные стволовые клетки и раковые стволовые клетки: ниша имеет значение» . Исследования рака . 66 (9): 4553–4557. дои : 10.1158/0008-5472.CAN-05-3986 . ПМИД 16651403 .
- ^ Имитола Дж., Раддасси К., Парк К.И., Мюллер Ф.Дж., Ньето М., Тенг Ю.Д. и др. (декабрь 2004 г.). «Направленная миграция нейральных стволовых клеток к местам повреждения ЦНС с помощью пути стромального фактора 1альфа/CXC хемокинового рецептора 4» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (52): 18117–18122. Бибкод : 2004PNAS..10118117I . дои : 10.1073/pnas.0408258102 . ПМК 536055 . ПМИД 15608062 .
- ^ Ван И, Имитола Дж., Расмуссен С., О'Коннор К.С., Хури С.Дж. (октябрь 2008 г.). «Парадоксальное нарушение регуляции пути нервных стволовых клеток sonic hedgehog-Gli1 при аутоиммунном энцефаломиелите и рассеянном склерозе» . Анналы неврологии . 64 (4): 417–427. дои : 10.1002/ana.21457 . ПМК 2757750 . ПМИД 18991353 .
- ^ Вишвакарма А (01 апреля 2017 г.). Биология и инженерия ниш стволовых клеток . Академическое издательство, 2017. ISBN. 9780128027561 .