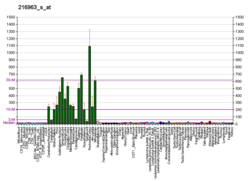
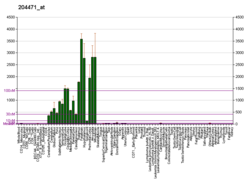
Белок Gap-43
| ГАП43 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | GAP43 , B-50, PP46, рост-ассоциированный белок 43, GAP-43 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 162060 ; МГИ : 95639 ; Гомологен : 1545 ; Генные карты : GAP43 ; ОМА : GAP43 — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Связанный с ростом белок 43 ( GAP43 ) представляет собой белок, кодируемый GAP43. геном [ 5 ] у людей.
GAP43 называют белком «роста» или «пластичности», поскольку он экспрессируется на высоких уровнях в конусах роста нейронов во время развития. [ 6 ] и регенерация аксонов, и он фосфорилируется после длительной потенциации и после обучения. [ нужна ссылка ]
GAP43 является важнейшим компонентом аксона и пресинаптического окончания. Его нулевая мутация приводит к смерти в течение нескольких дней после рождения из-за дефектов поиска путей аксонов. [ 7 ]
Синонимы
[ редактировать ]GAP43 также называют:
- белок F1
- нейромодулин
- нервный фосфопротеин B-50
- белок аксональной мембраны GAP-43
- кальмодулинсвязывающий белок P-57
- пептид GAP43, связанный с ростом нервов
- белок 43, связанный с ростом нейронов
Функция
[ редактировать ]GAP43 представляет собой специфичный для нервной ткани цитоплазматический белок, который может быть прикреплен к мембране посредством двойной пальмитоилирования последовательности цистеинов 3 и 4. Эта последовательность нацеливает GAP43 на липидные рафты . Это основной субстрат протеинкиназы C ( PKC ), который, как полагают, играет ключевую роль в нейритов . формировании, регенерации и пластичности [ 8 ] [ 9 ] Роль GAP-43 в развитии ЦНС не ограничивается воздействием на аксоны: он также является компонентом центросомы , а дифференцирующиеся нейроны, которые не экспрессируют GAP-43, демонстрируют неправильную локализацию центросомы и митотических веретен , особенно при нейрогенных клеточных делениях. . Как следствие, в мозжечке пул предшественников нейронов не может нормально расширяться, и мозжечок становится значительно меньше. [ 10 ]
Несколько разных лабораторий, изучающих один и тот же белок, который теперь называется GAP43, первоначально использовали разные названия. Он получил обозначение F1, затем B-50, затем GAP43, pp46 и, наконец, нейромодулин, причем каждое название отражало разные функции одной и той же молекулы. [ 11 ] F1 был локализован в синапсах, и его фосфорилирование увеличивалось через день после обучения. Однако F1 не был зависим от киназы цАМФ. B-50 регулируется пептидом гипофиза АКТГ и связан с ухаживающим поведением. В случае GAP-43 он был обозначен как белок, связанный с ростом, поскольку его синтез активируется во время регенерации аксонов. Pp46 был сконцентрирован в конусах роста нейронов и, таким образом, предполагалось, что он играет важную роль в развитии мозга. В случае нейромодулина было показано, что он активно связывает кальмодулин .
GAP43, консенсусный выбор для его обозначения, [ 11 ] представляет собой специфичный для нервной системы белок, который прикрепляется к мембране посредством двойной последовательности пальмитоилирования на цистеинах 3 и 4, хотя он может существовать в несвязанной форме в цитоплазме . Эта двойная последовательность позволяет связывать фосфатидилинозитол-4,5-бисфосфат [PI(4,5)P2] или PIP2 с актином , способствуя полимеризации последнего, тем самым регулируя структуру нейронов. Это может происходить внутри липидного рафта, чтобы компартментализировать и локализовать подвижность филоподий в конусах роста в развивающемся мозге, а также может ремоделировать пресинаптические терминали у взрослых в зависимости от активности. GAP-43 также является субстратом протеинкиназы C (PKC). Фосфорилирование серина-41 на GAP-43 с помощью PKC регулирует образование, регенерацию и синаптическую пластичность нейритов. [ 8 ]
Из-за ассоциации и потенциального связывания GAP43 с рядом различных молекул, включая PKC, PIP2 , актин , кальмодулин , спектрин , пальмитат, синаптофизин , амилоид и тау-белок , может быть полезно рассматривать GAP43 как адаптерный белок, расположенный внутри терминал в супрамолекулярном комплексе, регулирующий пресинаптические терминальные функции, в частности двунаправленную связь с постсинаптическим процессом. Его важная роль в памяти и хранении информации осуществляется посредством клеточных биологических механизмов фосфорилирования, пальмитоилирования , белок-белкового взаимодействия и структурного ремоделирования посредством полимеризации актина .
Клиническое значение
[ редактировать ]Люди с делецией одного аллеля гена GAP43 не способны образовывать телеэнцефальные спайки и являются умственно отсталыми. [ 12 ] [ 13 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000172020 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000047261 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Косик К.С., Ореккио Л.Д., Брунс Г.А., Беновиц Л.И., Макдональд Г.П., Кокс Д.Р., Неве Р.Л. (апрель 1988 г.). «Человеческий GAP-43: его установленная аминокислотная последовательность и хромосомная локализация у мыши и человека». Нейрон . 1 (2): 127–32. дои : 10.1016/0896-6273(88)90196-1 . ПМИД 3272162 . S2CID 12067138 .
- ^ Ссылки внутри: Росскотен-Куль Н., Иллинг Р.Б. (2014). «Модуляция транскрипции Gap43 во взрослом мозге зависит от сенсорной активности и синаптического сотрудничества» . ПЛОС ОДИН . 9 (3): е92624. Бибкод : 2014PLoSO...992624R . дои : 10.1371/journal.pone.0092624 . ПМК 3960265 . ПМИД 24647228 .
- ^ «Ген Энтрез: белок 43, связанный с ростом GAP43» .
- ^ Jump up to: а б Беновиц Л.И., Руттенберг А. (февраль 1997 г.). «GAP-43: внутренний детерминант развития и пластичности нейронов». Тенденции в нейронауках . 20 (2): 84–91. дои : 10.1016/S0166-2236(96)10072-2 . ПМИД 9023877 . S2CID 35082372 .
- ^ Аартс Л.Х., Шотман П., Верхааген Дж., Шрама Л.Х., Гиспен В.Х. (1998). «Роль белка B-50/Gap-43, связанного с ростом нейронов, в морфогенезе». Молекулярные и клеточные механизмы нейрональной пластичности . Достижения экспериментальной медицины и биологии. Том. 446. стр. 85–106. дои : 10.1007/978-1-4615-4869-0_6 . ISBN 978-1-4613-7209-7 . ПМИД 10079839 .
- ^ Мишра Р., МаниС (2008). «GAP-43 является ключом к контролю митотического веретена и поляризации на основе центросом в нейронах» . Клеточный цикл . 7 (3): 348–357. дои : 10.4161/cc.7.3.5235 . ПМИД 18235238 .
- ^ Jump up to: а б Беновиц Л.И., Руттенберг А. (1987). «Мембранный фосфопротеин, связанный с развитием нейронов, регенерацией аксонов, метаболизмом фосфолипидов и синаптической пластичностью». Тенденции в нейронауках . 10 (12): 527–532. дои : 10.1016/0166-2236(87)90135-4 . S2CID 54322365 .
- ^ Дженуарди М., Кальвьери Ф., Тоцци К., Кослови Р., Нери Дж. (октябрь 1994 г.). «Новый случай интерстициальной делеции хромосомы 3q, del(3q)(q13.12q21.3) с агенезией мозолистого тела». Клиническая дисморфология . 3 (4): 292–6. дои : 10.1097/00019605-199410000-00003 . ПМИД 7894733 . S2CID 38716384 .
- ^ Маки Огилви С, Руни СК, Ходжсон СВ, Берри АС (март 1998 г.). «Удаление проксимальной области хромосомы 3q приводит к вариабельному фенотипу». Клиническая генетика . 53 (3): 220–2. дои : 10.1111/j.1399-0004.1998.tb02681.x . ПМИД 9630079 . S2CID 20499346 .
Дальнейшее чтение
[ редактировать ]- Фантини Ф, Йоханссон О (декабрь 1992 г.). «Экспрессия рост-ассоциированного белка 43 и рецептора фактора роста нервов в коже человека: сравнительное иммуногистохимическое исследование». Журнал исследовательской дерматологии . 99 (6): 734–42. дои : 10.1111/1523-1747.ep12614465 . ПМИД 1281863 .
- Меркен М., Любке У., Вандермерен М., Геуэнс Дж., Острайхер А.Б. (апрель 1992 г.). «Иммуноцитохимическое обнаружение рост-ассоциированного белка B-50 с помощью недавно охарактеризованных моноклональных антител в мозге и мышцах человека». Журнал нейробиологии . 23 (3): 309–21. дои : 10.1002/neu.480230310 . ПМИД 1385623 .
- Спенсер С.А., Шух С.М., Лю В.С., Уиллард М.Б. (май 1992 г.). «GAP-43, белок, связанный с ростом аксонов, фосфорилируется в трех участках в культивируемых нейронах и мозге крысы» . Журнал биологической химии . 267 (13): 9059–64. дои : 10.1016/S0021-9258(19)50388-X . ПМИД 1533624 .
- Апель Э.Д., Личфилд Д.В., Кларк Р.Х., Кребс Э.Г., Шторм Д.Р. (июнь 1991 г.). «Фосфорилирование нейромодулина (GAP-43) казеинкиназой II. Идентификация сайтов фосфорилирования и регуляция кальмодулином» . Журнал биологической химии . 266 (16): 10544–51. дои : 10.1016/S0021-9258(18)99258-6 . ПМИД 1828073 .
- Апель Э.Д., Байфорд М.Ф., Ау Д., Уолш К.А., Шторм Д.Р. (март 1990 г.). «Идентификация сайта фосфорилирования протеинкиназы С в нейромодулине». Биохимия . 29 (9): 2330–5. дои : 10.1021/bi00461a017 . ПМИД 2140056 .
- Косик К.С., Ореккио Л.Д., Брунс Г.А., Беновиц Л.И., Макдональд Г.П., Кокс Д.Р., Неве Р.Л. (апрель 1988 г.). «Человеческий GAP-43: его установленная аминокислотная последовательность и хромосомная локализация у мыши и человека». Нейрон . 1 (2): 127–32. дои : 10.1016/0896-6273(88)90196-1 . ПМИД 3272162 . S2CID 12067138 .
- Нг С.К., де ла Монте С.М., Конбой Г.Л., Карнс Л.Р., Фишман МС (апрель 1988 г.). «Клонирование человеческого GAP-43: ассоциация роста и возобновление ишемии». Нейрон . 1 (2): 133–9. дои : 10.1016/0896-6273(88)90197-3 . ПМИД 3272163 . S2CID 19627547 .
- Ниландер Х.Б., Де Гроен ПК, Эгген Б.Дж., Шрама Л.Х., Гиспен В.Х., Шотман П. (сентябрь 1993 г.). «Структура человеческого гена нервного фосфопротеина B-50 (GAP-43)». Исследования мозга. Молекулярные исследования мозга . 19 (4): 293–302. дои : 10.1016/0169-328X(93)90128-C . hdl : 1874/4067 . ПМИД 8231732 .
- Эрляйн С.А., Паркер П.Дж., Хергет Т. (июль 1996 г.). «Фосфорилирование GAP-43 (рост-ассоциированный белок массой 43 кДа) обычными, новыми и атипичными изотипами семейства генов протеинкиназы C: различия между фосфорилированием олигопептидов и полипептидов» . Биохимический журнал . 317. 317 (1): 219–24. дои : 10.1042/bj3170219 . ПМЦ 1217466 . ПМИД 8694767 .
- Каназир С., Руздиич С., Вукосавич С., Ивкович С., Милошевич А., Зечевич Н., Ракич Л. (май 1996 г.). «Экспрессия мРНК GAP-43 на раннем этапе развития нервной системы человека». Исследования мозга. Молекулярные исследования мозга . 38 (1): 145–55. дои : 10.1016/0169-328X(96)00008-3 . ПМИД 8737678 .
- де Гроен ПК, Эгген Б.Дж., Гиспен В.Х., Шотман П., Шрама Л.Х. (1996). «Клонирование и анализ промотора человеческого гена B-50/GAP-43». Журнал молекулярной нейронауки . 6 (2): 109–19. дои : 10.1007/BF02736770 . ПМИД 8746449 . S2CID 22911100 .
- Чао С., Беновиц Л.И., Крайнц Д., Ирвин Н. (сентябрь 1996 г.). «Использование двухгибридной системы для исследования молекулярных взаимодействий GAP-43». Исследования мозга. Молекулярные исследования мозга . 40 (2): 195–202. дои : 10.1016/0169-328X(96)00049-6 . ПМИД 8872303 .
- Гэмби С., Вааге MC, Аллен Р.Г., Байзер Л. (октябрь 1996 г.). «Анализ роли связывания и секвестрации кальмодулина в функции нейромодулина (GAP-43)» . Журнал биологической химии . 271 (43): 26698–705. дои : 10.1074/jbc.271.43.26698 . ПМИД 8900147 .
- Хойсс Д., Шлёцер-Шрехардт У (июнь 1998 г.). «Субклеточная локализация фосфопротеина В-50 в регенерирующей мышце. Иммуноэлектронно-микроскопическое исследование». Неврологические исследования . 20 (4): 360–4. дои : 10.1080/01616412.1998.11740532 . ПМИД 9618702 .
- Нив Р.Л., Куперсмит Р., Макфи Д.Л., Сантеуфемио С., Пратт К.Г., Мерфи С.Дж., Линн С.Д. (октябрь 1998 г.). «Белок GAP-43, связанный с ростом нейронов, взаимодействует с рабаптином-5 и участвует в эндоцитозе» . Журнал неврологии . 18 (19): 7757–67. doi : 10.1523/JNEUROSCI.18-19-07757.1998 . ПМК 6793001 . ПМИД 9742146 .
- Арни С., Кейлбо С.А., Остермейер А.Г., Браун Д.А. (октябрь 1998 г.). «Ассоциация GAP-43 с мембранами, устойчивыми к детергентам, требует наличия двух пальмитоилированных остатков цистеина» . Журнал биологической химии . 273 (43): 28478–85. дои : 10.1074/jbc.273.43.28478 . ПМИД 9774477 .
- Иствуд С.Л., Харрисон П.Дж. (сентябрь 1998 г.). «Информационная РНК белка-43, связанная с ростом гиппокампа и коры головного мозга, при шизофрении». Нейронаука . 86 (2): 437–48. дои : 10.1016/S0306-4522(98)00040-2 . ПМИД 9881859 . S2CID 41460546 .
- Каргилл М., Альтшулер Д., Ирландия Дж., Склар П., Ардли К., Патил Н., Шоу Н., Лейн Ч.Р., Лим Э.П., Кальянараман Н., Немеш Дж., Зиаугра Л., Фридланд Л., Рольф А., Уоррингтон Дж., Липшуц Р., Дейли Г.К. , Ландер Э.С. (июль 1999 г.). «Характеристика однонуклеотидных полиморфизмов в кодирующих областях генов человека». Природная генетика . 22 (3): 231–8. дои : 10.1038/10290 . ПМИД 10391209 . S2CID 195213008 .
- Ридерер Б.М., Руттенберг А. (август 1999 г.). «Может ли GAP-43 взаимодействовать со спектрином мозга?». Исследования мозга. Молекулярные исследования мозга . 71 (2): 345–8. дои : 10.1016/S0169-328X(99)00179-5 . ПМИД 10521589 .
- Венто П., Сойнила С. (ноябрь 1999 г.). «Количественное сравнение связанного с ростом белка GAP-43, нейрон-специфической енолазы и белкового генного продукта 9.5 в качестве нейрональных маркеров в зрелом кишечнике человека» . Журнал гистохимии и цитохимии . 47 (11): 1405–16. дои : 10.1177/002215549904701107 . ПМИД 10544214 .
Внешние ссылки
[ редактировать ]- Gap-43+белок Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- ihop-net, Рост-ассоциированный белок 43
- NCBI