Тримерный автотранспортерный клей
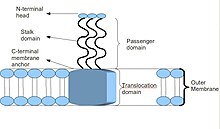
Принципиальная схема базовой структуры тримерного автотранспортера клея.
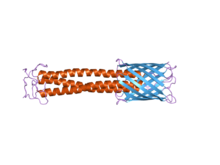
С-концевой мембранный якорный домен отчетливо виден справа синим цветом. Домен стебля можно увидеть красным.
В молекулярной биологии тримерные аутотранспортные адгезины ( ТАА ) представляют собой белки, обнаруженные на мембране грамотрицательных бактерий внешней . Бактерии используют ТАА для заражения хозяев клеток- посредством процесса, называемого клеточной адгезией . [ 1 ] ТАА также имеют другое название — олигомерные спиральные адгезины , которое сокращенно до OCA. По сути, это факторы вирулентности , факторы, которые делают бактерии вредными и заразными для организма хозяина . [ 2 ]
ТАА — лишь один из многих методов, которые бактерии используют для заражения своих хозяев, что приводит к таким заболеваниям, как пневмония , сепсис и менингит . Большинство бактерий заражают своего хозяина методом, называемым путем секреции . ТАА являются частью пути секреции , а точнее, системы секреции типа Vc . [ 3 ]
Тримерные автотранспортёрные адгезины имеют уникальную структуру. Структура, которую они поддерживают, имеет решающее значение для их функции. Все они имеют структуру «голова-стебель-якорь». Каждый TAA состоит из трех идентичных белков, отсюда и название тримерный . Как только мембранный якорь вставлен во внешнюю мембрану, пассажирский домен автономно проходит через него во внеклеточную среду хозяина, отсюда и описание аутотранспортера. Головной домен после сборки прикрепляется к элементу внеклеточного матрикса хозяина , например, коллагену , фибронектину и т. д. [ 2 ]
Молекулярная структура
[ редактировать ]Большинство ТАА имеют схожую белковую структуру. При наблюдении с помощью электронной микроскопии структура была описана как форма «леденца», состоящая из N-концевого домена головки, домена стебля и С-концевого мембранного якорного домена. [ 2 ] Часто в литературе они называются доменом пассажира , содержащим N-конец, голову, шею и спиральную ножку, и доменом транслокации , относящимся к C-концевому мембранному якорю. Хотя все ТАА имеют общий мембранный якорь, не все они могут содержать и ножку, и головку. Кроме того, все мембранные якорные домены относятся к типу левосторонних параллельных бета-роллов . [ 4 ]

Расположение белковых доменов тримерного автотранспортера адгезина, BadA [ 1 ] На этом рисунке показаны домены головы, стебля и якоря. На нем изображена голова, похожая на Яду, серого цвета. Стебель содержит повторы, окрашенные в зеленый цвет, а мембранный якорь - в красный. В приведенной ниже последовательности показана окраска в соответствии с расположением доменов и сайтами расщепления протеазой: красным (трипсин) и синим (химотрипсин). (Рисунок использован из журнала открытого доступа, находящегося в свободном доступе, Public Library of Science (PLoS) Pathogen).
Домен расширенной области сигнального пептида
[ редактировать ]| ЭСПР | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | ЭСПР | ||
| Пфам | ПФ13018 | ||
| |||
Расширенная область сигнального пептида (ESPR) находится на N-конце сигнальных пептидов белков, принадлежащих к системам секреции типа V. Функция ESPR заключается в содействии транслокации внутренней мембраны. [ 5 ] действуя как временная привязь. Это предотвращает накопление неправильно свернутых белков. [ 6 ] ESPR можно разделить на отдельные области: домены N1 (заряженный), H1 ( гидрофобный ), N2, H2 и C ( расщепления сайт ). N1 и H1 образуют ESPR и имеют сильную консервацию . [ 7 ]
Функция : Считается, что расширенная область сигнального пептида выполняет несколько функций. Во-первых, биогенез белков в системе секреции типа V (T5SS). Во-вторых, считается, что он нацеливает белок на внутреннюю мембрану для транслокации либо по пути частиц распознавания сигнала (SRP), либо по двойному транслоцированному аргинину (ТАТ). В-третьих, наблюдалось и считалось, что он регулирует скорость миграции белков в периплазму . [ 7 ]
N-концевой головной домен
[ редактировать ]Структура : Этот конкретный домен представляет собой тример одноцепочечных левых бета-спиралей. Они объединяются, образуя левый бета-ролл с девятью витками. [ 8 ] Он содержит мотивы последовательности, в которых имеется большое сходство с другими головками ТАА. Это указывает на большое сходство при сравнении структуры белков. Головной домен соединен со стеблем короткой высококонсервативной последовательностью, которую часто называют шеей или иногда называют соединителем. [ 2 ]
Функция : Функция этого белкового домена заключается в связывании с внеклеточным матриксом хозяина, особенно с фибронектином , коллагеном и ламинином . [ 9 ] Головной домен очень важен для прикрепления к клетке-хозяину и для аутоагглютинации , прилипания к самому себе. [ 1 ]
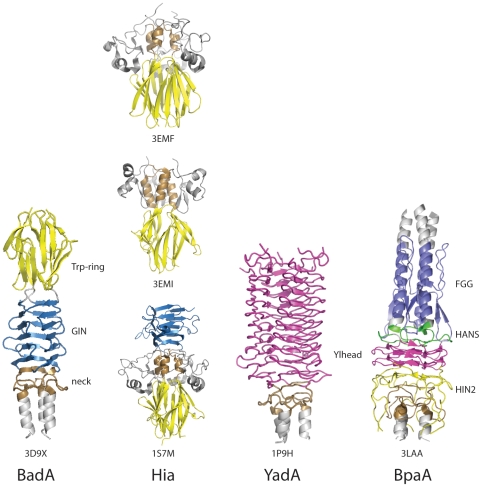
Сравнение головных доменов в различных тримерных автотранспортерных адгезинах [ 10 ] (Рисунок использован из журнала открытого доступа, находящегося в свободном доступе, Public Library of Science (PLoS) Pathogen)
Существует несколько типов головного домена. [ 11 ] Каждый домен помогает головке связываться с различным компонентом внеклеточного матрикса. К ним относятся следующие: YadA-подобный головной домен, Trp-кольцо, GIN, FxG, HIN1 и HIN2. В этой статье основное внимание уделяется первым трем упомянутым.
Голова в стиле Яда
[ редактировать ]Голова в стиле Яда [ 12 ] состоит из одноцепочечных левых бета-спиралей, которые в дальнейшем объединяются, образуя девятиспиральный левосторонний параллельный бета-ролл (LPBR). Это самая плотная из известных структур бета-ролла и первая открытая. Головной домен YadA имеет восемь повторяющихся мотивов, каждый из которых четырнадцать остатков . имеет длину [ 8 ] [ 13 ] [ 14 ]
Трп кольцо
[ редактировать ]Кольцо Трп [ 15 ] является второй по распространенности головкой ТАА. Trp — аминокислота триптофан . это Кольцо Trp получило свое название из-за высокого уровня триптофана , обнаруженного в С-концевой части головного домена. [ 16 ] Они работают, стабилизируя переход между спиральной спиралью и бета-меандром , где голова встречается с шеей или стеблем. Во многих случаях за кольцом Trp часто следует домен GIN.
ДЖИН
[ редактировать ]Домен GIN [ 17 ] представляет собой головной домен, названный в честь мотива его последовательности GIN ( глицин - изолейцин - аспарагин ). Он имеет полностью бета-структуру, при которой две пары антипараллельных бета-листов соединены диагонально расширенным бета-листом. Затем листы складываются, образуя бета-призму, в которой каждая стенка состоит из полного набора из пяти бета-нитей. [ 16 ] За доменом GIN часто следует домен шеи.
Домен шеи
[ редактировать ]Структура : Шейковый домен представляет собой гомотример, в котором связаны три одинаковые субъединицы. Все три субъединицы устроены таким образом, что напоминают структуру, похожую на «английскую булавку». [ 8 ]
Функция : функция шейного домена — быть адаптером между большим диаметром бета -спиралей и меньшим диаметром спиральной катушки. [ 2 ] Кроме того, как и его структура английской булавки, он также выполняет функцию скрепления всех трех мономеров вместе и прикрепляет их к головному домену. [ 8 ] Это увеличивает стабильность шейного отдела.
Существует семь различных типов шейных доменов. [ 11 ] Это следующие: ISneck1, ISneck2, разъем HANS, DALL-1, DALL-2, DALL-3 и шейный домен. Эта статья посвящена домену ISneck.
Домен ISneck
[ редактировать ]Домен ISneck представляет собой тип домена шеи. Существует два типа домена ISneck. Это первый ISneck, который прерывается вставкой. Вставка может иметь сложенную форму (ISneck 1 [ 18 ] ) или намного короче, в развернутом виде (ISшея 2 [ 19 ] ) возмущение. [ 16 ]
Сталкерский домен
[ редактировать ]| Яда_stalk | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | Яда_stalk | ||
| Пфам | PF05662 | ||
| ИнтерПро | ИПР008635 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1с7м / СКОПе / СУПФАМ | ||
| |||
Структура : Эти домены являются волокнистыми и встречаются в часто повторяющихся количествах. Они содержат скрученные витки, и их длина имеет тенденцию различаться у разных видов. Спирально-спиральные сегменты стебельчатых доменов обладают двумя необычными свойствами:
- они чередуются с правосторонней на левостороннюю суперспирализацию
- часто прерываются небольшими шаровидными доменами, что связано с их появлением в виде сегментированных жгутов. [ 2 ]
Кроме того, стебель полностью состоит из пентадекад. Следовательно, стебельковые домены можно рассматривать как альфа-спиральные спиральные спирали , которые отклоняются от стандартной модели из-за своих необычных свойств. [ 20 ] С более глубокой структурной точки зрения спиральная спираль устроена таким образом, что угол пересечения между спиралями практически равен нулю. Упаковка этих спиралей соответствует схеме «шишки в отверстия», при которой гидрофобные остатки выступают, образуя выступы, которые упаковываются в полости, образованные другими остатками на другой спирали. Затем, как только ручки укладываются в полости, три спирали наматываются друг вокруг друга, так что все остатки в определенных положениях оказываются на одной высоте. [ 16 ]
Функция перемещая головные домены от поверхности бактериальной клетки к внеклеточному матриксу хозяина : Их роль заключается в том, чтобы действовать как спейсеры , . Они также играют роль в защите бактериальной клетки от защиты хозяина. [ 2 ] Они делают это, способствуя сопротивлению комплемента . Белковый домен стебля также альтернативно называют внутренним доменом-пассажиром. [ 21 ]
Существует два типа домена стебля: [ 11 ] домен FGG и домен правостороннего стебля.
С-концевой мембранный якорный домен
[ редактировать ]| Якорный домен бактериального адгезина YadA | |||
|---|---|---|---|
 Структура бета-цилиндра, обнаруженная на С-конце якорного домена бактериального адгезина, YadA. [ 22 ] | |||
| Идентификаторы | |||
| Символ | ЯдА_anchor | ||
| Пфам | PF03895 | ||
| Пфам Клан | CL0327 | ||
| ИнтерПро | ИПР005594 | ||
| |||
Структура : Структура этого белкового домена представляет собой левостороннюю спираль, за которой следуют четыре трансмембранные бета-цепи . Считается, что после того, как произошла тримеризация, эти бета-цепи далее складываются в 12-нитевой бета-цилиндр . Он также содержит сайт узнавания сигнальных пептидаз, что означает, что фермент распознает сигнальный пептид и расщепляет его в определенной точке. [ 6 ]
Функция : Функция мембранного якорного домена заключается в содействии движению полипептидной цепи через клеточную мембрану — процесс, известный как аутотранспортная активность. [ 2 ] Способ перемещения ОАА через внешнюю мембрану еще предстоит выяснить, но считается, что они перемещаются внутрь бета-цилиндра , что приводит к транспортировке пассажирского домена от C-конца к N-концу через просвет бета-цилиндра. [ 3 ] По сути, бета-бочонок представляет собой порин , который находится внутри внешней мембраны бактерии . Пассажирский домен или, другими словами, домен стебля со спиральной спиралью перемещается через эту пору. Дополнительными функциями мембранного якоря являются олигомеризация домена стебля и закрепление всего белка на внешней мембране бактерии . [ 23 ]
Модельные белки
[ редактировать ]Все тримерные автотранспортеры-адгезины являются важнейшими факторами вирулентности, вызывающими серьезные заболевания у людей. Наиболее изученные и известные тримерные автотранспортирующие клеи перечислены ниже: [ 1 ]
- Яда Yersinia enterocolitica
- NadA Neisseria meningitidis
- UspA1 и A2 Moraxella cataralis
- Hia и Hsf Haemophilus influenzae
- BadA от Bartonella henselae
| Домен | Белки | |||||
|---|---|---|---|---|---|---|
| Выбросить | Ничего | УспА1 | ХадА | Привет | Да | |
| N-терминал Головка | Одноцепочечная левая бета-спираль [ 9 ] | Шаровидная голова [ 24 ] | пропеллера Бета- головка [ 25 ] | Нет | Бета-призмы | Подобно голове Яда, содержит левостороннюю бета-спираль. |
| Шея | Подарок | Нет | Подарок | Подарок | Подарок | Подарок |
| Стебель | Правосторонняя спиральная катушка | Спирально-спиральные альфа-спирали, за которыми следует линкерная область. | Расширенная спиральная катушка | Трех- альфа-спираль спирально-спиральная | Трехальфа спиральная спираль | Расширенная спиральная катушка |
| Терминал C Мембранный анкер | Структура бета-ствола | Структура бета-ствола | Структура бета-ствола | Структура бета-ствола | Структура бета-ствола | Структура бета-ствола |
| Головной домен Яда | |||
|---|---|---|---|
 Кристаллическая структура коллагенсвязывающего домена адгезина Yersinia YadA | |||
| Идентификаторы | |||
| Символ | YadA_head | ||
| Пфам | PF05658 | ||
| ИнтерПро | ИПР008640 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1п9ч / СКОПе / СУПФАМ | ||
| |||
белок YadA
[ редактировать ]YadA — это белковый домен, обнаруженный у грамотрицательных бактерий, таких как Yersinia enterocolitica , Yersinia pestis и Yersinia pseudotuberculosis . YadA означает белок A адгезина Yersinia . Этот белковый домен является примером тримерных аутотранспортирующих адгезинов и является первым обнаруженным ТАА. [ 26 ] Как и другие ТАА, YadA также подвергается гомотримеризации с образованием стабильного коллаген -связывающего белка. [ 8 ] Гомотримеризация — это процесс, при котором три одинаковых субъединицы объединяются, образуя комплекс из трех идентичных белков YadA. Кроме того, как и другие ТАА, он имеет белковую архитектуру «головка-стебель-якорь». [ 9 ] Большинство ТАА имеют большое сходство в С-концевой мембранной якорной области, единственный член, который различается между ТАА, - это области головки, шеи и стебля. Головная область YadA состоит из бета-спиралей, которые дополнительно свернуты, образуя левосторонний параллельный бета-ролл с девятью витками (LPBR). [ 8 ]
белок NadA
[ редактировать ]Другим примером ТАА является белок NadA. Белок NadA обнаружен у вида грамотрицательных бактерий Neisseria meningitidis , который вызывает сепсис и менингит у людей. [ 27 ] Исследования показали, что глобулярный N-концевой головной домен NadA жизненно важен для адгезии. NadA также содержит область спиральной спирали, а также С-концевой мембранный якорь. [ 24 ]
Белок UspA1
[ редактировать ]UspA1 является еще одним примером тримерного автотранспортера-адгезина, обнаруженного в бактерии Moraxella cataralis , которая является частой причиной инфекций среднего уха у людей. Структура UspA1 также имеет головной домен в N-концевом домене, однако он свернут в бета-пропеллер. Как и другие TAA, он имеет область стебля со спиральной спиралью, но в этом случае он расширен и имеет типичный для TAA С-концевой мембранный якорный домен бета-цилиндра. [ 25 ]
Hia протеин
[ редактировать ]Белок Hia представляет собой ОАА, обнаруженный на внешней мембране бактерии Haemophilus influenzae . У человека он прикрепляется к респираторному эпителию . [ 28 ] Этот белок может вызвать пневмонию , а некоторые штаммы вызывают менингит и сепсис . [ 29 ] У Hia немного необычная N-концевая голова, состоящая из бета-призм. Бета-призма — это необычный тип белковой архитектуры, впервые описанный Чотией и Мурзином. [ 30 ] Как следует из названия, он содержит три бета-листа, расположенных в треугольной призме и обладающих внутренней симметрией. [ 31 ] Кроме того, головной домен содержит 5 доменов Trp-Ring. Кроме того, этот белок также содержит три шейных домена, два из которых являются доменами IsNeck в дополнение к другим доменам, таким как домены KG, GANG и TTT. [ 29 ] Он также содержит спиральную ножку и обычно консервативный мембранный якорь С-конца ТАА. [ 32 ]
Плохой белок A
[ редактировать ]Белок BadA является еще одним примером ОАА, обнаруженного в бактериях Bartonella henselae . Bartonella henselae является возбудителем болезни кошачьих царапин , обычно безвредной болезни, но у людей с ослабленной иммунной системой , например, у тех, кто проходит химиотерапию или борется со СПИДом , она является более серьезной, поскольку может привести к бациллярному ангиоматозу . [ 1 ] Это состояние, при котором доброкачественные опухоли кровеносных сосудов подвергаются неконтролируемой пролиферации , вызывая образование узлов в более мелких кровеносных сосудах, таких как капилляры , ограничивая поток крови. Это может быть связано с тем, что BadA индуцирует транскрипцию проангиогенных факторов, поскольку он активирует NF-κB , а также фактор 1, индуцируемый гипоксией . [ 33 ] Головной домен BadA более сложен, чем у других TAA. Считается, что это химера или, другими словами, комбинация головных доменов YadA и Hia. [ 1 ] Эта комбинация дает представление о том, как патогенность грамотрицательных бактерий развивалась с течением времени. BadA также содержит шейный домен, удлиненную спирально-спиральную ножку и С-концевой мембранный якорь бета-цилиндра.
Клинические эффекты
[ редактировать ]| Белковый домен | Виды бактерий | Болезни, вызванные |
|---|---|---|
| Выбросить | Иерсиния энтероколитика | иерсиниоз |
| Ничего | Нейссерийный менингит | сепсис и менингит |
| УспА1 | Моракселла катаралис | инфекция среднего уха |
| Привет | Гемофильная инфекция | пневмония и некоторые штаммы вызывают менингит и сепсис. |
| Да | Бартонелла Хенселае | болезнь кошачьих царапин |
Процесс заражения
[ редактировать ]Процесс заражения сложен. Инвазионная бактерия должна преодолеть множество барьеров, чтобы заразить своего хозяина, включая барьеры окружающей среды, физические барьеры и барьеры иммунной системы . Бактерия должна проникнуть в организм хозяина, а в случае Yersinia sp. хозяина кишечника , проникают в слизистую . Затем тримерный автотранспортер-адгезин должен прикрепиться к слою клеток, находящихся на внутренней поверхности, эпителиальных клетках кишечника, используя свою головку для связывания с белками, обнаруженными во внеклеточном матриксе, такими как коллаген , ламинин и фибронектин . [ 8 ] Важно, чтобы эти адгезины внешней мембраны вступали в физический контакт с рецепторами, обнаруженными на клетке-хозяине. Это означает, что адгезин должен быть достаточно длинным, чтобы выходить за пределы липополисахаридного слоя внешней мембраны бактерии и взаимодействовать с гликановым слоем клетки-хозяина. [ 29 ] Как только это произойдет, он может связаться с ЕСМ клетки-хозяина. тип микробных ТАА представляют поверхностных компонентов , собой распознающих ) адгезивной матрицы молекулы MSCRAMM ( . Другими словами, они представляют собой комплекс, способствующий адгезии к ЕСМ. [ 34 ]
Система секреции типа V (T5SS)
[ редактировать ]
Схематическая диаграмма, иллюстрирующая тримерные автотранспортеры-адгезины в секреции типа V. системе
Секреция является одним из методов переноса веществ через внешнюю мембрану бактерий . Грамотрицательные бактерии имеют совсем другую структуру клеточной стенки по сравнению с грамположительными бактериями. Грамотрицательные бактерии имеют три слоя: самый внутренний слой называется внутренней мембраной ; средний слой, называемый периплазматическим пространством , представляет собой пространство, содержащее тонкий слой пептидогликана ; а третий слой называется внешней мембраной , которая содержит липополисахариды . [ 23 ]
У грамотрицательных бактерий секреторный путь сильно отличается от такового у эукариот или грамположительных бактерий, главным образом из-за различия в строении клеточной стенки. [ 35 ] Тримерные аутотранспортеры-адгезины используют особый путь секреции, называемый системой секреции типа V (T5SS). Грамотрицательные бактерии должны секретировать адгезины , поскольку у них есть внешняя мембрана, из-за которой им трудно прикрепляться к хозяину и заражать его. Внешняя мембрана полезна, поскольку позволяет бактериям колонизироваться и добавляет еще один уровень защиты. Однако внешняя мембрана является барьером для секреции белков, и для транспортировки белков через внешнюю мембрану требуется энергия. Следовательно, путь T5SS решает эту проблему. [ 35 ]
T5SS использует для работы систему Sec-machine. Фермент Sec - транслоказа обнаружен на внутренней мембране . Таким Sec-зависимым системам не нужно использовать энергию, в отличие от Sec-независимых механизмов, которые используют другие формы энергии, такие как аденозинтрифосфат (АТФ) или протонный градиент . Поскольку он может транспортировать вещества через внешнюю мембрану без необходимости генерировать новую форму энергии, он получил название автотранспортер , поскольку он транспортирует белки автономно . [ 36 ] другими словами, само собой.
Sec-зависимая система разделена на три пути. ТАА являются одним из этих путей и также называются путем секреции типа Vc . Механизм разделен на две части. Во-первых, белок должен перемещаться через внутреннюю мембрану или, другими словами, транслоцироваться Sec-зависимым образом через периплазму . [ 37 ] Сигнальный пептид на N-конце действует как временный привязь, удерживающий его на месте. Далее он должен переместиться на внешнюю мембрану. Тримеризация способствует транслокации, и никакая транслокация не произошла бы без мембранного якоря в виде бета-цилиндра. [ 3 ] Система секреции типа V описывается как нефимбриальная, что означает, что бактериальные клетки не используют длинные физические придатки, называемые пилями, для прикрепления друг к другу. [ 6 ]
Уклонение от иммунной системы хозяина
[ редактировать ]ТАА могут помочь предотвратить разрушение бактерий иммунной системой хозяина. В частности, в случае некоторых видов Yersinia spp. ТАА YadA играет роль в аутоагглютинации , сывороточной резистентности, инактивации комплемента и резистентности к фагоцитозу . Все эти методы предотвращают уничтожение бактерий хозяином и обеспечивают его выживание. [ 8 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж Щесны П., Линке Д., Урсинус А., Бэр К., Шварц Х., Рисс Т.М. и др. (2008). Гош П. (ред.). «Структура головки бартонеллы адгезина Бада» . ПЛОС Патог . 4 (8): e1000119. дои : 10.1371/journal.ppat.1000119 . ПМЦ 2483945 . ПМИД 18688279 .
- ^ Перейти обратно: а б с д и ж г час Линке Д., Рисс Т., Аутенрит И.Б., Лупас А., Кемпф В.А. (2006). «Тримерные автотранспортеры: переменная структура, общая функция». Тенденции Микробиол . 14 (6): 264–70. дои : 10.1016/j.tim.2006.04.005 . ПМИД 16678419 .
- ^ Перейти обратно: а б с Микула К.М., Лео Дж.К., Лысковский А., Кедрачка-Крок С., Пирог А., Гольдман А. (2012). «Транслокационный домен в тримерных аутотранспортерных адгезинах необходим и достаточен для тримеризации и аутотранспортировки» . J Бактериол . 194 (4): 827–38. дои : 10.1128/JB.05322-11 . ПМК 3272944 . ПМИД 22155776 .
- ^ Щесны П., Лупас А. (2008). «Аннотация доменов тримерных автотранспортеров-адгезинов - daTAA» . Биоинформатика . 24 (10): 1251–6. doi : 10.1093/биоинформатика/btn118 . ПМК 2373917 . ПМИД 18397894 .
- ^ Дево М., Скотт-Такер А., Тернер С.М., Купер Л.М., Хубер Д., Натаро Дж.П. и др. (2007). «Консервативный расширенный участок сигнального пептида управляет посттрансляционной транслокацией белка с помощью нового механизма» . Микробиология . 153 (Часть 1): 59–70. дои : 10.1099/mic.0.29091-0 . ПМИД 17185535 .
- ^ Перейти обратно: а б с Лейтон Д.Л., Росситер А.Е., Хендерсон И.Р. (2012). «От самодостаточности к зависимости: механизмы и факторы, важные для биогенеза автотранспортеров» . Nat Rev Микробиол . 10 (3): 213–25. дои : 10.1038/nrmicro2733 . ПМИД 22337167 . S2CID 19562964 .
- ^ Перейти обратно: а б Дево М., Купер Л.М., Филенко Н.А., Скотт-Такер А., Тернер С.М., Коул Дж.А. и др. (2006). «Необычная область расширенного сигнального пептида системы секреции типа V филогенетически ограничена» . FEMS Microbiol Lett . 264 (1): 22–30. дои : 10.1111/j.1574-6968.2006.00425.x . ПМИД 17020545 .
- ^ Перейти обратно: а б с д и ж г час Нуммелин Х., Меркель М.К., Лео Дж.К., Ланкинен Х., Скурник М., Гольдман А. (2004). «Коллагенсвязывающая доменная структура Yersinia Adhesin YadA представляет собой новый левосторонний параллельный бета-ролл» . ЭМБО Дж . 23 (4): 701–11. дои : 10.1038/sj.emboj.7600100 . ПМК 381008 . ПМИД 14765110 .
- ^ Перейти обратно: а б с Коретке К.К., Щесны П., Грубер М., Лупас А.Н. (2006). «Модельная структура прототипного нефимбриального адгезина YadA Yersinia enterocolitica». J Структур Биол . 155 (2): 154–61. дои : 10.1016/j.jsb.2006.03.012 . ПМИД 16675268 .
- ^ Эдвардс Т.Э., Фан И., Абендрот Дж., Дитрих С.Х., Масуди А., Го В. и др. (2010). Курсула П. (ред.). «Структура адгезионной головки тримерного автотранспортера Burkholderia pseudomallei» . ПЛОС ОДИН . 5 (9): e12803. Бибкод : 2010PLoSO...512803E . дои : 10.1371/journal.pone.0012803 . ПМЦ 2942831 . ПМИД 20862217 .
- ^ Перейти обратно: а б с «Инструментарий биоинформатики» .
- ^ «Инструментарий биоинформатики» .
- ^ Валле Дж., Маббетт А.Н., Улетт Г.К., Толедо-Арана А., Векер К., Тоцика М. и др. (2008). «UpaG, новый член семейства тримерных автотранспортеров адгезинов в уропатогенной Escherichia coli» . J Бактериол . 190 (12): 4147–61. дои : 10.1128/JB.00122-08 . ПМЦ 2446758 . ПМИД 18424525 .
- ^ Казерта Р., Такита М.А., Таргон М.Л., Росселли-Мурай Л.К., де Соуза А.П., Перони Л. и др. (2010). «Экспрессия фимбриальных и афимбриальных белков Xylella fastidiosa во время формирования биопленок» . Appl Environ Microbiol . 76 (13): 4250–9. Бибкод : 2010ApEnM..76.4250C . дои : 10.1128/АЕМ.02114-09 . ПМЦ 2897468 . ПМИД 20472735 .
- ^ «Инструментарий биоинформатики» .
- ^ Перейти обратно: а б с д Лысковский А., Лео Дж.К., Голдман А. (2011). «Структура и биология тримерных автотранспортеров». Бактериальная адгезия . Достижения экспериментальной медицины и биологии. Том. 715. стр. 143–58. дои : 10.1007/978-94-007-0940-9_9 . ISBN 978-94-007-0939-3 . ПМИД 21557062 .
- ^ «Инструментарий биоинформатики» .
- ^ «Инструментарий биоинформатики» .
- ^ «Инструментарий биоинформатики» .
- ^ Лупас А.Н., Грубер М. (2005). «Структура альфа-спиральных закрученных катушек». Adv Protein Chem . Достижения в химии белков. 70 : 37–78. дои : 10.1016/S0065-3233(05)70003-6 . ISBN 9780120342709 . ПМИД 15837513 .
- ^ Коттер, ЮВ; Сурана, Северная Каролина; Сент-Джем, JW (2005). «Тримерные автотранспортеры: отдельное подсемейство белков-автотранспортеров». Тенденции в микробиологии . 13 (5): 199–205. дои : 10.1016/j.tim.2005.03.004 . ПМИД 15866036 .
- ^ http://www.ebi.ac.uk/thornton-srv/databases/cgi-bin/pdbsum/GetPage.pl [ нужна полная цитата ]
- ^ Перейти обратно: а б Бялас Н., Касперкевич К., Радзеевская-Лебрехт Ю., Скурник М. (2012). «Структуры поверхности бактериальных клеток Yersinia enterocolitica». Arch Immunol Ther Exp (Варш) . 60 (3): 199–209. дои : 10.1007/s00005-012-0168-z . ПМИД 22484801 . S2CID 10237335 .
- ^ Перейти обратно: а б Тавано Р., Капечки Б., Монтанари П., Франзосо С., Марин О., Штуковска М. и др. (2011). «Картирование сайта связывания NadA с клетками Neisseria meningitidis: значимость предсказанных {альфа}-спиралей в NH2-концевых и димерных спирально-спиральных областях» . J Бактериол . 193 (1): 107–15. дои : 10.1128/JB.00430-10 . ПМК 3019930 . ПМИД 20971901 .
- ^ Перейти обратно: а б Агнью С., Бородина Е., Заккаи Н.Р., Коннерс Р., Бертон Н.М., Викари Дж.А. и др. (2011). «Корреляция механочувствительных реакций in situ адгезина UspA1 Moraxella cataralis со связыванием фибронектина и рецептора CEACAM1» . Proc Natl Acad Sci США . 108 (37): 15174–8. Бибкод : 2011PNAS..10815174A . дои : 10.1073/pnas.1106341108 . ПМК 3174611 . ПМИД 21876142 .
- ^ Казутт-Мейер С., Ренци Ф., Шмалер М., Янн Нью-Джерси, Амстутц М., Корнелис Г.Р. (2010). Бересвилл, Стефан (ред.). «Олигомерный спиральный клей YadA – это палка о двух концах» . ПЛОС ОДИН . 5 (12): e15159. Бибкод : 2010PLoSO...515159C . дои : 10.1371/journal.pone.0015159 . ПМЦ 2999546 . ПМИД 21170337 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Командуччи М., Бамбини С., Брунелли Б., Аду-Боби Дж., Арико Б., Капечки Б. и др. (2002). «NadA, новый кандидат на вакцину против Neisseria meningitidis» . Джей Эксп Мед . 195 (11): 1445–54. дои : 10.1084/jem.20020407 . ПМК 2193550 . ПМИД 12045242 .
- ^ Мэн Дж., Сурана Н.К., Сент-Гем Дж.В., Ваксман Дж. (2006). «Структура транслокаторного домена внешней мембраны тримерного аутотранспортера Haemophilus influenzae Hia» . ЭМБО Дж. 25 (11): 2297–304. дои : 10.1038/sj.emboj.7601132 . ПМК 1478200 . ПМИД 16688217 .
- ^ Перейти обратно: а б с Мэн Г., Сент-Геме Дж.В., Ваксман Г. (2008). «Повторяющаяся архитектура тримерного автотранспортера Haemophilus influenzae Hia» . Дж Мол Биол . 384 (4): 824–36. дои : 10.1016/j.jmb.2008.09.085 . ПМК 2597055 . ПМИД 18948113 .
- ^ Андреева А, Мурзин А.Г. (2010). «Структурная классификация белков и структурная геномика: новый взгляд на сворачивание и эволюцию белков» . Акта Кристаллогр Ф. 66 (Часть 10): 1190–7. дои : 10.1107/S1744309110007177 . ПМК 2954204 . ПМИД 20944210 .
- ^ Симидзу Т., Морикава К. (1996). «Бета-призма: новый складной мотив». Тенденции биохимической науки . 21 (1): 3–6. дои : 10.1016/s0968-0004(06)80018-6 . ПМИД 8848836 .
- ^ Сурана Н.К., Каттер Д., Баренкамп С.Дж., Сент-Геме Дж.В. (2004). «Автотранспортер Hia Haemophilus influenzae содержит необычно короткий тримерный транслокаторный домен» . J Биол Хим . 279 (15): 14679–85. дои : 10.1074/jbc.M311496200 . ПМИД 14726537 .
- ^ Хармс А., Дехио С. (2012). «Злоумышленники ниже радара: молекулярный патогенез видов Bartonella» . Клин Микробиол Ред . 25 (1): 42–78. дои : 10.1128/CMR.05009-11 . ПМК 3255967 . ПМИД 22232371 .
- ^ Харрис Л.Г., Ричардс Р.Г. (2006). «Стафилококки и поверхности имплантатов: обзор». Рана . 37 Приложение 2 (2): S3–14. doi : 10.1016/j.injury.2006.04.003 . ПМИД 16651069 .
- ^ Перейти обратно: а б Герлах Р.Г., Хензель М. (2007). «Системы секреции белков и адгезины: молекулярный арсенал грамотрицательных патогенов». Int J Med Microbiol . 297 (6): 401–15. дои : 10.1016/j.ijmm.2007.03.017 . ПМИД 17482513 .
- ^ Лео Дж.К., Грин И., Линке Д. (2012). «Секреция типа V: механизмы аутотранспорта через внешнюю мембрану бактерий» . Philos Trans R Soc Lond B Biol Sci . 367 (1592): 1088–101. дои : 10.1098/rstb.2011.0208 . ПМЦ 3297439 . ПМИД 22411980 .
- ^ Костакиоти М., Ньюман К.Л., Танасси Д.Г., Статопулос С. (2005). «Механизмы экспорта белка через внешнюю мембрану бактерий» . J Бактериол . 187 (13): 4306–14. дои : 10.1128/JB.187.13.4306-4314.2005 . ПМК 1151778 . ПМИД 15968039 .