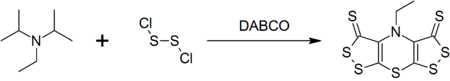N , n -диазопропилитиламин
| |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное имя IUPAC
N -этил- н- (пропан-2-ил) пропан-2-амин | |||
Другие имена
| |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| Chemspider | |||
| Echa Infocard | 100.027.629 | ||
| ЕС номер |
| ||
| Сетка | N, n-диизопропилитиламин | ||
PubChem CID
|
|||
| НЕКОТОРЫЙ | |||
| Номер | 2733 | ||
Comptox Dashboard ( EPA )
|
|||
| Характеристики | |||
| C 8 H 19 N | |||
| Молярная масса | 129.247 g·mol −1 | ||
| Появление | Бесцветная жидкость | ||
| Запах | Рыбный, аммиачный | ||
| Плотность | 0,742 г мл −1 | ||
| Точка плавления | От -50 до -46 ° C (от -58 до -51 ° F; 223 до 227 К) | ||
| Точка кипения | 126,6 ° C; 259,8 ° F; 399,7 К. | ||
| 4,01 г/л (при 20 ° С) | |||
| Давление паров | 4,1 кПа (при 37,70 ° C) | ||
Показатель преломления ( N D )
|
1.414 | ||
| Опасности | |||
| GHS Маркировка : | |||
  
| |||
| Опасность | |||
| H225 , H301 , H314 , H412 | |||
| P210 , P273 , P280 , P301+P310 , P305+P351+P338 , P310 | |||
| точка возгорания | 10 ° C (50 ° F; 283 K) | ||
| Взрывные пределы | 0.7–6.3% | ||
| Смертельная доза или концентрация (LD, LC): | |||
Ld 50 ( средняя доза )
|
200–500 мг кг −1 (устная крыса) | ||
| Связанные соединения | |||
Связанные амины
|
|||
Связанные соединения
|
|||
За исключением случаев, когда отмечены, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа).
| |||
N , n -диазопропилитиламин , или основание Хюнига , является органическим соединением , которое является третичным амином . Он назван в честь немецкого химика Зигфрида Хюнига . Он используется в органической химии в качестве некулеофильной основы . Он обычно сокращена как Dipea, Diea или I -pr 2 Net .
Структура
[ редактировать ]Dipea состоит из центрального атома азота , который связан с этильной группой и двух изопропильных групп. Одинокая пара электронов находится на атоме азота, который может реагировать с электрофилами. Тем не менее, три алкильные группы на атоме азота создают стерические препятствия , поэтому только небольшие электрофилы , такие как протоны, могут реагировать с одинокой азотной парой.
Появление и подготовка
[ редактировать ]Dipea коммерчески доступна. готовятся алкилирование диизопропиламина диэтилсульфатом с Традиционно . [ 1 ]
Чистая Dipea существует как бесцветная жидкость, хотя коммерческие образцы могут быть слегка желтыми. При необходимости соединение может быть очищено путем дистилляции от гидроксида калия [ 2 ] или гидрид кальция . [ 3 ]
Использование и реакции
[ редактировать ]Dipea - это стерически затрудненное органическое основание, которое обычно используется в качестве протонного мусорщика. Таким образом, как 2,2,6,6-тетраметилпиперидина и триэтиламин , Dipea-хорошее основание, но плохой нуклеофил , Dipea имеет низкую растворимость в воде, что очень легко восстанавливается в коммерческих процессах, комбинация свойств, которые делают ее Полезный органический реагент. [ 4 ]
Амидная связь
[ редактировать ]Он обычно используется в качестве затрудненного основания в реакциях амидной связи между карбоновой кислотой (обычно активируется, например, в виде хлорида кислоты, как показано ниже) и нуклеофильным амином. [ 5 ] Поскольку Dipea затруднен и плохо нуклеофильной, она не конкурирует с нуклеофильным амином в реакции связи.
Алкилирования
[ редактировать ]Dipea была исследована для его использования в качестве селективного реагента в вторичных аминов к третичным аминам алкилгалогентами алкилировании . Это часто мешают нежелательной реакции меншина, образующей четвертичную соль аммония , но отсутствует, когда присутствует Dipea. [ 6 ]
Переходные металлы катализировали реакции поперечного связки
[ редактировать ]Dipea может использоваться в качестве основания в ряде переходных металлов, катализируемых реакциями перекрестной связки , таких как муфта Heck и соногашира (как показано ниже). [ 7 ]
Окисление Сворна
[ редактировать ]Хотя триэтиламин традиционно используется в качестве затрудненного основания при окислении Swern , вместо этого можно использовать структурно сходную дипеа, как показано ниже. [ 8 ]
Примеры Dipea, используемые в качестве субстрата
[ редактировать ]Dipea образует сложное гетероциклическое соединение, называемое скорпионином (BIS ([1,2] дитиоло)-[1,4] тиазин) при реакции с дихлоридом дильфур-дихлорида , которая катализируется DABCO в синтезе с одним POT . [ 9 ]
Сравнение с триэтиламином
[ редактировать ]Дипо и триэтиламин структурно очень похожи, причем оба соединения считаются затрудненными органическими основаниями. Из -за их структурного сходства дипо и триэтиламин можно использовать взаимозаменяемо в большинстве приложений. Атом азота в DIPEA более затруднен, чем атом азота в триэтиламине. Однако триэтиламин является немного более сильным основанием, чем Dipea; P a Значения в соответствующих конъюгатных кислот диметилсульфоксиде составляют 9,0 и 8,5 соответственно. [ 10 ]
Ссылки
[ редактировать ]- ^ Hünig, S.; Kiessel, M. (1958). «Специфические протонные рецепторы в качестве вспомогательных оснований в алкилировании и реакциях дегидрогалогенирования». Химические отчеты . 91 (2): 380–392. Doi : 10.1002/cber.19580910223 .
- ^ Armarego, WLF (2012-10-17). Очистка лабораторных химикатов . Чай, Кристина Ли Лин (седьмое изд.). Амстердам. ISBN 9780123821621 Полем OCLC 820853648 .
{{cite book}}: CS1 Maint: местоположение отсутствует издатель ( ссылка ) - ^ Keiper, Sonja; Vyle, Joseph S. (2006-05-12). «Обратимый фотоконтроль дезоксирибозимного катализируемого расщепления РНК в условиях множественного оборота» . Angewandte Chemie International Edition . 45 (20): 3306–3309. doi : 10.1002/anie.200600164 . ISSN 1433-7851 . PMID 16619331 . S2CID 21242501 .
- ^ Сорги, К.Л. (2001). «Диизопропапилэтиламин». Энциклопедия реагентов для органического синтеза . doi : 10.1002/047084289x.rd254 . ISBN 978-0471936237 .
- ^ Dunetz, Joshua R.; Магано, Хавьер; Вайзенбургер, Джеральд А. (2016-02-05). «Крупномасштабные применения реагентов амидной связи для синтеза фармацевтических препаратов». Органические процессы исследования и разработки . 20 (2): 140–177. doi : 10.1021/op500305s . ISSN 1083-6160 .
- ^ Мур, JL; Тейлор, См; Soloshonok, VA (2005). «Эффективный и оперативно удобный общий синтез третичных аминов путем прямого алкилирования вторичных аминов с алкилгалогентами в присутствии основания Хуенига» . Arkivoc . 2005 (часть VI): 287–292. doi : 10.3998/ark.5550190.0006.624 . HDL : 2027/spo.5550190.0006.624 . EJ-1549c.
- ^ Чиншилла, Рафаэль; Наджера, Кармен (2011). «Последние достижения в области реакций Соногаширы» . Обзоры химического общества . 40 (10): 5084–5121. doi : 10.1039/c1cs15071e . ISSN 0306-0012 . PMID 21655588 .
- ^ Walba, David M.; Турмес, Уильям Н.; Haltiwanger, R. Curtis (1988). «Высокий стереоконтролированный маршрут к системе Spiroketal Ring Monensin» ». Журнал органической химии . 53 (5): 1046–1056. doi : 10.1021/jo00240a022 . ISSN 0022-3263 .
- ^ Рис, W.; Маркос, CF; Polo, C.; Торроба, Т.; ОА РАКИТИН (1997). «От основания Хюнига до бис ([1,2] дитиоло)-[1,4] тиазины в одном горшке: быстрый путь к высоко серым гетероциклам». Angewandte Chemie International Edition . 36 (3): 281–283. doi : 10.1002/anie.199702811 .
- ^ Lepore, Salvatore D.; Хорам, Анита; Бромфилд, Дебора С.; Кон, Памела; Jairaj, Vinod; Сильвестри, Максимилиан А. (2005). «Исследования по марганцево-опосредованной изомеризации алкиниловых карбонилов Аленил Карбонилы». Журнал органической химии . 70 (18): 7443–7446. doi : 10.1021/jo051040u . ISSN 0022-3263 . PMID 16122274 .