Cyaa
| Бифункциональный гемолизин/аденилатциклаза | |||
|---|---|---|---|
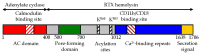 Схематическое представление CYAA. | |||
| Идентификаторы | |||
| Организм | |||
| Символ | из | ||
| Альт. символы | cyaa | ||
| Входить | 45387797 | ||
| Refseq (prot) | WP_010929995.1 | ||
| Uniprot | P0DKX7 | ||
| Другие данные | |||
| ЕС номер | 4.6.1.1 | ||
| Хромосома | Геном: 0,49 - 0,5 МБ | ||
| |||
Токсин аденилатциклазы ( CYAA ) высвобождается из бактерий Bordetella perfussis T1SS (система секреции типа 1) и выделяется в дыхательных путях хозяина , чтобы подавить его раннюю врожденную и последующую адаптивную иммунную защиту. [ 1 ]
CYAA играет особую роль в ранних этапах колонизации дыхательных путей. Он способен мгновенно поднять бактерицидный окислительный взрыв, наряду с опсонофагоцитарными способностями уничтожения нейтрофилов и макрофагов . В результате это позволяет установить инфекцию слизистой оболочки дыхательных путей и способствует иммунному уклонению от B. pertussis, влияя на иммунные клетки хозяина. [ 1 ]
Структура
[ редактировать ]Токсин представляет собой полипептид длиной остатка 1706 года, который состоит из N-концевого фермента ~ 400 остатка аденилатциклазы (AC), который связан с характерным фрагментом гемолизина RTX (HLY) ~ 1300 остатков. Сама эта Hly Fire состоит из четырех функциональных поддоменов, включающих: (i) гидрофобный домен породи-формирования; (ii) домен активации с двумя посттрансляционно ацилированными остатками лизина; (iii) рецептор-связывающий домен RTX, состоящий из ~ 40 типичных кальций-связывающих непептидных повторений RTX]; и (iv) не обработанный сигнал C-концевой секреции C-концевой секреции, признанный бактериальной системой секреции типа I (T1SS), соответственно. [ 2 ]
Режим действия в ячейках хозяина
[ редактировать ]Оказавшись в клетках-хозяевах, CYAA связывает рецептор комплемента 3 (CR3), интегрин αMβ2, известный также как CD11b/CD18 или Mac-1. Затем токсин транслоцирует его фермент -домен AC через цитоплазматическую мембрану CR3 -экспрессирующих миелоидных клеток, таких как макрофаги, нейтрофилы и дендритные клетки. [ 1 ]
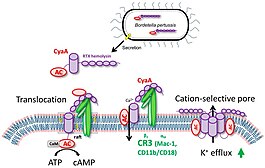
Вставка в мембрану клетки приводит к притоку ионов кальция, который приводит к опосредованному кальпаинам расщепления талина . Комплекс CYAA -CR3 перемещается в липидные рафты, а домен AC транслоцируется через клеточную мембрану в трансмембранную область, где сигнальные комплексы, такие как протеинкиназа A. кластерируются [ 3 ]
Внутри клеток фермент переменного тока связывает кальмодулин и катализирует нерегулируемое превращение АТФ в ключевую молекулу второго мессенджера 3 ', 5'-циклический аденозин-монофосфат (ЦАМ). CAMP отвечает за недостаток бактерицидной активности клеток -мишеней. Гемолизин RTX часть CYAA функционально не зависит от домена AC и образует олигомерные катионо-селективные поры, которые позволяют цитозольным ионам калия утекать из клеток через клеточную мембрану. [ 3 ]
Вмешательство в иммунную защиту
[ редактировать ]Быстрое производство очень высокого уровня внутриклеточного ЦАМФ в CD11B-экспрессирующих иммунных клетках, которые сталкиваются с COAA, сразу же мешают физиологическим функциям фагоцитов. [ 1 ] В моноцитах и макрофагах, продуцированный CYAA CAMP, передача сигнала через путь цАМФ/протеинкиназы A (PKA) блокирует производство активных форм кислорода (ROS). Это также останавливает опосредованное дополнением поглощение опсонизированных частиц. При более высоких дозах CYAA FCR-опосредованный фагоцитоз также ингибируется. [ 4 ]
Благодаря передаче сигналов CAMP CYAA также изменяет TLR-вызванное созревание дендритных клеток, ингибируя провоспалительные IL-12 и секрецию TNF-α и усиление производства IL-10 и расширение TREG, предотвращая индукцию адаптивных иммунных реакций на инфекции Bordetella. [ 5 ]
Энзиматическая активность AC CYAA также, по-видимому, продлевает внутриклеточное выживание неэпсонизированных интернализованных (вторгающихся) бактерий B. pertussis, которые вступают в человеческие и мышиные макрофаги нефагоцитарным механизмом. [ 4 ]
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а беременный в дюймовый Fedele G, Schiavoni I, Adkins I, Klimova N, Sebo P (сентябрь 2017 г.). «Инвазия дендритных клеток, макрофагов и нейтрофилов с помощью токсина Bordetella аденилатциклазы: подрывное движение, чтобы обмануть иммунитет хозяина» . Токсины . 9 (10): 293. doi : 10.3390/toxins9100293 . PMC 5666340 . PMID 28934122 .
- ^ Новак Дж., Черни О., Осикова А., Линхартова И., Масин Дж., Бумба Л. и др. (Сентябрь 2017). «Структурно-функциональные отношения, лежащие в основе способности токсина Bordetella аденилатциклазы, чтобы разоружить фагоциты хозяина» . Токсины . 9 (10): 300. doi : 10.3390/toxins9100300 . PMC 5666347 . PMID 28946636 .
- ^ Jump up to: а беременный Bumba L, Masin J, Fiser R, Sebo P (May 2010). Брэдли Ка (ред.). «Структурно-функциональные отношения, лежащие в основе способности токсина Bordetella аденилатциклазы, чтобы разоружить фагоциты хозяина» . PLO -патогены . 6 (5): E1000901. doi : 10.1371/journal.ppat.1000901 . PMC 2869314 . PMID 20485565 .
- ^ Jump up to: а беременный Kamanova J, Kofronova O, Masin J, Genth H, Vojtova J, Linhartova I, et al. (Октябрь 2008 г.). «Аденилатциклазы токсин подрывает функцию фагоцитов путем ингибирования RhoA и непродуктивного взрыва» . Журнал иммунологии . 181 (8): 5587–97. doi : 10.4049/jimmunol.181.8.5587 . PMID 18832717 .
- ^ Sebo P, Osicka R, Masin J (октябрь 2014 г.). «Аденилат циклаза токсин-гемолизин для вакцин против коклюша». Экспертный обзор вакцин . 13 (10): 1215–27. doi : 10.1586/14760584.2014.944900 . PMID 25090574 . S2CID 27038032 .