трет -Бутилпероксибензоат

| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
трет -Бутилбензолкарбопероксоат | |
| Другие имена
трет -Бутилпербензоат
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.009.440 |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 11 Н 14 О 3 | |
| Молярная масса | 194.230 g·mol −1 |
| Плотность | 1,034 г/см 3 |
| Температура плавления | 8-9 °С |
| Точка кипения | 112 °C (разлагается) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
трет -Бутилпероксибензоат ( TBPB ) органическое соединение формулы C 6 H 5 CO 3 CMe 3 (Me = CH 3 ). Это наиболее широко производимый перестер ; это сложный эфир пероксибензойной кислоты ( С 6 Н 5 СО 3 Н ). Его часто используют в качестве радикального инициатора в реакциях полимеризации , например, при производстве ПЭНП из этилена , а также для сшивания , например, для ненасыщенных полиэфирных смол. [ 1 ]
Характеристики
[ редактировать ]ТБФБ бледно-желтого цвета встречается исключительно в виде раствора в таких растворителях, как этанол или фталат. [ 2 ]
Как пероксосоединение, ТБФБ содержит около 8,16 мас.% активного кислорода и имеет температуру самоускоряющегося разложения (ТСУР) около 60 °C. SADT — это самая низкая температура, при которой в течение недели может произойти самоускоряющееся разложение в транспортной упаковке, и которую не следует превышать при хранении или транспортировке. [ 3 ] Поэтому TBPB следует хранить при температуре минимум 10 °C (ниже затвердевания ) и максимум 50 °C. Разбавление высококипящим растворителем увеличивает ТСУР. Период полураспада ТБФБ, при котором разлагается 50% пероксиэфира, составляет 10 часов при 104°С, один час при 124°С и одну минуту при 165°С. Амины, ионы металлов , сильные кислоты и основания , а также сильные восстановители и окислители ускоряют разложение ТБФБ даже в низких концентрациях. [ 3 ] Однако TBPB является одним из самых безопасных в обращении перэфиров или органических пероксидов. [ 4 ] Основными продуктами разложения трет -бутилпероксибензоата являются углекислый газ , ацетон , метан , трет -бутанол , бензойная кислота и бензол . [ 5 ]
Производство
[ редактировать ]получения перэфиров является ацилирование бутилгидропероксида трет - бензоилхлоридом . Стандартной процедурой [ 6 ] В реакции большой избыток трет используют -бутилгидропероксида и образовавшийся хлористый водород удаляют в вакууме, практически количественный выход в результате чего получают .

Приложения
[ редактировать ]В полимерной химии
[ редактировать ]Прежде всего, ТБФБ используется в качестве радикального инициатора либо при полимеризации, например, этилена (в ПЭНП), винилхлорида, стирола или акриловых эфиров, либо в качестве так называемых ненасыщенных полиэфирных смол (УП-смолы). [ 2 ] Количество, используемое для отверждения UP-смол, составляет около 1-2%. [ 2 ]
Недостатком, особенно при производстве полимеров для применения в пищевой или косметической промышленности, является возможное образование бензола в качестве продукта разложения, который может диффундировать из полимера (например, упаковочной пленки из полиэтилена низкой плотности).
В органической химии
[ редактировать ]Защитная группа 2-триметилсилилэтансульфонилхлорид (SES-Cl) для первичных и вторичных аминогрупп доступна при реакции винилтриметилсилана с гидросульфитом натрия и ТБФБ до натриевой соли триметилсилилэтансульфокислоты и последующей реакции с тионилхлоридом до соответствующего сульфонилхлорида. [ 4 ]

ТБФБ можно использовать для введения бензоилоксигруппы в аллильное положение ненасыщенных углеводородов. [ 7 ]

Из циклогексена с помощью ТБФБ в присутствии каталитических количеств бромида меди(I) образуется 3-бензоилоксициклогексен с выходами от 71 до 80%.
Это аллильное окисление алкенов, также известное как окисление Хараша-Сосновского , приводит к образованию рацемических аллильных бензоатов в присутствии каталитических количеств бромида меди (I) . [ 8 ]

Модификация реакции использует трифторметансульфонат меди(II) в качестве катализатора и ДБН или ДБУ в качестве оснований для достижения выходов до 80% в реакции ациклических олефинов с ТБФБ до аллильных бензоатов. [ 9 ]
Замещенные оксазолины и тиазолины можно окислить до соответствующих оксазолов и тиазолов модифицированным окислением Хараша-Сосновского ТБФБ и смесью солей Cu(I) и Cu(II) с подходящими выходами. [ 10 ]

Карбоалкоксигруппа в положении С-4 необходима для успешной реакции.
Бензол и фураны могут быть алкенилированы олефинами в результате окислительного сочетания при катализе солями палладия с использованием ТБФБ в качестве акцептора водорода. [ 11 ]
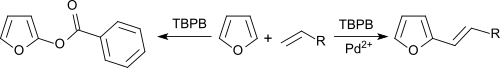
В отсутствие Pd 2+ соли, ароматические соединения бензоксилированы.
Ссылки
[ редактировать ]- ^ Кленк, Герберт; Гетц, Питер Х.; Зигмайер, Райнер; Майр, Уилфрид. «Перекисные соединения органические». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a19_199.pub2 . ISBN 978-3527306732 .
- ^ Jump up to: а б с United Initiators, Технический паспорт, TBPB
- ^ Jump up to: а б Отдел безопасности производителей органических пероксидов, БЕЗОПАСНОСТЬ И ОБРАЩЕНИЕ С ОРГАНИЧЕСКИМИ ПЕРОКСИДАМИ Общество индустрии пластмасс, издание 2012 г. Архивировано 1 апреля 2016 г. на Wayback Machine.
- ^ Jump up to: а б «2-Триметилсилилэтансульфонилхлорид (SES-Cl)». Органические синтезы . дои : 10.15227/orgsyn.075.0161 .
- ^ PERGAN GmbH: Органические пероксиды для полимеризации.
- ^ Н. А. Милас, Д. Г. Орфанос, Р. Дж. Кляйн (1964), "Сольволиз хлорангидридов с т-алкилгидропероксидами", J. Org. хим. , том. 29, нет. 10, стр. 3099–3100, doi : 10.1021/jo01033a525.
{{citation}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ «3-Бензоилоксициклогексен». Органические синтезы . дои : 10.15227/orgsyn.048.0018 .
- ^ М. С. Хараш, Г. Сосновский (1958), «Реакции трет-бутилпербензоата и олефинов - стереоспецифическая реакция», J. Am. хим. Соц. , том. 80, нет. 3, с. 756, номер домена : 10.1021/ja01536a062
- ^ Г. Сакар, А. ДаттаГупта, В.К. Сингх (1996), «Комплекс Cu(OTf)2 – DBN/DBU как эффективный катализатор аллильного окисления олефинов трет -бутилпербензоатом», Tetrahedron Lett. , том. 37, нет. 46, стр. 8435–8436, номер документа : 10.1016/0040-4039(96)01911-9.
{{citation}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ AI Meyers, FX Tavares (1996), "Окисление оксазолинов и тиазолинов до оксазолов и тиазолов. Применение реакции Хараша-Сосновского", J. Org. хим. , том. 61, нет. 23, стр. 8207–8215, номер документа : 10.1021/jo9613491 , PMID 11667808.
- ^ Дж. Цудзи, Х. Нагасима (1984), «Катализируемое палладием окислительное сочетание ароматических соединений с олефинами с использованием трет-бутилпербензоата в качестве акцептора водорода», Tetrahedron , vol. 40, нет. 14, стр. 2699–2702, номер документа : 10.1016/S0040-4020(01)96888-7.