Органические пероксиды

В химии органической органические пероксиды — это органические соединения, содержащие пероксидную функциональную группу ( R-O-O-R' ). Если R' представляет собой водород , соединения называются гидропероксидами , которые обсуждаются в этой статье. Связь О-О пероксидов легко разрывается, образуя свободные радикалы вида РО • (точка обозначает неспаренный электрон ). Таким образом, органические пероксиды полезны в качестве инициаторов некоторых типов полимеризации , таких как акриловые , ненасыщенные полиэфирные и винилэфирные смолы , используемые в стеклопластиках . МЭКП и перекись бензоила Для этой цели обычно используются . Однако это же свойство также означает, что органические пероксиды могут взрываться. Органические пероксиды, как и их неорганические аналоги, часто являются мощными отбеливателями . [1]
Виды органических пероксидов
[ редактировать ]Органические пероксиды классифицируются (i) по наличию или отсутствию гидроксильного (-OH) конца и (ii) по наличию алкильных и ацильных заместителей. [2]
- Примеры органических пероксидов
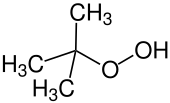
- трет -Бутилгидропероксид , гидропероксид (формула: ROOH), который используется для эпоксидирования алкенов.
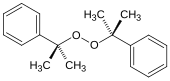
- Дикумилпероксид , диалкилпероксид (формула: ROOR), который используется для инициирования полимеризации.
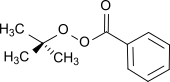
- трет- бутилпероксибензоат , пероксиэфир (формула: RCO 3 R' ), который использовали в качестве радикального инициатора.
- дибензоилпероксид , диацилпероксид (формула: (RCO 2 ) 2 ) ) также используется в качестве инициатора полимеризации.
- Пероксиуксусная кислота , пероксикарбоновая кислота (формула: (RCO 3 H ), реагент в органическом синтезе .
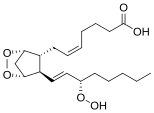
- Простагландин G2 , эндопероксид, предшественник других простагландинов.
Одним из пробелов в классах органических пероксидов является пероксид дифенила. Квантово-химические расчеты предсказывают, что он вступает в почти безбарьерную реакцию, подобную перегруппировке бензидина . [3]
Характеристики
[ редактировать ]O-O Длина связи в пероксидах составляет около 1,45 Å , а углы R-O-O (R = H, C) около 110 ° (водоподобные). Характерно, что двугранные углы C-O-O-R (R = H, C) составляют около 120°. Связь O-O относительно слабая, с энергией диссоциации связи 45–50 ккал/моль (190–210 кДж/моль ), что менее половины прочности связей C-C, C-H и C-O. [4] [5]
Биология
[ редактировать ]
Пероксиды играют важную роль в биологии. Известны сотни пероксидов и гидропероксидов, полученных из жирных кислот, стероидов и терпенов. [6] Простагландины арахидоновой биосинтезируются путем первоначального образования бициклического пероксида («эндопероксида»), полученного из кислоты . [7]
Многие аспекты биоразложения или старения связаны с образованием и распадом пероксидов, образующихся из кислорода воздуха. Противодействуя этим эффектам, ряд биологических и искусственных антиоксидантов разрушают перекиси.
У светлячков окисление люциферинов , катализируемое люциферазами , приводит к образованию пероксисоединения 1,2-диоксетана . Диоксетан нестабилен и самопроизвольно распадается на диоксид углерода и возбужденные кетоны , которые выделяют избыточную энергию путем испускания света ( биолюминесценция ). [8]

Промышленное использование
[ редактировать ]В полимерной химии
[ редактировать ]Многие пероксиды используются в качестве радикальных инициаторов , например, для обеспечения полимеризации акрилатов. Промышленные смолы на основе эфиров акриловой и/или метакриловой кислоты всегда производятся радикальной полимеризацией с органическими пероксидами при повышенных температурах. [9] Скорость полимеризации регулируют подходящим выбором температуры и типа пероксида. [10]
Пероксид метилэтилкетона , пероксид бензоила и, в меньшей степени, пероксид ацетона используются в качестве инициаторов радикальной полимеризации некоторых термореактивных материалов , например, ненасыщенных полиэфирных и винилэфирных смол, часто встречающихся при изготовлении композитов из стекловолокна или углеродного волокна (CFRP), например, для лодок. , автофургоны, ванны, бассейны, спортивное оборудование, лопасти ветряных турбин и различные промышленные применения.
Пероксид бензоила , пероксиэфиры / пероксикетали и алкилпероксимонокарбонаты используются в производстве полистирола , пенополистирола и ударопрочного полистирола , а пероксид бензоила используется для многих клеев на основе акрилата.
Технологии производства термопластов для многих применений промышленной полимеризации включают процессы, которые осуществляются партиями в больших объемах, в растворе или в суспензии. Соответствующие полимеры включают: поливинилхлорид (ПВХ), полиэтилен низкой плотности (ПВД), полиэтилен высокой плотности (ПВД), полиметилметакрилат (ПММА), полистирол и Поликарбонаты .
Отбеливающие и дезинфицирующие средства
[ редактировать ]Перекись бензоила и перекись водорода используются в качестве отбеливающих и «созревающих» агентов для обработки муки , чтобы ее зерно выделяло клейковину легче ; Альтернативой является медленное окисление муки воздухом, что слишком медленно для индустриальной эпохи. Перекись бензоила — эффективное местное лекарство для лечения большинства форм прыщей .
Подготовка
[ редактировать ]Из перекиси водорода
[ редактировать ]Диалкилпероксиды, например дикумилпероксид , синтезируют добавлением пероксида водорода к алкенам или O-алкилированием гидропероксидов.
Диацилпероксиды обычно получают путем обработки пероксида водорода хлорангидридами кислот или ангидридами кислот в присутствии основания: [1]
- H 2 O 2 + 2 RCOCl → (RCO 2 ) 2 + 2 HCl
- H 2 O 2 + (RCO) 2 O → (RCO 2 ) 2 + H 2 O
Реакция конкурирует с гидролизом ацилирующего агента, но гидропероксид-анион является более сильным нуклеофилом по сравнению с гидроксидом. Несимметричные диацилпероксиды можно получить обработкой ацилхлоридов пероксикислотой.
Переэфиры , примером которых является трет -Бутилпероксибензоат , получают путем обработки ангидридов кислот или хлоридов кислот гидропероксидами.
Из О 2
[ редактировать ]Циклические пероксиды можно получить циклоприсоединением синглетного кислорода (генерируемого УФ-излучением) к диенам. Важным примером является рубрен . Шестичленные циклические пероксиды называются эндопероксидами. [11] Четырехчленные диоксетаны можно получить путем 2+2- циклоприсоединения кислорода к алкенам . [12] [13]
Опасность, связанная с хранением эфиров на воздухе, связана с образованием гидропероксидов в результате прямой, хотя и медленной реакции триплетного кислорода со связями CH .
Реакции
[ редактировать ]Гомолиз
[ редактировать ]широко используются для инициирования полимеризации олефинов Органические пероксиды , например для образования полиэтилена . Ключевым этапом является гомолиз :
- РЕВ ⇌ 2 РО. .
Склонность к гомолизу также используется для модификации полимеров путем прививки или висбрекинга , а также для сшивки полимеров для создания термореактивных материалов . При использовании для этих целей пероксид сильно разбавлен, поэтому тепло, выделяемое при экзотермическом разложении, безопасно поглощается окружающей средой (например, полимерным соединением или эмульсией ).
Самоокисление
[ редактировать ]Органические пероксиды могут разлагаться путем самоокисления, особенно в концентрированной форме, поскольку органические пероксиды содержат как окислитель (связь OO), так и топливо (связи CH и CC). «Самоускоряющееся разложение» происходит, когда скорость разложения пероксида генерирует тепло с большей скоростью, чем оно может рассеиваться в окружающую среду. Температура является основным фактором, влияющим на скорость разложения. Самая низкая температура, при которой упакованный органический пероксид будет подвергаться самоускоряющемуся разложению в течение недели, определяется как температура самоускоряющегося разложения (ТСУР). Крупный пожар на химическом заводе Аркема в Кросби, штат Техас (США) в 2017 году был вызван разложением различных органических пероксидов после отключения электроэнергии и последующей потери систем охлаждения. [14] Это произошло из-за сильного наводнения, вызванного ураганом Харви , который разрушил основные и резервные электрогенераторы на объекте. [14]
Общий процесс
[ редактировать ]Гидропероксиды являются промежуточными продуктами или реагентами в основных коммерческих процессах. В кумоловом процессе ацетон и фенол получают разложением гидропероксида кумола (Me = метил):
- C 6 H 5 CMe 2 (O 2 H) → C 6 H 5 OH + O=CMe 2
Антрагидрохинон самопроизвольно реагирует с кислородом с образованием антрахинона и перекиси водорода, возможно, через какое-то органическое промежуточное соединение пероксида. После экстракции перекиси водорода антрахинон каталитически восстанавливается до антрагидрохинона и повторно используется в процессе. Есть и другие гидрохиноны, реагирующие аналогичным образом.
Снижение
[ редактировать ]Органоперекиси можно восстановить до спиртов с помощью алюмогидрида лития , как описано в этом идеализированном уравнении:
- 4 ROOH + LiAlH 4 → LiAlO 2 + 2 H 2 O + 4 ROH
Эфиры фосфита и третичные фосфины также способствуют восстановлению:
- РОХ + ПР 3 → П(ИЛИ) 3 + РОХ
Расщепление на кетоны и спирты происходит в результате катализируемой основаниями перегруппировки Корнблюма-ДеЛаМаре , которая включает разрыв связей внутри пероксидов с образованием этих продуктов.
Некоторые пероксиды представляют собой лекарства , действие которых основано на образовании радикалов в нужных местах организма. Например, артемизинин и его производные, такие как артесунат , обладают наиболее быстрым действием из всех современных препаратов против вызванной falciparum малярии, . [15] Артесунат также эффективен в снижении яйценоскости при инфекции Schistosoma haematobium . [16]
Органический синтез
[ редактировать ]Трет-Бутилгидропероксид используется в качестве реагентов эпоксидирования и гидроксилирования в сочетании с металлическими катализаторами. [17]
Анализ пероксидов
[ редактировать ]
Для качественного и количественного определения пероксидов используют несколько аналитических методов. [18] Простое качественное обнаружение пероксидов осуществляется с помощью йод-крахмальной реакции . [19] Здесь пероксиды, гидроперекиси или перкислоты окисляют добавленный йодид калия в йод , который вступает в реакцию с крахмалом, образуя темно-синий цвет. Доступны индикаторы коммерческих бумаг, использующие эту реакцию. Этот метод также пригоден для количественной оценки, но он не позволяет различить разные типы пероксидных соединений. обесцвечивание различных красителей индиго в присутствии пероксидов. Вместо этого для этой цели используется [20] Например, потеря синего цвета лейкометиленового синего селективна в отношении перекиси водорода. [21]
Количественный анализ гидропероксидов можно провести с помощью потенциометрического титрования алюмогидридом лития . [22] Другим способом оценки содержания надкислот и пероксидов является объемное титрование алкоксидами, например этилатом натрия . [23]
Активный кислород в пероксидах
[ редактировать ]Считается, что каждая пероксигруппа содержит один активный атом кислорода. Концепция содержания активного кислорода полезна для сравнения относительной концентрации пероксигрупп в рецептурах, которая связана с содержанием энергии. Как правило, содержание энергии увеличивается с увеличением содержания активного кислорода, и, следовательно, чем выше молекулярная масса органических групп, тем ниже содержание энергии и, как правило, тем ниже опасность.
Термин «активный кислород» используется для обозначения количества пероксида, присутствующего в любом составе органического пероксида. Один из атомов кислорода в каждой пероксидной группе считается «активным». Теоретическое количество активного кислорода можно описать следующим уравнением: [24]
где p — количество пероксидных групп в молекуле, а m — молекулярная масса чистого пероксида.
Органические пероксиды часто продаются в виде составов, включающих один или несколько флегматизирующих агентов . То есть из соображений безопасности или улучшения характеристик свойства состава органического пероксида обычно модифицируются путем использования добавок для флегматизации (снижения чувствительности), стабилизации или иного улучшения органического пероксида для коммерческого использования. Коммерческие составы иногда состоят из смесей органических пероксидов, которые могут быть или не быть флегматизированы.
Безопасность
[ редактировать ]
Пероксиды также являются сильными окислителями и легко вступают в реакцию с кожей, хлопком и древесной массой. [25] В целях безопасности пероксидные соединения хранят в прохладной непрозрачной таре, так как нагревание и освещение ускоряют их химические реакции . Небольшие количества пероксидов, выходящие из резервуаров для хранения или реакции, нейтрализуют с помощью восстановителей, таких как сульфат железа (II) . Меры безопасности на промышленных предприятиях, производящих большое количество пероксидов, включают следующее:
1) Оборудование размещается в железобетонных конструкциях с фольгированными окнами, которые сбрасывают давление и не разрушаются в случае взрыва.
2) Продукты разливают в небольшие контейнеры и сразу после синтеза перемещают в холодное место.
3) Контейнеры изготовлены из нереактивных материалов, таких как нержавеющая сталь, некоторые алюминиевые сплавы или темное стекло. [26]
Для безопасного обращения с концентрированными органическими пероксидами важным параметром является температура пробы, которую следует поддерживать ниже температуры самоускоряющегося разложения соединения. [27]
Перевозка органических пероксидов ограничена. Министерство транспорта США перечисляет ограничения на транспортировку органических пероксидов и запрещенные материалы в Таблице опасных материалов 49 CFR 172.101 в зависимости от концентрации и физического состояния материала:
| Химическое название | Номер CAS | Запреты |
|---|---|---|
| Пероксид ацетилацетона | 37187-22-7 | > 9% по массе активного кислорода |
| Ацетилбензоилпероксид | 644-31-5 | твердый или > 40% в растворе |
| Аскаридол | 512-85-6 | (органический пероксид) |
| трет -Бутилгидропероксид | 75-91-2 | > 90% в растворе (водном) |
| Ди-(1-нафтоил)пероксид | 29903-04-6 | |
| Диацетил пероксид | 110-22-5 | твердый или > 25% в растворе |
| Этил гидропероксид | 3031-74-1 | |
| Пероксид метилэтилкетона | 1338-23-4 | > 9% по массе активного кислорода в растворе |
| Пероксид метилизобутилкетона | 37206-20-5 | > 9% по массе активного кислорода в растворе |
См. также
[ редактировать ]Внешние ссылки
[ редактировать ]- Отдел безопасности производителей органических пероксидов
- Ответы по охране труда – органические пероксиды
- «Опасности пероксидов» . Каролина.com . Берлингтон, Северная Каролина: Компания по поставке биологических материалов Каролины. Архивировано из оригинала 18 декабря 2007 г.
- Европейская группа по безопасности органических пероксидов
Ссылки
[ редактировать ]- ^ Jump up to: а б Кленк, Герберт; Гетц, Питер Х.; Зигмайер, Райнер; Майр, Уилфрид. «Перекисные соединения органические». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a19_199.pub2 . ISBN 978-3527306732 .
- ^ Сол Патай, изд. (1983). Химия функциональных групп PATAI: пероксиды . Уайли. ISBN 9780470771730 .
- ^ «Блог Генри Рзепы: Почему не существует пероксида дифенила» .
- ^ Бах, Роберт Д.; Айяла, Филипп Ю.; Шлегель, Х.Б. (1996). «Переоценка энергии диссоциации связей пероксидов. Исследование ab initio ». Дж. Ам. хим. Соц. 118 (50): 12758–12765. дои : 10.1021/ja961838i .
- ^ Отто Экснер (1983). «Стереохимические и конформационные аспекты пероксисоединений». У Саула Патая (ред.). Химия функциональных групп ПАТАИ . Уайли. стр. 85–96. дои : 10.1002/9780470771730.ch2 . ISBN 9780470771730 .
- ^ Д.А. Кастил (1992). «Пероксидные натуральные продукты». Отчеты о натуральных продуктах . 9 (4): 289–312. дои : 10.1039/np9920900289 . ПМИД 1522977 .
- ^ Рузер, Кэрол А.; Марнетт, Лоуренс Дж. (2003). «Механизм свободнорадикального оксигенирования полиненасыщенных жирных кислот циклооксигеназами». Химические обзоры . 103 (6): 2239–2304. дои : 10.1021/cr000068x . ПМИД 12797830 .
- ^ Альдо Рода Хемилюминесценция и биолюминесценция: прошлое, настоящее и будущее , с. 57, Королевское химическое общество, 2010 г., ISBN 1-84755-812-7
- ^ Томас Брок, Майкл Гротеклас, Питер Мишке, Учебник по технологии окраски , Vincentz Network GmbH & Co KG, 2000, ISBN 3-87870-569-7 стр. 67
- ^ Органические пероксиды для полимеризации. Архивировано 29 июня 2016 г. в Wayback Machine . pergan.com (на немецком языке)
- ^ Обри, Жан-Мари; Пьерло, Кристель; Ригоди, Жан; Шмидт, Рейнхард (2003). «Обратимое связывание кислорода ароматическими соединениями». Отчеты о химических исследованиях . 36 (9): 668–675. дои : 10.1021/ar010086g . ПМИД 12974650 .
- ^ Хайнц Г.О. Беккер Органикум , Wiley-VCH, 2001, ISBN 3-527-29985-8 , с. 323
- ^ Криджи, Рудольф; Мюллер, Герхард (1956). «1,2-Диоксан». Химические отчеты . 89 (2): 238. doi : 10.1002/cber.19560890209 .
- ^ Jump up to: а б УСКСБ. «Оказавшись в шторме: экстремальные погодные опасности» . Ютуб . УСКСБ . Проверено 29 июня 2023 г.
- ^ Белый Нью-Джерси (1997). «Оценка фармакодинамических свойств противомалярийных препаратов in vivo» . Антимикроб. Агенты Чематер . 41 (7): 1413–22. дои : 10.1128/AAC.41.7.1413 . ПМЦ 163932 . ПМИД 9210658 .
- ^ Буланжер Д., Диенг И., Сиссе Б. и др. (2007). «Антисистосомальная эффективность комбинированной терапии артесунатом, применяемой в качестве лечения приступов малярии» . Trans R Soc Trop Med Hyg . 101 (2): 113–16. дои : 10.1016/j.trstmh.2006.03.003 . ПМИД 16765398 . S2CID 1675813 .
- ^ Чжу, Ненгбо; Яо, Хуэйцзе; Чжан, Сию; Бао, Хунли (2024). «Асимметричные реакции, катализируемые металлами, с участием органических пероксидов». Обзоры химического общества . 53 (5): 2326–2349. дои : 10.1039/D3CS00735A . ПМИД 38259195 .
- ^ Легради, Л.; Легради, Дж. (1970). «Обнаружение пероксидов, гидроперекисей и надкислот». Микрохимика Акта . 58 : 119–122. дои : 10.1007/BF01218105 . S2CID 101877371 .
- ^ Леа, CH (1931). «Влияние света на окисление жиров» . Труды Королевского общества B: Биологические науки . 108 (756): 175–189. Бибкод : 1931РСПСБ.108..175Л . дои : 10.1098/rspb.1931.0030 .
- ^ Вейбель, С. Анализ органических соединений , Akademie-Verlag, Берлин, 1960, с. 262
- ^ Эйсс, Мичиган; Гизеке, Пол (1959). «Колориметрическое определение органических пероксидов». Аналитическая химия . 31 (9): 1558. doi : 10.1021/ac60153a038 .
- ^ Хигучи, Т.; Цук, Дональд Антон (1951). «Поведение некоторых соединений как индикаторов при титровании функциональных групп литий-алюминийгидридом». Журнал Американского химического общества . 73 (6): 2676. doi : 10.1021/ja01150a073 .
- ^ Мартин, Эй Джей (1957). «Потенциометрическое титрование гидроперекиси и надкислоты в безводном этилендиамине». Аналитическая химия . 29 : 79–81. дои : 10.1021/ac60121a022 .
- ^ «ASTM E298, Стандартные методы анализа органических пероксидов» . АСТМ. 2010.
- ^ Хайнц Г.О. Беккер Органикум , Wiley-VCH, 2001, ISBN 3-527-29985-8 стр. 741–762.
- ^ Совместимость с пероксидом Ozonelab
- ^ «Управление продуктом» . Американский химический совет . 17 января 2021 г. Проверено 3 января 2022 г.


![{\displaystyle A[\mathrm {O} ]_{\text{theoretical}}(\%)=16{\frac {p}{m}}\times 100,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/176ebe20ba1c311442630b59225f66d03b08fe5f)