Вольтамперометрия

Вольтамперометрия — категория электроаналитических методов, используемых в аналитической химии и различных промышленных процессах. В вольтамперометрии информацию об аналите получают путем измерения тока при потенциала . изменении [1] [2] Аналитические данные для вольтамперометрического эксперимента представляют собой вольтамперограмму , которая отображает зависимость тока, производимого аналитом, от потенциала рабочего электрода . [3]
Теория
[ редактировать ]Вольтамперометрия — это исследование тока как функции приложенного потенциала. Вольтамперометрические методы включают электрохимические ячейки и исследуют реакции, происходящие на границе раздела электрод/электролит. [4] Реакционная способность аналитов в этих полуклетках используется для определения их концентрации. Это считается динамическим электрохимическим методом, поскольку приложенный потенциал изменяется с течением времени и измеряются соответствующие изменения тока. [4] В большинстве экспериментов контролируют потенциал ( вольты ) электрода, находящегося в контакте с аналитом, одновременно измеряя результирующий ток ( амперы ).
Электрохимические ячейки
[ редактировать ]Электрохимические ячейки используются в вольтамперометрических экспериментах для запуска окислительно-восстановительной реакции аналита. Как и в случае с другими электрохимическими элементами, требуются две полуячейки: одна для облегчения восстановления, а другая для окисления. Ячейка состоит из раствора аналита, ионного электролита и двух или трех электродов, при этом на границах раздела электрод/электролит происходят реакции окисления и восстановления. [5] Когда вещество окисляется, образующиеся электроны проходят через внешнюю электрическую цепь и генерируют ток, действуя как источник электронов для восстановления. Генерируемые токи представляют собой токи Фарадея, подчиняющиеся закону Фарадея. Поскольку закон Фарадея гласит, что количество молей вещества m, произведенного или потребленного во время электродного процесса, пропорционально электрическому заряду, прошедшему через электрод, токи Фарадея позволяют определять концентрации аналита. [6] Восстанавливается ли аналит или окисляется, зависит от аналита, но его реакция всегда происходит на рабочем/индикаторном электроде. Следовательно, потенциал рабочего электрода изменяется в зависимости от концентрации аналита. Второй вспомогательный электрод замыкает электрическую цепь. Третий электрод сравнения обеспечивает постоянное показание базового потенциала для сравнения потенциалов двух других электродов.
Трехэлектродная система
[ редактировать ]
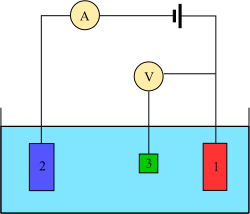
Вольтамперометрические эксперименты исследуют способность полуклеток аналита реакционную . Вольтамперометрия — это исследование тока как функции приложенного потенциала.Эти кривые I = f(E) называются вольтамперограммами.Потенциал изменяется произвольно, ступенчато или непрерывно, а результирующее значение тока измеряется как зависимая переменная.Противоположное явление, т. е. амперометрия , также возможно, но встречается нечасто.Форма кривых зависит от скорости изменения потенциала (природы движущей силы) и от того, перемешивается ли раствор или находится в состоянии покоя (массообмен).В большинстве экспериментов контролируют потенциал ( вольты ) электрода, находящегося в контакте с аналитом, одновременно измеряя результирующий ток ( амперы ). [7]
Для проведения такого эксперимента необходимо как минимум два электрода. , Рабочий электрод который контактирует с аналитом, должен прикладывать желаемый потенциал контролируемым образом и облегчать передачу заряда к аналиту и от него. Второй электрод действует как вторая половина ячейки. Этот второй электрод должен иметь известный потенциал, чтобы можно было измерить потенциал рабочего электрода; кроме того, он должен уравновешивать заряд, добавляемый или удаляемый рабочим электродом. Хотя это жизнеспособная установка, она имеет ряд недостатков. Самое главное, что электроду чрезвычайно трудно поддерживать постоянный потенциал при пропускании тока для противодействия окислительно-восстановительным процессам на рабочем электроде. [7]
Чтобы решить эту проблему, функции доставки электронов и создания опорного потенциала разделены между двумя отдельными электродами. Электрод сравнения представляет собой полуэлемент с известным восстановительным потенциалом. Его единственная роль — служить эталоном для измерения и контроля потенциала рабочего электрода, и он не пропускает ток. Вспомогательный электрод пропускает ток, необходимый для балансировки наблюдаемого тока на рабочем электроде. Для достижения такого тока вспомогательный ток часто достигает экстремальных значений потенциала на краях окна растворителя , где он окисляет или восстанавливает растворитель или опорный электролит. Эти электроды, рабочий , опорный и вспомогательный, составляют современную трехэлектродную систему. [7]
Существует множество систем с большим количеством электродов, но принципы их конструкции аналогичны трехэлектродной системе. Например, вращающийся кольцевой дисковый электрод имеет два отдельных рабочих электрода: диск и кольцо, которые можно использовать для сканирования или удержания потенциалов независимо друг от друга. Оба этих электрода сбалансированы одной комбинацией эталонного и вспомогательного электродов, что обеспечивает общую четырехэлектродную конструкцию. В более сложных экспериментах при необходимости могут добавляться рабочие электроды, электроды сравнения или вспомогательные электроды. [7]
На практике может оказаться важным иметь рабочий электрод с известными размерами и характеристиками поверхности. В результате рабочие электроды необходимо регулярно чистить и полировать. Вспомогательный электрод может быть практически любым, при условии, что он не вступает в реакцию с основной массой раствора аналита и хорошо проводит ток. Распространенный метод вольтамперометрии, полярография, использует ртуть в качестве рабочего электрода, например, ДМЭ и ГМДЭ , и в качестве вспомогательного электрода. Эталонный электрод — самый сложный из трех электродов; используются различные стандарты. Для неводных растворов ИЮПАК рекомендует использовать пару ферроцен / ферроцений в качестве внутреннего стандарта. [8] объемный электролит (также известный как опорный электролит В большинстве экспериментов по вольтамперометрии для минимизации сопротивления раствора используется ). Можно провести эксперимент без объемного электролита, но добавочное сопротивление значительно снижает точность результатов. В случае ионных жидкостей комнатной температуры растворитель может действовать как электролит. [7]
Вольтамперограммы
[ редактировать ]


Вольтамперограмма — это график, на котором измеряется ток в электрохимической ячейки зависимости от приложенного потенциала. [9] Этот график используется для определения концентрации и стандартного потенциала аналита. Для определения концентрации такие значения, как предельный или пиковый ток, считываются с графика и применяются к различным математическим моделям. [10] После определения концентрации приложенный стандартный потенциал можно определить с помощью уравнения Нернста. [10]
Существует три основные формы вольтамперограммы. Первая форма зависит от диффузионного слоя. [1] Если анализируемое вещество непрерывно перемешивать, диффузионный слой будет иметь постоянную ширину и давать вольтамперограмму, которая достигает постоянного тока. График принимает такую форму, когда ток увеличивается от фонового остатка до достижения предельного тока (i l ). Если смесь не перемешивать, ширина диффузионного слоя со временем увеличивается. Это можно наблюдать по максимальному пиковому току (i p ) и обозначается самой высокой точкой на графике. Третья распространенная форма вольтамперограммы измеряет в образце изменение тока, а не приложенного тока. Максимальный ток все еще наблюдается, но представляет собой максимальное изменение тока ( я п ). [10]
Математические модели
[ редактировать ]Для определения концентрации аналита необходимы математические модели, связывающие приложенный потенциал и ток, измеренный с течением времени. Уравнение Нернста связывает электрохимический потенциал ячейки с соотношением концентраций восстановленных и окисленных частиц в логарифмическом соотношении. [6] Уравнение Нернста имеет следующий вид:
Где:
- : Потенциал снижения
- : Стандартный потенциал
- : Универсальная газовая постоянная
- : Температура в Кельвинах
- : Заряд иона (моль электронов)
- : постоянная Фарадея
- : Коэффициент реакции
Это уравнение описывает, как изменения приложенного потенциала изменят соотношение концентраций. Однако уравнение Нернста ограничено, поскольку оно моделируется без временной составляющей, а в вольтамперометрических экспериментах приложенный потенциал изменяется в зависимости от времени. Другие математические модели, в первую очередь уравнение Батлера-Фольмера, уравнение Тафеля и закон Фика, учитывают зависимость от времени.
Уравнение Батлера-Фольмера связывает концентрацию, потенциал и ток как функцию времени. [5] Он описывает нелинейную зависимость между разностью напряжений на электроде и электролите и электрическим током. Это помогает делать прогнозы о том, как прямые и обратные окислительно-восстановительные реакции влияют на потенциал и реактивность клетки. [11] Эта функция включает константу скорости, которая учитывает кинетику реакции. Компактная версия уравнения Батлера-Фольмера выглядит следующим образом:
Где:
- : плотность электродного тока , А/м 2 (определяется как j = I/S )
- : плотность тока обмена , А/м 2
- : электродный потенциал , В
- : равновесный потенциал, В
- : абсолютная температура , К
- : количество электронов, участвующих в электродной реакции
- : постоянная Фарадея
- : универсальная газовая постоянная
- : так называемый катодный коэффициент переноса заряда , безразмерный
- : так называемый анодный коэффициент переноса заряда, безразмерный
- активации : перенапряжение (определяется как ).
При высоких перенапряжениях уравнение Батлера-Фольмера упрощается до уравнения Тафеля . Уравнение Тафеля экспоненциально связывает электрохимические токи с перенапряжением и используется для расчета скорости реакции. [11] Перенапряжение рассчитывается на каждом электроде отдельно и соотносится с данными вольтамперограммы для определения скорости реакции. Уравнение Тафеля для одного электрода:
Где:
- знак плюс под показателем степени относится к анодной реакции, а знак минус к катодной реакции.
- : overpotential , V
- A: " Tafel slope ", V
- : плотность тока , А/м 2
- : « плотность тока обмена », А/м 2 .
Поскольку окислительно-восстановительные соединения окисляются и восстанавливаются на электродах, материал накапливается на границе раздела электрод/электролит. [5] Накопление материала создает градиент концентрации между границей раздела и основным раствором. Законы диффузии Фика используются для того, чтобы связать диффузию окисленных и восстановленных частиц с фарадеевским током, используемым для описания окислительно-восстановительных процессов. Закон Фика чаще всего записывается в терминах кротов и выглядит следующим образом:
Где:
- J: диффузионный поток (в количестве вещества на единицу площади в единицу времени)
- D: коэффициент диффузии или коэффициент диффузии . (по площади в единицу времени)
- φ: концентрация (в количестве вещества на единицу объема)
- x: позиция (по длине)
Виды вольтамперометрии
[ редактировать ]| Тип вольтамперометрии | Описание |
|---|---|
| Линейная вольтамперометрия с разверткой | Любой вольтамперометрический метод, при котором потенциал на рабочем электроде изменяется линейно со временем, потенциал электрода сравнения остается постоянным и проводятся измерения тока на рабочем электроде . [12] |
| Лестничная вольтамперометрия | Специализированный метод вольтамперометрии с линейной разверткой , при котором напряжение подается в течение определенного периода времени, за которым следует измерение тока, а затем повторяется для изменения напряжения с использованием ступенчатой программы. [11] |
| Прямоугольная вольтамперометрия | Электрохимический метод, сочетающий в себе аспекты многих методов импульсной вольтамперометрии. Форма сигнала SWV аналогична форме сигнала DPV , но для интерпретации результатов форма сигнала анализируется как ступенчатое сканирование. [11] |
| Циклическая вольтамперометрия | Вольтамперометрический метод, который можно использовать для определения коэффициентов диффузии полуячейки и потенциалов восстановления . [13] |
| Анодная зачистная вольтамперометрия | Количественный аналитический метод следового анализа катионов металлов. Аналит осаждается ( наносится гальваническим способом ) на рабочий электрод на этапе осаждения, а затем окисляется на этапе удаления. Ток измеряется на этапе зачистки. [14] |
| Катодная инверсионная вольтамперометрия | Количественный аналитический метод анализа следов анионов. Прикладывается положительный потенциал, окисляющий ртутный электрод и образующий нерастворимые осадки анионов. Затем отрицательный потенциал восстанавливает (сбрасывает) осажденную пленку в раствор. [15] |
| Адсорбционная инверсионная вольтамперометрия | Количественный аналитический метод анализа следов. Аналит осаждается просто путем адсорбции на поверхности электрода (т.е. без электролиза), а затем подвергается электролизу для получения аналитического сигнала. Часто используются химически модифицированные электроды. [16] |
| Вольтамперометрия переменного тока | Тип циклической вольтамперометрии , при котором к электрохимической ячейке прикладывают небольшие синусоидальные колебания напряжения при изменении общего напряжения. [17] |
| Полярография | подкласс вольтамперометрии, в котором рабочим электродом является капающий ртутный электрод (ДМЭ), полезный благодаря своему широкому катодному диапазону и возобновляемой поверхности. [18] |
| Вольтамперометрия с вращающимся электродом | Гидродинамический метод, при котором рабочий электрод , обычно вращающийся дисковый электрод (RDE) или вращающийся кольцевой дисковый электрод (RRDE), вращается с очень высокой скоростью. метод полезен для изучения кинетики и механизма электрохимической реакции полуреакции Этот . [19] |
| Нормальная импульсная полярография | Электрохимический метод, при котором потенциал начинается с одного и того же значения для каждого шага, а амплитуда увеличивается для каждого последующего шага. Измерения тока проводятся в зависимости от времени и потенциала между индикаторным и эталонным электродами. [20] [21] |
| Нормальная импульсная вольтамперометрия | Электрохимический метод, который использует ту же форму сигнала, что и обычная импульсная полярография, но может использоваться для обозначения сигналов неполярографических электродов. [22] |
| Дифференциальная импульсная вольтамперометрия | Электрохимический метод аналогичен обычной импульсной вольтамперометрии , но приложенный базовый потенциал постоянно увеличивается или уменьшается, а соотношение высоты импульса к высоте базы остается постоянным. В DPV измерения тока проводятся дважды во время каждого падения: сначала непосредственно перед импульсом, а затем перед смещением капли. [11] |
| Хроноамперометрия | изменяется Тип электрохимического эксперимента, в котором потенциал на рабочем электроде , а ток регистрируется как функция времени. [11] |
История
[ редактировать ]Началу вольтамперометрии способствовало открытие полярографии в 1922 году чешским химиком, лауреатом Нобелевской премии Ярославом Гейровским . [23] Ранние вольтамперометрические методы имели множество проблем, ограничивавших их пригодность для повседневного использования в аналитической химии. В полярографии эти проблемы включали тот факт, что ртуть окисляется при потенциале, более положительном, чем +0,2 В, что затрудняет анализ результатов для аналитов в положительной области потенциала. Другая проблема заключалась в остаточном токе, возникающем при зарядке большой емкости поверхности электрода . [24] Когда в 1922 году Гейровский впервые зафиксировал первую зависимость тока, протекающего через падающий ртутный электрод, от приложенного потенциала, он провел поточечные измерения и построил вольт-амперную кривую. Это считалось первой полярограммой. Чтобы облегчить этот процесс, он вместе с М. Шикатой сконструировал то, что сейчас известно как полярограф, который позволил ему фотографически записать ту же кривую за считанные часы. Он признал важность потенциала и его контроля, а также признал возможности измерения предельных токов. Он также сыграл важную роль во внедрении падающего ртутного электрода в качестве современного инструмента. [25]
В 1942 году английский электрохимик Арчи Хиклинг ( Лестерский университет ) построил первые трехэлектродные потенциостаты , что стало достижением в области электрохимии. [26] Он использовал этот потенциостат для управления напряжением электрода. Тем временем, в конце 1940-х годов, американский биофизик Кеннет Стюарт Коул изобрел электронную схему, которую он назвал зажимом напряжения. Зажим напряжения использовался для анализа ионной проводимости в нервах . [27]
В 1960-е и 1970-е годы произошло много достижений в теории, приборостроении и внедрении компьютерных и управляемых систем. Современные полярографические и вольтамперометрические методы на ртутных электродах сложились в трех разделах.
Первый раздел включает разработку ртутных электродов. Были произведены следующие электроды: капающий ртутный электрод , ртутный паровой электрод, подвесной ртутный капельный электрод, статический ртутный капельный электрод, ртутный пленочный электрод, ртутно-амальгамные электроды, ртутные микроэлектроды, химически модифицированные ртутные электроды, ртутные электроды с контролируемым ростом и сжимающиеся ртутные капельные электроды. .
Произошло также развитие используемых методов измерения. Эти методы измерения включают в себя: классическую полярографию постоянного тока, осциллополярографию, переключатель Калусека, полярографию переменного тока, дегустационную полярографию, нормальную импульсную полярографию, дифференциальную импульсную полярографию, прямоугольную вольтамперометрию, циклическую вольтамперометрию , анодную вольтамперометрию , методы свертки и методы исключения.
Наконец, произошло развитие методов концентрирования, что привело к увеличению чувствительности ртутных электродов. Это стало возможным благодаря развитию анодной инверсионной вольтамперометрии , катодной инверсионной вольтамперометрии и адсорбционной инверсионной вольтамперометрии . [25]
Эти достижения повысили чувствительность и создали новые аналитические методы, что побудило промышленность отреагировать на это производством более дешевых потенциостатов , электродов и ячеек, которые можно было бы эффективно использовать в рутинной аналитической работе.
Приложения
[ редактировать ]Вольтамперометрические датчики
[ редактировать ]Ряд вольтамперометрических систем производится коммерчески для определения видов, представляющих интерес для промышленности и исследований. Эти устройства иногда называют электродами , но на самом деле они представляют собой полноценные вольтамперометрические ячейки, которые лучше называть датчиками . Эти датчики можно использовать для анализа органических и неорганических аналитов в различных матрицах. [28]
Кислородный электрод
[ редактировать ]Определение растворенного кислорода в различных водных средах, таких как морская вода, кровь, сточные воды, стоки химических заводов и почвы, имеет огромное значение для промышленности, биомедицинских и экологических исследований, а также клинической медицины. Одним из наиболее распространенных и удобных методов проведения таких измерений является использование датчика кислорода Кларка , который был запатентован Л.С. Кларком-младшим в 1956 году.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б Питер Т. Киссинджер; Уильям Р. Хейнеман, ред. (1996). Лабораторные методы электроаналитической химии (2-е изд.). Нью-Йорк: Марсель Деккер. ISBN 0-8247-9445-1 . OCLC 33359917 .
- ^ Зоски, Синтия Г. (7 февраля 2007 г.). Справочник по электрохимии . Эльзевир Наука. ISBN 978-0-444-51958-0 .
- ^ Харрис, Дэниел К. (01 января 2016 г.). Количественный химический анализ, девятое издание (9-е изд.). WH Фриман и компания. ISBN 978-1-4641-3538-5 .
- ^ Перейти обратно: а б с д и Харви, Дэвид (2000). Современная аналитическая химия . Бостон: МакГроу-Хилл. ISBN 0-07-237547-7 . OCLC 41070677 .
- ^ Перейти обратно: а б с Кунавес С.П., 1997. Вольтамперометрические методы. Справочник инструментальной техники аналитической химии , стр.709-726.
- ^ Перейти обратно: а б Шольц, Фриц (декабрь 2015 г.). «Вольтамперометрические методы анализа: основы» . Химтексты . 1 (4): 17. дои : 10.1007/s40828-015-0016-y . ISSN 2199-3793 . S2CID 98262000 .
- ^ Перейти обратно: а б с д и Бард, Аллен Дж.; Ларри Р. Фолкнер (18 декабря 2000 г.). Электрохимические методы: основы и приложения (2-е изд.). Уайли. ISBN 0-471-04372-9 .
- ^ Грицнер, Г.; Дж. Кута (1984). «Рекомендации по регистрации электродных потенциалов в неводных растворителях» . Чистое приложение. Хим . 56 (4): 461–466. дои : 10.1351/pac198456040461 . Проверено 17 апреля 2009 г.
- ^ «вольтамперограмма». Вольтамперограмма | инструмент | Британника . Британская энциклопедия . Проверено 24 октября 2022 г.
- ^ Перейти обратно: а б с Харви, Дэвид (2000). Современная аналитическая химия . Бостон: МакГроу-Хилл. ISBN 0-07-237547-7 . OCLC 41070677 .
- ^ Перейти обратно: а б с д и ж Бард, Аллен Дж. (2001). Электрохимические методы: основы и приложения . Ларри Р. Фолкнер (2-е изд.). Хобокен, Нью-Джерси. ISBN 0-471-04372-9 . OCLC 43859504 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Скуг, Дуглас А. (2018). Принципы инструментального анализа . Ф. Джеймс Холлер, Стэнли Р. Крауч (7-е изд.). Австралия. ISBN 978-1-305-57721-3 . OCLC 986919158 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ «11.4: Вольтамперометрические методы» . Химия LibreTexts . 24 декабря 2016 г. Проверено 9 ноября 2022 г.
- ^ Томас, ФГ (2001). Введение в вольтамперометрический анализ: теория и практика . Гюнтер Хенце. Коллингвуд, Вика: CSIRO Pub. ISBN 978-0-643-06593-2 . OCLC 711261475 .
- ^ Ахтерберг, Е.П.; Барриада, JL; Браунгардт, CB (2005), «ВОЛЬТАМЕТРИЯ | Катодная зачистка» , Энциклопедия аналитической науки , Elsevier, стр. 203–211, doi : 10.1016/b0-12-369397-7/00649-x , ISBN 978-0-12-369397-6 , получено 9 ноября 2022 г.
- ^ Ван, Джозеф (1985). Обнажающий анализ: принципы, инструменты и приложения . ВЧ. ISBN 0-89573-143-6 . OCLC 299394898 .
- ^ «Циклическая вольтамперометрия переменного тока» . Кафедра химической инженерии и биотехнологии . 14 ноября 2013 г. Проверено 22 октября 2022 г.
- ^ Рейнмут, штат Вашингтон (1 ноября 1961 г.). «Теория стационарной электродной полярографии» . Аналитическая химия . 33 (12): 1793–1794. дои : 10.1021/ac60180a004 . ISSN 0003-2700 .
- ^ Хольце, Рудольф (15 февраля 2002 г.). «Рецензия на книгу: Электрохимические методы. Основы и приложения (2-е издание). Аллена Дж. Барда и Ларри Р. Фолкнера». Angewandte Chemie, международное издание . 41 (4): 655–657. doi : 10.1002/1521-3773(20020215)41:4<655::aid-anie655>3.0.co;2-i . ISSN 1433-7851 .
- ^ «Онтология» . www.rsc.org . Проверено 23 октября 2022 г.
- ^ «Определение нормального_пульса_полярографии_нпп — Химический словарь» . www.chemicool.com . Проверено 23 октября 2022 г.
- ^ «Нормальная импульсная вольтамперометрия (NPV)» . Магазин исследовательских приборов «Сосна» . 06.03.2019 . Проверено 23 октября 2022 г.
- ^ Будников, ГК; Широкова, В.И. (05.12.2009). «История вольтамперометрии в России». Журнал аналитической химии . 64 (12): 1279. doi : 10.1134/S1061934809120144 . ISSN 1608-3199 . S2CID 93836045 .
- ^ Кунавес, Самуэль. «Вольтамперометрические методы». Химический факультет Университета Тафтса
- ^ Перейти обратно: а б Барек, Дж. (2003). «Восемьдесят лет полярографии - история и будущее». Электроанализ . 15 (5–6): 467–472. дои : 10.1002/elan.200390055 .
- ^ Хиклинг, А. (1942). «Исследования по поляризации электродов. Часть IV. Автоматический контроль потенциала рабочего электрода». Труды Фарадеевского общества . 38 : 27–33. дои : 10.1039/TF9423800027 .
- ^ Джексон Э. Харрар (2013). «Потенциостат и зажим напряжения» (PDF) . электрохим.орг . Проверено 15 декабря 2021 г.
- ^ Сангхави, Банким; Шривастава, Ашвини (2010). «Одновременное вольтамперометрическое определение ацетаминофена, аспирина и кофеина с использованием in situ электрода из пасты из многостенных углеродных нанотрубок, модифицированного поверхностно-активными веществами». Электрохимика Акта . 55 (28): 8638–8648. дои : 10.1016/j.electacta.2010.07.093 .
Дальнейшее чтение
[ редактировать ]- Рейнмут, штат Вашингтон (1 ноября 1961 г.). «Теория стационарной электродной полярографии». Аналитическая химия . 33 (12): 1793–1794. дои : 10.1021/ac60180a004 .
- Скуг, Дуглас А.; Дональд М. Уэст; Ф. Джеймс Холлер (25 августа 1995 г.). Основы аналитической химии (7-е изд.). Издательство Harcourt Brace College. ISBN 0-03-005938-0 .
- Занелло, П. (1 октября 2003 г.). Неорганическая электрохимия: теория, практика и применение (1-е изд.). Королевское химическое общество. ISBN 0-85404-661-5 .









![{\displaystyle {\displaystyle j=j_{0}\cdot \left\{\exp \left[{\frac {\alpha _{\rm {a}}zF\eta }{RT}}\right]-\ exp \left[-{\frac {\alpha _{\rm {c}}zF\eta }{RT}}\right]\right\}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/add16a7df4212623e9e012a948585d9b4b895281)










