Электрод

Электрод используемый — это электрический проводник, для контакта с неметаллической частью цепи ( например, полупроводником , электролитом , вакуумом или воздухом). Электроды являются важными частями батарей , которые могут состоять из различных материалов в зависимости от типа батареи.
Электрофор статического , изобретенный Йоханом Вильке , был ранней версией электрода, используемого для изучения электричества . [1]
Анод и катод в электрохимических ячейках [ править ]

Электроды являются неотъемлемой частью любого аккумулятора . Первая электрохимическая батарея была изобретена Алессандро Вольтой и получила название « Вольтов элемент» . [2] Эта батарея состояла из стопки медных и цинковых электродов, разделенных бумажными дисками, пропитанными рассолом . Из-за колебаний напряжения, обеспечиваемого гальваническим элементом, это было не очень практично. Первая практичная батарея была изобретена в 1839 году и названа ячейкой Дэниела в честь Джона Фредерика Дэниела . В нем по-прежнему использовалась комбинация цинк-медных электродов. С тех пор еще множество батарей было разработано с использованием различных материалов. В основе всего этого по-прежнему лежит использование двух электродов: анодов и катодов .
Анод [ править ]
Анод был придуман Уильямом Уэвеллом по Майкла Фарадея просьбе и образован от греческих слов ἄνο (ано), «вверх» и ὁδός (ходос), «путь». [3] Анод — это электрод, через который условный ток поступает из электрической цепи гальванического элемента (батареи) в неметаллический элемент . перетекают Затем электроны на другую сторону батареи. Бенджамин Франклин предположил, что электрический поток перемещается от положительного к отрицательному. [4] Электроны утекают от анода, а условный ток – к нему. Из обоих можно сделать вывод, что заряд анода отрицательный. Электрон, попадающий на анод, возникает в результате реакции окисления , протекающей рядом с ним.
Катод [ править ]
Катод во многом является противоположностью анода. Название (также придуманное Уэвеллом) происходит от греческих слов κάτω (като), «вниз» и ὁδός (ходос), «путь». Это положительный электрод, то есть электроны перетекают из электрической цепи через катод в неметаллическую часть гальванической ячейки. На катоде протекает реакция восстановления, при этом электроны, поступающие из провода, подключенного к катоду, поглощаются окислителем .
Первичная ячейка [ править ]

Первичный элемент — это батарея, предназначенная для однократного использования, а затем выбрасываемая. Это связано с тем, что электрохимические реакции, протекающие на электродах ячейки, необратимы. Примером первичного элемента является выбрасываемая щелочная батарея, обычно используемая в фонариках. Состоит из цинкового анода и катода из оксида марганца, в котором образуется ZnO.
Полуреакции:
- Zn (s) + 2OH − ( вод ) → ZnO (т) + Н 2 О (ж) + 2е − [И 0 окисление = -1,28 В]
- 2MnO2 т) + H2O ( (ж) + 2е − → Mn 2 O 3(s) + 2OH − (вода) [И 0 снижение = +0,15 В]
Общая реакция:
- Zn (тв) + 2MnO 2(тв) ⇌ ZnO (тв) + Mn 2 O 3(тв) [И 0 total = +1.43 V]
ZnO склонен к комкованию, и при повторной перезарядке его разрядка будет менее эффективной. Эти батареи можно заряжать, но это связано с соображениями безопасности, которые не рекомендует производитель. Другие первичные элементы включают цинк-углеродные , цинк-хлоридные и дисульфид лития-железа.
Вторичная ячейка [ править ]


В отличие от первичного аккумулятора, вторичный аккумулятор можно перезаряжать. Первым был свинцово-кислотный аккумулятор , изобретенный в 1859 году французским физиком Гастоном Планте . Этот тип аккумулятора по-прежнему наиболее широко используется в автомобилях. [5] Катод состоит из диоксида свинца (PbO2), а анод – из твердого свинца. Другими широко используемыми аккумуляторными батареями являются никель-кадмиевые , никель-металлогидридные и литий-ионные . Последний из которых будет объяснен более подробно в этой статье ввиду его важности.
Маркуса Теория электрона переноса
Теория Маркуса — это теория, первоначально разработанная нобелевским лауреатом Рудольфом А. Маркусом и объясняющая скорость, с которой электрон может переходить от одного химического вида к другому. [6] в данной статье это можно рассматривать как «переход» от электрода к веществу в растворителе или наоборот.Мы можем представить задачу как вычисление скорости передачи электрона от донора к акцептору.
- Д + А → Д + + А −

Потенциальная энергия системы является функцией поступательных, вращательных и колебательных координат реагирующих веществ и молекул окружающей среды, которые вместе называются координатами реакции. Абсцисса на рисунке справа представляет это. Из классической теории переноса электрона выражение константы скорости реакции (вероятности реакции) можно вычислить, если предположить неадиабатический процесс и параболическую потенциальную энергию, найдя точку пересечения (Q x ). Следует отметить одну важную вещь, которую отметил Маркус, когда он придумал теорию: перенос электрона должен подчиняться закону сохранения энергии и принципу Франка-Кондона. Выполнение этого и последующая перестановка приводят к выражению активации свободной энергии ( ) через общую свободную энергию реакции ( ).
В котором – энергия реорганизации.Заполнение этого результата в классическом уравнении Аррениуса
приводит к
Поскольку A является предэкспоненциальным фактором, который обычно определяется экспериментально, [7] хотя полуклассический вывод дает больше информации, как будет объяснено ниже.
Этот классический результат качественно воспроизводил наблюдения максимальной скорости переноса электронов при условиях . [8] Для более обширного математического рассмотрения можно прочитать статью Ньютона. [9] Интерпретация этого результата и какой более пристальный взгляд на физический смысл можно прочитать статью Маркуса. [10]
рассматриваемую ситуацию можно более точно описать, используя модель смещенного гармонического осциллятора, в этой модели квантовое туннелирование допускается . Это нужно для того, чтобы объяснить, почему даже при околонулевых Кельвинах все еще происходят переносы электронов. [11] в противоречии с классической теорией.
Не вдаваясь в подробности того, как осуществляется этот вывод, отметим, что он основан на использовании золотого правила Ферми из нестационарной теории возмущений с полным гамильтонианом системы. Можно посмотреть на перекрытие волновых функций как реагентов, так и продуктов (правая и левая стороны химической реакции) и, следовательно, когда их энергии одинаковы и допускают перенос электрона. Как уже говорилось ранее, это должно произойти, потому что только тогда соблюдается закон сохранения энергии. Пропуская несколько математических шагов, вероятность переноса электрона можно вычислить (хотя и довольно сложно) по следующей формуле
С константа электронной связи, описывающая взаимодействие между двумя состояниями (реагентами и продуктами) и является функцией формы линии . Приняв классический предел этого выражения, т.е. , и после некоторой замены получается выражение, очень похожее на классическую формулу, как и ожидалось.
Основное отличие заключается в том, что теперь предэкспоненциальный фактор теперь описывается большим количеством физических параметров вместо экспериментального фактора. . Еще раз следует обратиться к источникам, перечисленным ниже, для более глубокого и строгого математического вывода и интерпретации.
Эффективность [ править ]
Физические свойства электродов в основном определяются материалом электрода и топологией электрода. Требуемые свойства зависят от применения, поэтому в обращении имеется множество типов электродов. Определяющим свойством материала, который будет использоваться в качестве электрода, является то, что он является проводящим . любой проводящий материал, такой как металлы, полупроводники , графит или проводящие полимеры Поэтому в качестве электрода можно использовать . Часто электроды состоят из комбинации материалов, каждый из которых выполняет определенную задачу. Типичными компонентами являются активные материалы, которые служат окисляющими или восстанавливающими частицами, проводящие агенты , улучшающие проводимость электрода, и связующие вещества, которые используются для удержания активных частиц внутри электрода. Об эффективности электрохимических элементов судят по ряду свойств, важными величинами являются время саморазряда , напряжение разряда и производительность цикла . Физические свойства электродов играют важную роль в определении этих величин. Важными свойствами электродов являются: электрическое сопротивление , удельная теплоемкость (c_p), электродный потенциал и твердость . Конечно, для технологических применений стоимость материала также является важным фактором. [12] Значения этих свойств при комнатной температуре (Т = 293 К) для некоторых часто используемых материалов приведены в таблице ниже.
| Характеристики | Литий (Li) | Марганец (Mn) | CopperМедь | Цинк (Zn) | Графит |
|---|---|---|---|---|---|
| Удельное сопротивление (Ом·м) | 8.40е-8 | 1.44e-6 | 1.70е-8 | 5.92е-8 | 6.00e-6 |
| Электродный потенциал (В) | -3.02 | -1.05 | -0.340 | -0.760 | - |
| Твердость (ВН) | <5 | 500 | 50 | 30 | 7-11 |
| Удельная теплоемкость (Дж/(гК)) | 2.997 | 0.448 | 0.385 | 0.3898 | 0.707 |
Поверхностные эффекты [ править ]
Топология поверхности электрода играет важную роль в определении эффективности электрода. Эффективность электрода может снизиться из-за контактного сопротивления . Поэтому для создания эффективного электрода важно спроектировать его так, чтобы минимизировать контактное сопротивление.
Производство [ править ]
Производство электродов для литий-ионных аккумуляторов осуществляется в несколько этапов: [14]
- Различные компоненты электрода смешиваются с растворителем. Эта смесь разработана таким образом, чтобы улучшить характеристики электродов. Обычными компонентами этой смеси являются:
- Активные электродные частицы.
- Связующее, используемое для удержания частиц активного электрода.
- Проводящий агент, используемый для улучшения проводимости электрода.
- Созданная смесь известна как «электродная суспензия».
- Вышеупомянутую электродную суспензию наносят на проводник, который действует как коллектор тока в электрохимической ячейке. Типичные коллекторы тока изготавливаются из меди для катода и алюминия для анода.
- После нанесения суспензии на проводник ее сушат, а затем прессуют до необходимой толщины.
Строение электрода [ править ]
При данном выборе составляющих электрода конечный КПД определяется внутренней структурой электрода. Важными факторами внутренней структуры, определяющими рабочие характеристики электрода, являются: [15]
- Кластеризация активного материала и проводящего агента. Чтобы все компоненты суспензии выполнили свою задачу, все они должны быть равномерно распределены внутри электрода.
- Равномерное распределение проводящего агента по активному материалу. Это гарантирует оптимальную проводимость электрода.
- Прилегание электрода к токосъемникам. Приклеивание гарантирует, что электрод не растворится в электролите.
- Плотность активного материала. Следует найти баланс между количеством активного материала, проводящего агента и связующего. Поскольку активный материал является важным фактором в электроде, суспензия должна быть разработана так, чтобы плотность активного материала была как можно выше, чтобы проводящий агент и связующее не функционировали должным образом.
На эти свойства можно влиять при производстве электродов различными способами. Самым важным этапом производства электродов является создание электродной суспензии. Как видно выше, все важные свойства электрода связаны с равномерным распределением компонентов электрода. Поэтому очень важно, чтобы электродная суспензия была максимально однородной. Для улучшения этой стадии смешивания было разработано множество процедур, и текущие исследования все еще продолжаются. [15]
Электроды в литий-ионных аккумуляторах [ править ]
Современное применение электродов – литий-ионные аккумуляторы (Li-ion аккумуляторы). Литий-ионная батарея — это разновидность проточной батареи , которую можно увидеть на изображении справа.
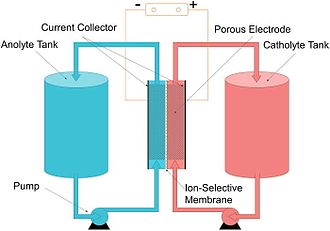
Кроме того, литий-ионная батарея является примером вторичного элемента, поскольку она перезаряжается. Он может действовать как гальванический или электролитический элемент . В литий-ионных батареях в качестве растворенного вещества электролита используются ионы лития, растворенные в органическом растворителе . Литиевые электроды были впервые изучены Гилбертом Н. Льюисом и Фредериком Г. Кизом в 1913 году. [17] В следующем столетии эти электроды были использованы для создания и изучения первых литий-ионных аккумуляторов. Литий-ионные аккумуляторы пользуются большой популярностью благодаря своим отличным характеристикам. Приложения включают мобильные телефоны и электромобили. Из-за их популярности проводится много исследований по снижению стоимости и повышению безопасности литий-ионных аккумуляторов. Неотъемлемой частью литий-ионных аккумуляторов являются их аноды и катоды, поэтому проводится много исследований по повышению эффективности, безопасности и снижению стоимости именно этих электродов. [18]
Катоды [ править ]
В литий-ионных батареях катод состоит из интеркалированного соединения лития (слоистого материала, состоящего из слоев молекул, состоящих из лития и других элементов). Общим элементом, составляющим часть молекул соединения, является кобальт . Другой часто используемый элемент — марганец . Лучший выбор компаунда обычно зависит от применения аккумулятора. Преимущества соединений на основе кобальта перед соединениями на основе марганца заключаются в их высокой удельной теплоемкости, высокой объемной теплоемкости , низкой скорости саморазряда, высоком разрядном напряжении и высокой циклической долговечности. Однако существуют и недостатки использования соединений на основе кобальта, такие как их высокая стоимость и низкая термостабильность . Марганец имеет аналогичные преимущества и более низкую стоимость, однако существуют некоторые проблемы, связанные с его использованием. Основная проблема заключается в том, что марганец имеет тенденцию со временем растворяться в электролите. По этой причине кобальт по-прежнему является наиболее распространенным элементом, который используется в соединениях лития. В настоящее время проводится много исследований по поиску новых материалов, которые можно использовать для создания более дешевых и долговечных литий-ионных батарей. [18]
Аноды [ править ]
Аноды, используемые в массово выпускаемых литий-ионных батареях, изготавливаются либо на основе углерода (обычно графита), либо из шпинели-титаната лития (Li 4 Ti 5 O 12 ). [18] Графитовые аноды успешно используются во многих современных коммерчески доступных батареях благодаря своей низкой цене, долговечности и высокой плотности энергии. [19] Однако при этом возникают проблемы роста дендритов, что сопряжено с риском короткого замыкания батареи и создания проблем с безопасностью. [20] Li 4 Ti 5 O 12 занимает вторую по величине долю рынка анодов благодаря своей стабильности и хорошей производительности, но с такими проблемами, как низкая емкость. [21] В начале 2000-х годов исследования кремниевых анодов начали набирать обороты, став одним из наиболее многообещающих кандидатов десятилетия для будущих анодов литий-ионных батарей. [22] Кремний обладает одной из самых высоких весовых емкостей по сравнению с графитом и Li 4 Ti 5 O 12 , а также высокой объемной емкостью. Кроме того, кремний имеет то преимущество, что работает при разумном напряжении холостого хода без паразитных реакций лития. [23] [24] Однако кремниевые аноды сталкиваются с серьезной проблемой объемного расширения во время литиирования, составляющего около 360%. [25] Это расширение может привести к измельчению анода, что приведет к снижению производительности. [26] Чтобы решить эту проблему, ученые попытались изменить размерность Si. [22] Многие исследования были проведены в отношении кремниевых нанопроволок , кремниевых трубок, а также кремниевых листов. [22] В результате композитные иерархические кремниевые аноды стали основной технологией будущего применения в литий-ионных батареях. В начале 2020-х годов технология достигает коммерческого уровня: в США строятся заводы по массовому производству анодов. [27] Кроме того, металлический литий является еще одним возможным кандидатом на роль анода. Он может похвастаться более высокой удельной емкостью, чем кремний, однако имеет тот недостаток, что работает с очень нестабильным металлическим литием. [28] Как и в случае с графитовыми анодами, образование дендритов является еще одним серьезным ограничением металлического лития, при этом граница раздела с твердым электролитом является серьезной проблемой при проектировании. [29] В конце концов, если стабилизировать металлический литий, можно будет производить батареи, которые сохранят наибольший заряд, но при этом будут самыми легкими. [28]
Механические свойства [ править ]
Распространенным механизмом отказа аккумуляторов является механический удар, который разрушает либо электрод, либо контейнер системы, что приводит к плохой проводимости и утечке электролита. [30] Однако значимость механических свойств электродов выходит за рамки устойчивости к столкновениям с окружающей средой. При стандартной работе попадание ионов в электроды приводит к изменению объема. Это хорошо иллюстрируется кремниевыми электродами в литий-ионных батареях, которые во время литиирования расширяются примерно на 300%. [31] Такое изменение может привести к деформациям решетки и, следовательно, к напряжениям в материале. Происхождение напряжений может быть связано с геометрическими ограничениями электрода или неоднородностью покрытия иона. [32] Это явление вызывает большую тревогу, поскольку может привести к поломке электрода и потере производительности. Таким образом, механические свойства имеют решающее значение для разработки новых электродов для аккумуляторов с длительным сроком службы. Возможная стратегия измерения механического поведения электродов во время работы — использование наноиндентирования . [33] Этот метод позволяет анализировать, как напряжения развиваются во время электрохимических реакций, что является ценным инструментом для оценки возможных путей взаимодействия механического поведения и электрохимии.
Напряжения могут влиять не только на морфологию электрода, но и на электрохимические реакции. [32] [34] Хотя химические движущие силы обычно превышают по величине механическую энергию, это не относится к литий-ионным батареям. [35] Исследование доктора Ларше установило прямую связь между приложенным напряжением и химическим потенциалом электрода. [36] Хотя он пренебрегает множеством переменных, таких как изменение упругих ограничений, он вычитает из общего химического потенциала упругую энергию, вызванную напряжением.
В этом уравнении μ представляет собой химический потенциал, а μ° — его опорное значение. T означает температуру, а k Больцмана — постоянную . Член γ внутри логарифма представляет собой активность, а x представляет собой отношение иона к общему составу электрода. Новый термин Ω представляет собой парциальный молярный объем иона в хозяине, а σ соответствует среднему напряжению, испытываемому системой. Результатом этого уравнения является то, что на диффузию, которая зависит от химического потенциала, влияет дополнительное напряжение и, следовательно, изменяется производительность батареи. Кроме того, механические напряжения также могут воздействовать на межфазный слой твердого электролита. [30] Интерфейс, который регулирует перенос ионов и зарядов, может разрушаться под воздействием напряжения. Таким образом, на его реформирование будет расходоваться больше ионов в растворе, что снижает общую эффективность системы. [37]
Другие аноды и катоды [ править ]
В вакуумной лампе или полупроводнике, имеющем полярность ( диоды , электролитические конденсаторы ), анодом является положительный (+) электрод, а катодом — отрицательный (-). Электроны входят в устройство через катод и выходят из устройства через анод. Многие устройства имеют другие электроды для управления работой, например, базу, затвор, управляющую сетку.
В трехэлектродной ячейке противоэлектрод, также называемый вспомогательным электродом , используется только для соединения с электролитом, чтобы ток можно было подать на рабочий электрод . Противоэлектрод обычно изготавливается из инертного материала, такого как благородный металл или графит , чтобы предотвратить его растворение.
Сварочные электроды [ править ]
При дуговой сварке электрод используется для проведения тока через заготовку и соединения двух деталей вместе. В зависимости от процесса электрод бывает либо плавящимся, в случае газовой дуговой сварки или сварки защитным металлом , либо неплавящимся, например, при газовой вольфрамовой дуговой сварке . В системе постоянного тока сварочный стержень или палочка могут быть катодом для сварного шва заполняющего типа или анодом для других сварочных процессов. Для дуговой сварки переменного тока сварочный электрод не считается анодом или катодом.
Электроды переменного тока [ править ]
В электрических системах, использующих переменный ток , электроды представляют собой соединения схемы с объектом, на который будет воздействовать электрический ток, но не называются анодом или катодом, поскольку направление потока электронов периодически меняется , обычно много раз в секунду. .
Химически модифицированные электроды [ править ]
Химически модифицированные электроды электрода — это электроды, поверхность которых химически модифицирована для изменения физических , химических , электрохимических , оптических , электрических и транспортных свойств . Эти электроды используются для передовых целей в исследованиях и исследованиях. [38]
Использует [ править ]
Электроды используются для подачи тока через неметаллические объекты, для их изменения различными способами, а также для измерения проводимости в различных целях. Примеры включают в себя:
- Электроды для топливных элементов
- Электроды для медицинских целей, такие как ЭЭГ (для записи активности мозга), ЭКГ (запись сердечных сокращений ), ЭСТ (электрическая стимуляция мозга), дефибриллятор (запись и проведение сердечной стимуляции)
- Электроды для электрофизиологических методов биомедицинских исследований
- Электроды для казни на электрическом стуле
- Электроды для гальваники
- Электроды для дуговой сварки
- Электроды для катодной защиты
- Электроды для заземления
- для химического анализа электрохимическими Электроды методами
- Наноэлектроды для высокоточных измерений в наноэлектрохимии
- Инертные электроды для электролиза (из платины )
- Мембранный электрод в сборе
- Электроды для Taser электрошокового оружия
См. также [ править ]
Ссылки [ править ]
- ^ Уитакер, Гарри (2007). Мозг, разум и медицина: Очерки нейробиологии восемнадцатого века . Нью-Йорк, штат Нью-Йорк: Спрингер. п. 140. ИСБН 978-0387709673 .
- ^ Беллис, Мэри. Биография Алессандро Вольты – Накопленное электричество и первая батарея.
- ^ Росс, С. (30 ноября 1961 г.). «Фарадей консультируется с учеными: истоки терминов электрохимии». Заметки и отчеты Лондонского королевского общества . 16 (2): 187–220. дои : 10.1098/rsnr.1961.0038 . S2CID 145600326 .
- ^ Обычный ток и поток электронов. (2021, 12 сентября). Общественный колледж долины Мохок. https://eng.libretexts.org/@go/page/25106
- ^ «Описание 4 типов аккумуляторных батарей» . Батарея РБ . 2 июня 2020 г.
- ^ «Реакции переноса электрона в химии: теория и эксперимент» . Нобелевский фонд . 8 декабря 1992 года . Проверено 2 апреля 2007 г.
- ^ Голд, Виктор, изд. (2019). «Сборник химической терминологии ИЮПАК» . дои : 10.1351/goldbook .
- ^ «Теория Маркуса для переноса электрона» . 12 декабря 2020 г. Проверено 24 января 2021 г.
- ^ Ньютон, Маршалл Д. (1991). «Квантово-химические исследования кинетики переноса электрона: природа донорно-акцепторных взаимодействий». Химические обзоры . 91 (5): 767–792. дои : 10.1021/cr00005a007 .
- ^ Маркус, Рудольф А. (1993). «Реакции переноса электрона в химии. Теория и эксперимент» . Обзоры современной физики . 65 (3): 599–610. Бибкод : 1993РвМП...65..599М . дои : 10.1103/RevModPhys.65.599 .
- ^ ДеВо, Д. (1984) Квантово-механическое туннелирование в биологических системах; Издательство Кембриджского университета: Кембридж.
- ^ Инжиниринг360. «Руководство по выбору электродов и электродных материалов: типы, особенности, применение» . www.globalspec.com .
- ^ «Информационный ресурс интернет-материалов» . www.matweb.com .
- ^ Хоули, В. Блейк; Ли, Цзяньлинь (2019). «Производство электродов для литий-ионных батарей — анализ технологий обработки текущего и следующего поколения» . Журнал хранения энергии . 25 : 100862. дои : 10.1016/j.est.2019.100862 . ОСТИ 1546514 . S2CID 201301519 .
- ↑ Перейти обратно: Перейти обратно: а б Конда, Кумари; Мудакаре, Сахана Б.; Кумар, П. Логеш; Баттабьял, Манджуша; Сет, Джиоти Р.; Ювекар, Винай А.; Гопалан, Рагхаван (2020). «Комплексные усилия по приготовлению электродной суспензии для улучшения электрохимических характеристик батареи LiFePO 4 ». Журнал источников энергии . 480 : 228837. Бибкод : 2020JPS...48028837K . дои : 10.1016/j.jpowsour.2020.228837 . S2CID 224980374 .
- ^ Ци, Чжаосян; Кениг, Гэри М. (12 мая 2017 г.). «Обзорная статья: Проточные аккумуляторные системы с твердыми электроактивными материалами» . Журнал вакуумной науки и технологий B. 35 (4): 040801. Бибкод : 2017JVSTB..35d0801Q . дои : 10.1116/1.4983210 . ISSN 2166-2746 .
- ^ Льюис, Гилберт Н.; Киз, Фредерик Г. (1913). «Потенциал литиевого электрода» . Журнал Американского химического общества . 35 (4): 340–344. дои : 10.1021/ja02193a004 .
- ↑ Перейти обратно: Перейти обратно: а б с Кам, Кинсон К.; Доефф, Марка М., «Электродные материалы для литий-ионных батарей» , Техническая документация Sigma-Aldrich: лабораторные и производственные материалы.
- ^ Чжан, Хао; Ян, Ян; Рен, Дуншэн; Ван, Ли; Хэ, Сянмин (01 апреля 2021 г.). «Графит как анодный материал: фундаментальный механизм, последние достижения и достижения» . Материалы для хранения энергии . 36 : 147–170. дои : 10.1016/j.ensm.2020.12.027 . ISSN 2405-8297 . S2CID 233072977 .
- ^ Чжао, Цян; Хао, Сяогэ; Су, Шиминг; Ма, Цзябин; Ху, Йи; Лю, Юн; Канг, Фейю; Хэ, Ян-Бин (2019). «Расширенный графит, встроенный в металлический литий, в качестве бездендритного анода литий-металлических батарей» . Журнал химии материалов А. 7 (26): 15871–15879. дои : 10.1039/C9TA04240G . ISSN 2050-7488 . S2CID 195381622 .
- ^ Чжан, Хао; Ян, Ян; Сюй, Хун; Ван, Ли; Лу, Ся; Хэ, Сянмин (апрель 2022 г.). «Шпинелевой анод Li 4 Ti 5 O 12: основы и достижения в области аккумуляторных батарей» . Инфомат . 4 (4). дои : 10.1002/inf2.12228 . ISSN 2567-3165 .
- ↑ Перейти обратно: Перейти обратно: а б с Цзо, Сюся; Чжу, Цзинь; Мюллер-Бушбаум, Питер; Ченг, Я-Цзюнь (01 января 2017 г.). «Аноды литий-ионных аккумуляторов на основе кремния: хронический перспективный обзор» . Нано Энергия . 31 : 113–143. дои : 10.1016/j.nanoen.2016.11.013 . ISSN 2211-2855 .
- ^ Чжан, Вэй-Цзюнь (1 января 2011 г.). «Обзор электрохимических характеристик сплавов анодов для литий-ионных аккумуляторов» . Журнал источников энергии . 196 (1): 13–24. дои : 10.1016/j.jpowsour.2010.07.020 . ISSN 0378-7753 .
- ^ Лян, Бо; Лю, Яньпин; Сюй, Юньхуа (01 декабря 2014 г.). «Материалы на основе кремния в качестве анодов высокой емкости для литий-ионных аккумуляторов нового поколения» . Журнал источников энергии . 267 : 469–490. дои : 10.1016/j.jpowsour.2014.05.096 . ISSN 0378-7753 .
- ^ Ли, Сяолинь; Гу, Мэн; Ху, Шэньян; Кеннард, Рианнон; Ян, Пэнфэй; Чен, Силинь; Ван, Чхонмин; Моряк, Майкл Дж.; Чжан, Цзи-Гуан; Лю, Цзюнь (08 июля 2014 г.). «Мезопористая кремниевая губка как противопыльная структура для анодов высокопроизводительных литий-ионных аккумуляторов» . Природные коммуникации . 5 (1): 4105. doi : 10.1038/ncomms5105 . ISSN 2041-1723 . ПМИД 25001098 .
- ^ Чжан, Хуэйган; Браун, Пол В. (13 июня 2012 г.). «Трехмерные металлические каркасы, поддерживающие двунепрерывные аноды кремниевых батарей» . Нано-буквы . 12 (6): 2778–2783. дои : 10.1021/nl204551m . ISSN 1530-6984 . ПМИД 22582709 .
- ^ Онсман, Алан. «Бывший инженер Tesla строит завод по производству кремниевых анодов, а США наращивают производство аккумуляторов для электромобилей» . Форбс . Проверено 19 ноября 2022 г.
- ↑ Перейти обратно: Перейти обратно: а б Алекс Скотт (7 апреля 2019 г.). «В мире аккумуляторных материалов пришло время анода» . cen.acs.org . Проверено 19 ноября 2022 г.
- ^ Лю, Бин; Чжан, Цзи-Гуан; Сюй, Ву (16 мая 2018 г.). «Развитие литий-металлических батарей» . Джоуль . 2 (5): 833–845. дои : 10.1016/j.joule.2018.03.008 . ISSN 2542-4785 .
- ↑ Перейти обратно: Перейти обратно: а б Паласин, MR; де Гиберт, А. (05 февраля 2016 г.). «Почему батарейки выходят из строя?» . Наука . 351 (6273): 1253292. doi : 10.1126/science.1253292 . hdl : 10261/148077 . ISSN 0036-8075 . ПМИД 26912708 . S2CID 11534630 .
- ^ Ли, Давэй; Ван, Икай; Ху, Цзячжи; Лу, Бо; Ченг, Ян-Цзы; Чжан, Цзюньцянь (31 октября 2017 г.). «Измерение механических свойств и эволюции напряжения в композитном кремниевом электроде на месте» . Журнал источников энергии . 366 : 80–85. Бибкод : 2017JPS...366...80L . дои : 10.1016/j.jpowsour.2017.09.004 . ISSN 0378-7753 .
- ↑ Перейти обратно: Перейти обратно: а б Сюй, Ронг; Чжао, Кэджи (12 декабря 2016 г.). «Электрохемомеханика электродов в литий-ионных аккумуляторах: обзор» . Журнал электрохимического преобразования и хранения энергии . 13 (3). дои : 10.1115/1.4035310 . ISSN 2381-6872 .
- ^ де Васконселос, Луиза Скалько; Сюй, Ронг; Чжао, Кеджи (2017). «Операндо-наноиндентирование: новая платформа для измерения механических свойств электродов во время электрохимических реакций» . Журнал Электрохимического общества . 164 (14): А3840–А3847. дои : 10.1149/2.1411714jes . ISSN 0013-4651 . S2CID 102588028 .
- ^ Чжао, Кеджи; Фарр, Мэтт; Цай, Шэнцян; Власак, Йост Дж.; Суо, Чжиган (июнь 2011 г.). «Большая пластическая деформация в литий-ионных аккумуляторах большой емкости, вызванная зарядом и разрядом: Большая пластическая деформация в литий-ионных аккумуляторах» . Журнал Американского керамического общества . 94 : с226–с235. дои : 10.1111/j.1551-2916.2011.04432.x .
- ^ Спепен *, Ф. (11 сентября 2005 г.). «Обзор энергий в материаловедении» . Философский журнал . 85 (26–27): 2979–2987. Бибкод : 2005PMag...85.2979S . дои : 10.1080/14786430500155080 . ISSN 1478-6435 . S2CID 220330377 .
- ^ Ларше, Ф; Кан, Дж. В. (1 августа 1973 г.). «Линейная теория термохимического равновесия твердых тел под напряжением» . Акта Металлургика . 21 (8): 1051–1063. дои : 10.1016/0001-6160(73)90021-7 . ISSN 0001-6160 .
- ^ Чжао, Кеджи; Цуй, И (01 декабря 2016 г.). «Понимание роли механики в энергетических материалах: перспектива» . Письма по экстремальной механике . Механика энергетических материалов. 9 : 347–352. дои : 10.1016/j.eml.2016.10.003 . ISSN 2352-4316 .
- ^ Дерст Р., Баумнер А., Мюррей Р., Бак Р. и Андриё К., « Химически модифицированные электроды: рекомендуемая терминология и определения (PDF). Архивировано 1 февраля 2014 г. в Wayback Machine » , ИЮПАК, 1997, стр. 1317–1323.
Дальнейшее чтение [ править ]
- Кебеде, Месфин А.; Эзема, Фабиан И., ред. (2022). Электродные материалы для хранения и преобразования энергии (Первое изд.). Бока-Ратон: CRC Press/Тейлор и Фрэнсис. дои : 10.1201/9781003145585 . ISBN 978-0-367-70304-2 . S2CID 240536462 .
- Доефф, ММ; Чен, Г; Кабана, Дж; Ричардсон, Ти Джей; Мехта, А; Ширпур, М; Дункан, Х; Ким, С; Кам, КК; Конри, Т. (11 ноября 2013 г.). «Характеристика электродных материалов для литий-ионных и натрий-ионных аккумуляторов методами синхротронного излучения» . Журнал визуализированных экспериментов (81): e50594. дои : 10.3791/50594 . ПМЦ 3989498 . ПМИД 24300777 .







![{\displaystyle k=A\,\exp \left[{\frac {-(\Delta G^{0}+\lambda)^{2}}{4\lambda kT}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d5dce1cabe338c7c99de9017275f3f525aecd1f5)





![{\displaystyle w_{ET}={\frac {|J|^{2}}{\hbar }}{\sqrt {\frac {\pi }{\lambda kT}}}\exp \left[{\frac {-(\Delta E+\lambda )^{2}}{4\lambda kT}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a9ac3bceea415577318ca69fea5d6a3073d9f81)


