Митохондриальная теория старения
Митохондриальная теория старения имеет две разновидности: свободнорадикальную и несвободнорадикальную. Первый — один из вариантов свободнорадикальной теории старения. Он был сформулирован Ж. Микелем и его коллегами в 1980 г. [1] и был развит в работах Линнана и его коллег (1989). [2] Второй был предложен А. Н. Лобачевым в 1978 г. [3]
Митохондриальная свободнорадикальная теория старения ( MFRTA ) предполагает, что свободные радикалы, образующиеся в результате митохондриальной активности, повреждают клеточные компоненты, что приводит к старению .

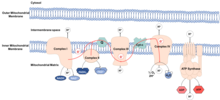
Митохондрии — это клеточные органеллы , которые обеспечивают клетку энергией путем производства АТФ (аденозинтрифосфата). Во время производства АТФ электроны могут покинуть митохондрии и вступить в реакцию с водой, образуя активные формы кислорода , сокращенно АФК. АФК могут повреждать макромолекулы , включая липиды , белки и ДНК , что, как считается, способствует процессу старения.
В 1950-х годах Денэм Харман предложил свободнорадикальную теорию старения , которую позже расширил до MFRTA.
При изучении мутаций антиоксидантов , удаляющих АФК, результаты оказались противоречивыми. Однако было замечено, что сверхэкспрессия антиоксидантных ферментов у дрожжей , червей , мух и мышей увеличивает продолжительность жизни .
Молекулярная основа
[ редактировать ]
Считается, что митохондрии — это органеллы, развившиеся из эндоцитированных бактерий , которые научились сосуществовать внутри древних клеток. Эти бактерии сохранили свою собственную ДНК, митохондриальную ДНК (мтДНК), которая кодирует компоненты цепи переноса электронов (ЭТС). ЦЭТ находится во внутренней митохондриальной мембране и выполняет функцию передачи энергии, полученной из пищи, в молекулы АТФ. Этот процесс называется окислительным фосфорилированием , поскольку АТФ образуется из АДФ в серии окислительно-восстановительных реакций . Электроны передаются через ЭТЦ от НАДН и ФАДН 2 к кислороду , восстанавливая кислород до воды.
РОС
[ редактировать ]
АФК представляют собой высокореактивные кислородсодержащие химические соединения , которые включают супероксид , перекись водорода и гидроксильный радикал . Если комплексы ЭТЦ не функционируют должным образом, электроны могут просачиваться и вступать в реакцию с водой, образуя АФК. Обычно утечка невелика, а АФК поддерживаются на физиологическом уровне, выполняя роль в передаче сигналов и гомеостазе . Фактически, их присутствие на низких уровнях приводит к увеличению продолжительности жизни за счет активации факторов транскрипции и метаболических путей, участвующих в долголетии . При повышенных уровнях АФК вызывают окислительное повреждение , окисляя макромолекулы, такие как липиды, белки и ДНК. Считается, что это окислительное повреждение макромолекул является причиной старения. Митохондриальная ДНК особенно подвержена окислительному повреждению из-за ее близости к месту образования этих видов. [4] Повреждение митохондриальной ДНК вызывает мутации, приводящие к образованию комплексов ЭТС, которые не функционируют должным образом, повышая выработку АФК, увеличивая окислительное повреждение макромолекул.
УПО тонна
[ редактировать ]Ответ митохондриального развернутого белка (UPR тонна ) включается в ответ на митохондриальный стресс. Митохондриальный стресс возникает, когда градиент протонов через внутреннюю митохондриальную мембрану рассеивается, мтДНК мутирует и/или накапливаются АФК, что может привести к неправильному сворачиванию и снижению функции митохондриальных белков. Стресс ощущается ядром , где шаперонов и протеаз активируется активность , что может корректировать сворачивание или удалять поврежденные белки соответственно. [5] Снижение уровня протеазы связано со старением, поскольку митохондриальный стресс сохраняется, поддерживая высокий уровень АФК. [6] Такой митохондриальный стресс и дисфункция связаны с различными возрастными заболеваниями , включая сердечно-сосудистые заболевания и диабет 2 типа . [7]
Митохондриальные метаболиты
[ редактировать ]Поскольку в митохондриальном матриксе происходит цикл ТСА , различные метаболиты обычно задерживаются в митохондриях. С возрастом функция митохондрий снижается, что приводит к утечке этих метаболитов, что может вызвать эпигенетические изменения. [8] связанный со старением.

Ацетил-коэнзим А (ацетил-КоА) входит в цикл ТСА в митохондриальном матриксе и окисляется в процессе производства энергии. Покинув митохондрии и попав в ядро, он может действовать как субстрат для ацетилирования гистонов . [9] Ацетилирование гистонов — это эпигенетическая модификация, которая приводит к активации генов . В молодом возрасте уровни ацетил-КоА выше в ядре и цитозоле , и его транспорт в ядро может продлить продолжительность жизни червей. [10] [11]
Никотинамидадениндинуклеотид (НАД + ) вырабатывается в митохондриях и, попадая в ядро, может выступать в качестве субстрата для сиртуинов . [12] Сиртуины — это семейство белков, которые, как известно, играют роль в долголетии. Сотовый НАД + Было показано, что уровень снижается с возрастом. [13]
DAMP
[ редактировать ]Молекулярные паттерны, связанные с повреждением (DAMP), — это молекулы, которые высвобождаются во время клеточного стресса . Митохондриальная ДНК представляет собой DAMP, который становится доступным только при повреждении митохондрий. Уровни митохондриальной ДНК в крови повышаются с возрастом, что способствует воспалительному старению — хроническому состоянию воспаления, характерному для пожилого возраста. [14]
Пептиды митохондриального происхождения
[ редактировать ]Известно, что митохондриальная ДНК кодирует 13 белков. Недавно были идентифицированы другие короткие последовательности, кодирующие белки, и их продукты называются пептидами, полученными из митохондрий. [15]
Было показано, что пептид митохондриального происхождения, гуманин, защищает от болезни Альцгеймера , которая считается возрастным заболеванием . [16]
Было показано, что MOTS-c предотвращает возрастную резистентность к инсулину , основную причину диабета 2 типа.
Было показано, что уровни гуманина и MOTS-c снижаются с возрастом, а их активность, по-видимому, увеличивает продолжительность жизни. [17]
Митохондриальная мембрана
[ редактировать ]Алмаида-Пэган и его коллеги обнаружили, что липидный состав митохондриальной мембраны меняется с возрастом при изучении бирюзового киллифиса . [18] Доля мононенасыщенных жирных кислот и общее содержание фосфолипидов с возрастом снижались.
История
[ редактировать ]В 1956 году Денэм Харман впервые постулировал свободнорадикальную теорию старения , которую он позже модифицировал в митохондриальную свободнорадикальную теорию старения (MFRTA). [19] Он обнаружил, что АФК являются основной причиной повреждения макромолекул, известного как «старение». Позже он модифицировал свою теорию, обнаружив, что АФК производят и повреждают митохондрии, что привело его к выводу, что митохондрии определяют старение. В 1972 году он опубликовал свою теорию в Журнале Американского гериатрического общества . [20]
Доказательство
[ редактировать ]Было замечено, что с возрастом функция митохондрий снижается, а мутации митохондриальной ДНК увеличиваются в тканевых клетках в зависимости от возраста. Это приводит к увеличению производства АФК и потенциальному снижению способности клетки удалять АФК. Было показано, что большинство долгоживущих животных более устойчивы к окислительному повреждению и имеют более низкое производство АФК, что связывает уровни АФК с продолжительностью жизни. [21] [22] [23] [24] [25] сверхэкспрессия антиоксидантов , которые снижают АФК, увеличивает продолжительность жизни. Также было показано, что [26] [27] Биоинформатический анализ показал, что аминокислотный состав митохондриальных белков коррелирует с долголетием (долгоживущие виды обеднены цистеином и метионином ), связывая митохондрии с процессом старения. [28] [29] Изучая экспрессию определенных генов у C. elegans , [30] Дрозофила , [31] и мыши [32] было обнаружено, что разрушение комплексов ETC может продлить жизнь, связывая функцию митохондрий с процессом старения.
Доказательства, подтверждающие эту теорию, начали рушиться в начале 2000-х годов.Мыши со сниженной экспрессией митохондриального антиоксиданта SOD2 накапливали окислительные повреждения и развивали рак , но не жили дольше нормальной жизни. [33] Сверхэкспрессия антиоксидантов снижала клеточный стресс, но не увеличивала продолжительность жизни мышей. [34] [35] повреждения . Было показано, что голый землекоп, который живет в 10 раз дольше, чем обычные мыши, имеет более высокий уровень окислительного [36]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Микель, Дж.; Экономос, AC; Флеминг, Дж.; Джонсон, Дж. Э. (1 января 1980 г.). «Роль митохондрий в старении клеток» . Экспериментальная геронтология . 15 (6): 575–591. дои : 10.1016/0531-5565(80)90010-8 . ISSN 0531-5565 . ПМИД 7009178 . S2CID 38511082 .
- ^ Линнейн, Энтони В; Одзава, Такаюки; Марзуки, Сангкот; Танака, Масаси (25 марта 1989 г.). «Мутации митохондриальной ДНК как важный фактор старения и дегенеративных заболеваний» . Ланцет . 333 (8639): 642–645. дои : 10.1016/S0140-6736(89)92145-4 . ISSN 0140-6736 . ПМИД 2564461 . S2CID 11933110 .
- ^ Lobachev A.N. Роль митохондриальных процессов в развитии и старении организма. Старение и рак (PDF) , Рефераты по химии. 1979 т. 91 N 25 91:208561т. Депонируется док., ВИНИТИ 2172-78, 1978, с. 48
- ^ Ковальд; Кирквуд (2018). «Разгадка загадки клональной экспансии делеций мтДНК» . Гены (Базель) . 9 (3): 126. doi : 10.3390/genes9030126 . ПМЦ 5867847 . ПМИД 29495484 .
- ^ Наргунд; и др. (2015). «Митохондриальное и ядерное накопление транскрипционного фактора ATFS-1 способствует восстановлению OXPHOS во время UPR(mt)» . Молекулярная клетка . 58 (1): 123–133. doi : 10.1016/j.molcel.2015.02.008 . ПМЦ 4385436 . ПМИД 25773600 .
- ^ Бота; и др. (2005). «Понижение уровня человеческой протеазы Lon нарушает структуру и функцию митохондрий и вызывает гибель клеток» . Свободнорадикальная биология и медицина . 38 (1): 665–677. doi : 10.1016/j.freeradbiomed.2004.11.017 . ПМИД 15683722 . S2CID 32448357 .
- ^ Ким; Вэй; Сеятели (2008). «Роль митохондриальной дисфункции в инсулинорезистентности» . Исследование кровообращения . 102 (4): 401–414. дои : 10.1161/CIRCRESAHA.107.165472 . ПМК 2963150 . ПМИД 18309108 .
- ^ Фрезза (2017). «Митохондриальные метаболиты: скрытые сигнальные молекулы» . Фокус на интерфейсе . 7 (2): 20160100. doi : 10.1098/rsfs.2016.0100 . ПМК 5311903 . ПМИД 28382199 .
- ^ Мензис; Чжан; Кацуяба; Оверкс (2016). «Ацетилирование белков в метаболизме - метаболиты и кофакторы». Обзоры природы Эндокринология . 12 (1): 43–60. дои : 10.1038/nrendo.2015.181 . ПМИД 26503676 . S2CID 19151622 .
- ^ Ши; Ту (2015). «Ацетил-КоА и регуляция обмена веществ: механизмы и последствия» . Современное мнение в области клеточной биологии . 33 : 125–131. дои : 10.1016/j.ceb.2015.02.003 . ПМК 4380630 . ПМИД 25703630 .
- ^ Бенаюн; Поллина; Брюне (2015). «Эпигенетическая регуляция старения: связь воздействия окружающей среды со стабильностью генома» . Nature Reviews Молекулярно-клеточная биология . 16 (1): 593–610. дои : 10.1038/nrm4048 . ПМЦ 4736728 . ПМИД 26373265 .
- ^ Имаи; Гаранте (2016). «Для танго нужны двое: НАД+ и сиртуины в контроле старения и долголетия» . npj Старение и механизмы заболеваний . 2 : 16017. дои : 10.1038/npjamd.2016.17 . ПМК 5514996 . ПМИД 28721271 .
- ^ Шульц; Синклер (2016). «Почему НАД(+) снижается во время старения: он разрушается» . Клеточный метаболизм . 23 (6): 965–966. дои : 10.1016/j.cmet.2016.05.022 . ПМК 5088772 . ПМИД 27304496 .
- ^ Пинти; и др. (2014). «Циркуляция митохондриальной ДНК увеличивается с возрастом и является знакомой чертой: последствия «воспаления старения» » . Европейский журнал иммунологии . 44 (5): 1552–1562. дои : 10.1002/eji.201343921 . ПМИД 24470107 . S2CID 5407086 .
- ^ Ким; и др. (2017). «Пептиды митохондриального происхождения как новые регуляторы метаболизма» . Журнал физиологии . 595 (21): 6613–6621. дои : 10.1113/JP274472 . ПМК 5663826 . ПМИД 28574175 .
- ^ Ким; и др. (2017). «Пептиды митохондриального происхождения как новые регуляторы метаболизма» . Журнал физиологии . 595 (21): 6613–6621. дои : 10.1113/JP274472 . ПМК 5663826 . ПМИД 28574175 .
- ^ Ким; и др. (2017). «Пептиды митохондриального происхождения как новые регуляторы метаболизма» . Журнал физиологии . 595 (21): 6613–6621. дои : 10.1113/JP274472 . ПМК 5663826 . ПМИД 28574175 .
- ^ Алмаида-Паган; и др. (2019). «Возрастные изменения в составе митохондриальной мембраны Nothobranchius Furzeri: сравнение с долгоживущими видами Nothobranchius». Биогеронтология . 20 (1): 83–92. дои : 10.1007/s10522-018-9778-0 . ПМИД 30306289 . S2CID 254287563 .
- ^ Харман (1956). «Старение: теория, основанная на свободнорадикальной и радиационной химии». Журнал геронтологии . 11 (3): 298–300. дои : 10.1093/geronj/11.3.298 . hdl : 2027/mdp.39015086547422 . ПМИД 13332224 .
- ^ Харман (1972). «Биологические часы: митохондрии?». Журнал Американского гериатрического общества . 20 (4): 145–147. дои : 10.1111/j.1532-5415.1972.tb00787.x . ПМИД 5016631 . S2CID 396830 .
- ^ Мартин; и др. (1996). «Генетический анализ старения: роль окислительного повреждения и стрессов окружающей среды». Природная генетика . 13 (1): 25–34. дои : 10.1038/ng0596-25 . ПМИД 8673100 . S2CID 9358797 .
- ^ Лян; и др. (2003). «Генетические мышиные модели увеличенной продолжительности жизни». Экспериментальная геронтология . 38 (11–12): 1353–1364. дои : 10.1016/j.exger.2003.10.019 . ПМИД 14698816 . S2CID 136263 .
- ^ Ламберт; и др. (2007). «Низкие темпы производства перекиси водорода изолированными митохондриями сердца связаны с большей максимальной продолжительностью жизни у гомеотермных животных» . Стареющая клетка . 6 (5): 607–618. дои : 10.1111/j.1474-9726.2007.00312.x . ПМИД 17596208 . S2CID 22676318 .
- ^ Унгвари; и др. (2011). «Чрезвычайное долголетие связано с повышенной устойчивостью к окислительному стрессу у Arctica Islandica, самого долгоживущего неколониального животного» . Журналы геронтологии. Серия А, Биологические и медицинские науки . 66 (7): 741–750. дои : 10.1093/gerona/glr044 . ПМК 3143345 . ПМИД 21486920 .
- ^ Барха; и др. (2014). «Митохондриальная свободнорадикальная теория старения». Прогресс молекулярной биологии и трансляционной науки . 127 : 1–27. дои : 10.1016/B978-0-12-394625-6.00001-5 . ISBN 9780123946256 . ПМИД 25149212 .
- ^ Солнце; и др. (2002). «Индуцированная сверхэкспрессия митохондриальной Mn-супероксиддисмутазы продлевает продолжительность жизни взрослой Drosophila melanogaster» . Генетика . 161 (2): 661–672. дои : 10.1093/генетика/161.2.661 . ПМЦ 1462135 . ПМИД 12072463 .
- ^ Орр; Сохал (1994). «Продление продолжительности жизни за счет сверхэкспрессии супероксиддисмутазы и каталазы у Drosophila melanogaster». Наука . 263 (5150): 1128–30. Бибкод : 1994Sci...263.1128O . дои : 10.1126/science.8108730 . ПМИД 8108730 .
- ^ Моосманн; Бел (2008). «Цистеин, кодируемый митохондриями, предсказывает продолжительность жизни животных» . Стареющая клетка . 7 (1): 32–46. дои : 10.1111/j.1474-9726.2007.00349.x . ПМИД 18028257 .
- ^ Аледо; и др. (2011). «Митохондриально кодируемый метионин обратно пропорционален долголетию млекопитающих» . Стареющая клетка . 10 (2): 198–207. дои : 10.1111/j.1474-9726.2010.00657.x . ПМИД 21108730 .
- ^ Ри; и др. (2007). «Связь между дисфункцией митохондриальной цепи переноса электронов, развитием и продлением жизни Caenorhabditis elegans» . ПЛОС Биология . 5 (10): е259. дои : 10.1371/journal.pbio.0050259 . ЧВК 1994989 . ПМИД 17914900 .
- ^ Коупленд; и др. (2009). «Продление жизни дрозофилы с помощью РНКи дыхательной цепи митохондрий» . Современная биология . 19 (19): 1591–1598. дои : 10.1016/j.cub.2009.08.016 . ПМИД 19747824 .
- ^ Лю; и др. (2005). «Эволюционная консервация clk-1-зависимого механизма долголетия: потеря mclk1 увеличивает клеточную пригодность и продолжительность жизни у мышей» . Гены и развитие . 19 (20): 2424–2434. дои : 10.1101/gad.1352905 . ПМЦ 1257397 . ПМИД 16195414 .
- ^ Ван Реммен; и др. (2003). «Пожизненное снижение активности MnSOD приводит к увеличению повреждения ДНК и увеличению заболеваемости раком, но не ускоряет старение». Физиологическая геномика . 16 (1): 29–37. doi : 10.1152/физиологгеномика.00122.2003 . ПМИД 14679299 . S2CID 9159294 .
- ^ Хуан; и др. (2000). «Повсеместная сверхэкспрессия супероксиддисмутазы CuZn не продлевает продолжительность жизни мышей» . Журналы геронтологии. Серия А, Биологические и медицинские науки . 55 (1): Б5-9. дои : 10.1093/gerona/55.1.b5 . ПМИД 10719757 .
- ^ Перес; и др. (2009). «Является ли теория старения окислительного стресса мертвой?» . Biochimica et Biophysical Acta (BBA) – Общие предметы . 1790 (10): 1005–1014. дои : 10.1016/j.bbagen.2009.06.003 . ПМЦ 2789432 . ПМИД 19524016 .
- ^ Андзиак; и др. (2006). «Высокие уровни окислительного повреждения у самого долгоживущего грызуна, голого землекопа» . Стареющая клетка . 5 (6): 463–471. дои : 10.1111/j.1474-9726.2006.00237.x . ПМИД 17054663 .