Мармезин
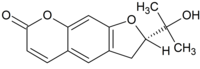
| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
(2 S )-2-(2-Гидроксипропан-2-ил)-2,3-дигидро-7 H -фуро[3,2- g ][1]бензопиран-7-он | |
| Другие имена
Нодакенет
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХЭМБЛ | |
| ХимическийПаук | |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 14 Н 14 О 4 | |
| Молярная масса | 246.262 g·mol −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Мармезин ( нодакенетин ) является химическим соединением- предшественником в псоралена и линейных фуранокумаринов биосинтезе . [ 1 ]
Мармезин играет центральную роль в биосинтезе фурокумаринов в растении ruta Graveolens, более известном как рута. Он действует как природный промежуточный продукт при образовании фуранового кольца, что приводит к образованию 4',5'-дигидропроизводного фурокумарина. Это вещество затем может трансформироваться в псорален и другие фурокумарины, присутствующие в руте. После введения в растение дозы мармезина радиоактивность стала прочно включаться в псорален и, следовательно, в само растение. [ 2 ]
Спектры
[ редактировать ]ИК-спектры
[ редактировать ]ИК (НПВО): νmax 3480, 2971, 1699, 1631, 1488 см-1. [ 3 ]
Протон-ЯМР
[ редактировать ]1H-ЯМР (300 МГц, CDCl3): δ 7,59 (д, J = 9,5 Гц, 1H, ароматический), 7,22 (с, 1H, ароматический), 6,75 (д, J = 21,6 Гц, 1H, ароматический), 6,20 ( д, J = 9,5 Гц, 1H, ароматический), 4,74 (т, J = 8,8 Гц, 1H, CH), 3,28-3,15 (м, 2H, CH2), 1,87 (с, 1H, OH), 1,37 (с, 3H, CH3), 1,24 (с, 3H, CH3) м.д. [ 4 ]
УФ-Вид
[ редактировать ]УФ: [нейтральный] λmax 217 (ε7420); 338 (ε17700)(MeOH) [нейтральный]λmax 332(EtOH). [ 5 ]
Производство
[ редактировать ]Синтез мармезина неоднократно успешно проводился в лаборатории. Один из способов сделать это — использовать стратегию, основанную на реакции внутримолекулярного сочетания, катализируемой палладием. Эта реакция позволит построить дигидропирановое кольцо и синтезировать соединение из промежуточного (-)-пейцеданола. Ключевым этапом общего синтеза является каталитическое асимметрическое эпоксидирование енона. [ 6 ]
Ссылки
[ редактировать ]- ^ Стек, Уоррен; Браун, Стюарт А. (1971). «Сравнение (+)- и (-)-мармезина как промежуточных продуктов биосинтеза линейных фураноконмаринов». Биохимия и клеточная биология . 49 (11): 1213–1216. дои : 10.1139/o71-174 . ISSN 1208-6002 . ПМИД 5134594 .
- ^ Капрал, Г.; Далл'Аква, Ф.; Капоцци, А.; Марчиани, С.; Крокко, Р. Исследования биосинтеза некоторых фурокумаринов, присутствующих в Ruta Graveolens. Zeitschrift für Naturforschung B 1971, 26, 1256–1259.
- ^ Андо, Т.; Нагумо, М.; Ниномия, М.; Танака, К.; Линхардт, Р.Дж.; Кокецу, М. Синтез производных кумарина и их цитопротекторное действие на окислительное повреждение, вызванное t-BHP, в клетках HepG2. Биоорг. Мед. хим. Летт. 2018, 28, 2422-2425.
- ^ Коммера, Р.; Бхимапака, Ч.Р. Простой и эффективный подход к получению дигидроксантилетина, ксантилетина, декурсинола и мармезина. Синтетические коммуникации 2020, 50, 3204-3211.
- ^ Анонимный словарь натуральных продуктов; Чепмен и Холл: Лондон, 1994.
- ^ Немото, Т.; Осима, Т.; Шибасаки, М. Энантиоселективный полный синтез нового активатора PKC (+)-декурсина и его производных с использованием каталитического асимметричного эпоксидирования енона. Тетраэдр Летт. 2000, 41, 9569-9574.
Внешние ссылки
[ редактировать ]- Абу-Мустафа, Эффат А.; Файез, MBE (1961). «Природные кумарины. I. Мармезин и мармезин, другие продукты из плодов Ammi majus L.». Журнал органической химии . 26 (1): 161–166. дои : 10.1021/jo01060a039 . ISSN 0022-3263 .