N -bromosuccinimide
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное имя IUPAC
1-бромпирролидин-2,5-дион | |||
| Другие имена
N -bromosuccinimide; Нож
| |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| 113916 | |||
| Чеби | |||
| Chemspider | |||
| Echa Infocard | 100.004.435 | ||
| ЕС номер |
| ||
| 26634 | |||
PubChem CID
|
|||
| НЕКОТОРЫЙ | |||
Comptox Dashboard ( EPA )
|
|||
| Характеристики | |||
| C 4 H 4 Br N O 2 | |||
| Молярная масса | 177.985 g·mol −1 | ||
| Появление | Белое твердое вещество | ||
| Плотность | 2.098 г/см 3 (твердый) | ||
| Точка плавления | От 175 до 178 ° C (от 347 до 352 ° F; от 448 до 451 К) | ||
| Точка кипения | 339 ° C (642 ° F; 612 K) | ||
| 14,7 г/л (25 ° C) | |||
| Растворимость в CCL 4 | Нерастворимый (25 ° C) | ||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности
|
Раздражающий | ||
| Лист данных безопасности (SDS) | [1] | ||
За исключением случаев, когда отмечены, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа).
| |||
N -BROMOSUCCINIMIDE или NBS является химическим реагентом, используемым в радикальной замещении , электрофильном добавлении и электрофильной замещения реакциях в органической химии . NBS может быть удобным источником BR • , радикал брома .
Подготовка
[ редактировать ]NBS коммерчески доступен. Это также может быть синтезировано в лаборатории. Для этого гидроксид натрия со льдом и брома добавляются в раствор сукцинимида . Продукт NBS осаждает и может быть собрана путем фильтрации. [ 1 ]
Сырая NBS дает лучшую урожайность в реакции Wohl -Ziegler . В других случаях нечистые NBS (слегка желтый по цвету) могут дать ненадежные результаты. Он может быть очищен путем перекристаллизации от 90 до 95 ° С воды (10 г NBS для 100 мл воды). [ 2 ]
Реакция
[ редактировать ]Дополнение к алкенам
[ редактировать ]NBS будет реагировать с алкенами 1 в водных растворителях с получением бромогидринов 2 . Предпочтительными условиями являются порционное добавление NBS в раствор алкена в 50% водного ДМСО , DME , THF или трет -бутанола при 0 ° C. [ 3 ] Образование иона бромония и немедленная атака водой дает сильное добавление Марковникова и анти стереохимическую селективность. [ 4 ]
Боковые реакции включают образование α-бромкетонов и соединений Dibromo. Они могут быть сведены к минимуму за счет использования свежепримененных NBS .
С добавлением нуклеофилов вместо воды можно синтезировать различные бифункциональные алканы. [ 5 ]
Аллиловая и бензиловая брома
[ редактировать ]Стандартные условия для использования NBS в аллильном и/или бензильном бромировании включает в себя рефлюксный раствор NBS в безводном CCL 4 с радикальным инициатором - обычно азобизизобиронитрил ( AIBN ) или бензоилпероксид , облучение или оба для воздействия радикации на инициацию . [ 6 ] [ 7 ] Аллильные и бензиловые радикальные промежутки, образованные во время этой реакции, более стабильны, чем другие углеродные радикалы, а основными продуктами являются аллильные и бензильные бромиды. Это также называется реакцией Wohl -Ziegler . [ 8 ] [ 9 ]
Тетрахлорид углерода должен поддерживаться безводным на протяжении всей реакции, так как присутствие воды , вероятно, может гидролизовать желаемый продукт. [ 10 ] Карбонат бария часто добавляется для поддержания безводных и неправедных условий.
В приведенной выше реакции, в то время как возможна смесь изомерных аллиловых бромидных продуктов, создается только одна из-за большей стабильности 4-позиционного радикала над метилцентриченным радикалом.
Бромирование карбонильных производных
[ редактировать ]NBS может α-браминат карбонильных производных через радикальный путь (как указано выше) или с помощью кислотного катализа. Например, гексаноилхлорид 1 может быть бромирован в альфа-позиции с помощью NB с использованием кислотного катализа. [ 11 ]
Реакция inolates , enol Ethers или Enol-ацетатов с NBS является предпочтительным методом α-браминации, поскольку он высокотерезируется с несколькими побочными продуктами. [ 12 ] [ 13 ]
Бромирование ароматических производных
[ редактировать ]Электроно-богатые ароматические соединения, такие как фенолы , анилины и различные ароматические гетероциклы , [ 14 ] может быть бромирован с использованием NBS. [ 15 ] [ 16 ] Использование DMF в качестве растворителя дает высокий уровень пара-селективности. [ 17 ]
Перестановление Хофманн
[ редактировать ]NBS, в присутствии сильного основания, такого как DBU , реагирует с первичными амидами для производства карбамата через перестройку Хофманна . [ 18 ]
Селективное окисление спиртов
[ редактировать ]Это редко, но для NBS возможно окислять спирты. EJ Corey et al. обнаружил, что можно избирательно окислять вторичные спирты в присутствии первичных спиртов с использованием NBS в водном диметокситане (DME). [ 19 ]
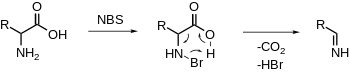
Окислительное декарбоксилирование α-аминокислот
[ редактировать ]NBS электрофилизирует амин, за которым следует декарбоксилирование и высвобождение имина. Дальнейший гидролиз даст альдегид и аммиак. [ 20 ] [ 21 ] (См. Неокислятельный PLP-зависимый декарбоксилирование)
Меры предосторожности
[ редактировать ]Хотя NBS легче и безопаснее справиться, чем брома, следует принимать меры предосторожности, чтобы избежать вдыхания. NBS следует хранить в холодильнике. NBS разлагается со временем, исходя из брома. Чистый NBS белый, но часто оказывается не совсем белым или коричневым цветом Bromine.
В целом, реакции, связанные с NB, являются экзотермическими. Следовательно, дополнительные меры предосторожности должны быть приняты при использовании в больших масштабах.
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Зиглер, К.; Späth, A. (1942). «Галогенирование ненасыщенных веществ в положении аллила». Энн. . Хим Doi : 10.1002/jlac.194255510103 .
- ^ Dauben, HJ Jr; McCoy, LL (1959). « N -bromosuccinimide. I. аллиловая бромирование, общее обследование переменных реакции». J. Am. Химический Соц 81 (18): 4863–4873. doi : 10.1021/ja01527a027 .
- ^ Hanzlik, RP «Селективное эпоксидирование терминальных двойных связей» . Органические синтезы ; Собранные объемы , вып. 6, с. 560 .
- ^ Beger, J. (1991). «Препаративные аспекты электрофильных трехкомпонентных реакций с алкенами» [препаративные аспекты электрофильных трех компонентных реакций с алкенами]. Дж. Практ. . Хим Doi : 10.1002/prac.19913330502 .
- ^ Haufe, G.; Alvernhe, G.; Лоран, А.; Ernet, T.; Goj, O.; Kröger, S.; Саттлер А. (2004). "ПРОМОТ ДЛЯ ДЛЯ АЛКЕНЫ" . Синтез органический ; Собранные объемы , вып. 10, с. 128
- ^ ДЖЕРОССИ, Карл (1948). «Броминации с n -bromosuccinimide и родственными соединениями. Реакция Вол -Зиглера». Химический Rev. 43 (2): 271–317. doi : 10.1021/cr60135a004 . PMID 18887958 .
- ^ Гринвуд, Флорида; Келлерт, MD; Седлак, Дж. (1958). "4-Bromo-2-Heptene". Органические синтезы . 38 : 8. doi : 10.15227/orgsyn.038.0008 .
- ^ Вероятно, А. (1919). «Бромизация ненасыщенных связей с n -Brom -ацетамидом, вклад в обучение химическим процессам» [бромирование ненасыщенных соединений с бромацетамидом , вклад в теорию хода химических процессов]. Отчеты Германского химического общества (серия A и B) . 52 : 51–63. Doi : 10.1002/cber.19190520109 .
- ^ Зиглер, К.; Schenck, G.; Крокв, EW; Зиберт, А.; Венц, А.; Вебер, Х. (1942). «Синтез кантаридина» [синтез кантаридина]. Юшки Либиг Анналы химии . 551 : 1–79. Doi : 10.1002/jlac.194255502 .
- ^ Бинкли, RW; Goewey, GS; Johnston, J. (1984). «Региоселективное отверстие кольца выбранных бензилиденных ацеталов. Фотохимически инициированная реакция для частичной снятия углеводов». J. Org. Химический 49 (6): 992. doi : 10.1021/jo00180a008 .
- ^ Harpp, DN; Бао, LQ; Coyle, C.; Глисон, JG; Горович С. (1988). «2-бромгогексаноилхлорид» . Органические синтезы ; Собранные объемы , вып. 6, с. 190 .
- ^ Стоттер, PL; Хилл, Ка (1973). «α-галокарбонильные соединения. II. Положение специфичное препарат α-бромкетонов путем бромирования литий-эунолятов. Специфичное введение α, β-Unsatureation в несимметричные кетоны». J. Org. Химический 38 (14): 2576. DOI : 10.1021/JO00954A045 .
- ^ Lichtenthaler, FW (1992). «Различные доноры гликозила с функцией кетона или оксима рядом с аномерным центром: легкая подготовка и оценка их селективности в гликозидациях». Синтез . 1992 : 179–84. doi : 10.1055/s-1992-34167 .
- ^ Amat, M.; Хадида, с.; Satyanarayana, S.; Bosc, J. (1998). «Сегиоселективный синтез 3-Substudited Indoles » Органические синтезы ; Собранные объемы , вып. 9, с. 417 .
- ^ Гилоу, HW; Бертон, де (1981). «Бромирование и хлорирование пиррола и некоторые реактивные 1-замещенные пирролы». J. Org. Химический 46 (11): 2221. DOI : 10.1021/JO00324A005 .
- ^ Браун, WD; Gouliaev, AH (2005). «Синтез 5-бромоизохинолина и 5-бром-8-нитроизохинолин» . Органические синтезы . 81 : 98 .
- ^ Митчелл, RH; Лай, да; Уильямс, RV (1979). « N -bromosuccinimide -диметилформамид: мягкий, селективный реагент ядерного моноброминации для реактивных ароматических соединений». J. Org. Химический 44 (25): 4733. DOI : 10.1021/JO00393A066 .
- ^ Кейлор, JW; Хуан, X. (2004). «Образование метил карбамат через модифицированные реакции перестройки Хофманна» . Органические синтезы ; Собранные объемы , вып. 10, с. 549 .
- ^ Кори, EJ ; Ишигуро, М. (1979). «Полный синтез (±) -2-изоцианопукуканана». Тетраэдр Летт. 20 (30): 2745–2748. doi : 10.1016/s0040-4039 (01) 86404-2 .
- ^ Рамачандран, MS; Easwaramoorthy, D.; Раджасингх, В.; Vivekanandam, TS (1990-01-01). « N -хлоросукцинимид-инфмопроизводимый окислительный декарбоксилирование α-аминокислот в водной щелочной среде» . Бюллетень химического общества Японии . 63 (8): 2397–2403. doi : 10.1246/bcsj.63.2397 .
- ^ Песня, Сюэжэн; Джу, Хонг; Чжао, Чунмей; Ласанаджак, Йи (2014-10-15). «Новая стратегия выпуска и помечения n -glycans для функциональной гликомики» . Биоконъюгатная химия . 25 (10): 1881–1887. doi : 10.1021/bc500366v . ISSN 1043-1802 . PMC 4197647 . PMID 25222505 .
Внешние ссылки
[ редактировать ]- Использование N -Bromosuccinimide в органическом синтезе
- Реакции с NBS