Генетика старения
Генетика старения обычно занимается продлением жизни, связанным с генетическими изменениями, а не болезнями ускоренного старения, приводящими к сокращению продолжительности жизни.
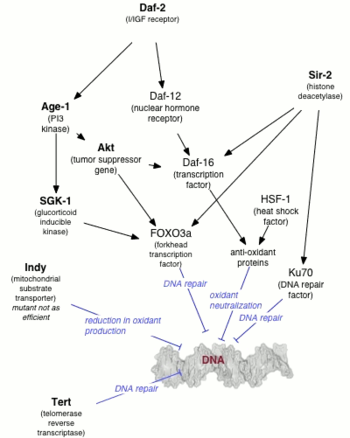
Первой мутацией , увеличивающей продолжительность жизни животного, был ген age-1 у Caenorhabditis elegans . Майкл Класс обнаружил, что продолжительность жизни C. elegans может быть изменена мутациями, но Класс полагал, что эффект был обусловлен снижением потребления пищи ( ограничением калорий ). [ 1 ] Позже Томас Джонсон показал, что продление жизни на 65% было связано с самой мутацией, а не с ограничением калорий. [ 2 ] и он назвал ген age-1 в надежде, что будут найдены и другие гены, контролирующие старение. Ген age-1 кодирует каталитическую субъединицу фосфатидилинозитол-3-киназы класса I (PI3K).
Спустя десятилетие после открытия Джонсоном daf-2 , одного из двух генов, которые необходимы для формирования личинок дауэра , [ 3 ] показала, Синтия Кеньон что он удваивает продолжительность жизни C. elegans . [ 4 ] Кеньон показал, что мутанты daf-2 , которые образуют дауэры при температуре выше 25 ° C (77 ° F), обходят состояние дауэра при температуре ниже 20 ° C (68 ° F) с удвоением продолжительности жизни. [ 4 ] До исследования Кеньона считалось, что продолжительность жизни можно увеличить только за счет потери репродуктивной способности, но нематоды Кеньона сохраняли репродуктивную способность молодости, а также продлевали молодость в целом. Было показано , что последующая генетическая модификация (нулевая мутация PI3K) C. elegans увеличивает максимальную продолжительность жизни в десять раз. [ 5 ] [ 6 ]
Было продемонстрировано, что долгоживущие мутанты C. elegans ( age-1 и daf-2 ) устойчивы к окислительному стрессу и УФ-излучению . [ 7 ] Эти долгоживущие мутанты обладали более высокой способностью к репарации ДНК, дикого типа чем C. elegans . [ 7 ] Нокдаун эксцизионной репарации нуклеотидов гена Xpa-1 увеличил чувствительность к ультрафиолету и сократил продолжительность жизни долгоживущих мутантов. Эти данные подтверждают гипотезу о том, что повреждение ДНК играет значительную роль в процессе старения . [ 7 ]
Генетические модификации других видов не привели к такому значительному увеличению продолжительности жизни, как это наблюдалось у C. elegans . Продолжительность жизни Drosophila melanogaster увеличилась вдвое. [ 8 ] — в 1,7 раза Генетические мутации у мышей могут увеличить максимальную продолжительность жизни в 1,5 раза, а в сочетании с ограничением калорий . [ 9 ]
У дрожжей НАД +-зависимая гистондеацетилаза Sir2 необходима для подавления геномного молчания в трех локусах: локусах спаривания дрожжей , теломерах и рибосомальной ДНК (рДНК). У некоторых видов дрожжей репликативное старение может быть частично вызвано гомологичной рекомбинацией между повторами рДНК; Удаление повторов рДНК приводит к образованию внехромосомных колец рДНК (ERC). Эти ERC реплицируются и преимущественно отделяются от материнской клетки во время клеточного деления и, как полагают, приводят к клеточному старению за счет титрования (конкуренции) основных ядерных факторов . ERC не наблюдались у других видов (и даже у всех штаммов того же вида дрожжей) дрожжей (которые также демонстрируют репликативное старение), и считается, что ERC не способствуют старению у высших организмов, таких как люди (их не было показано). накапливаться у млекопитающих аналогично дрожжам). Внехромосомная кольцевая ДНК (вкДНК) обнаружена у червей, мух и людей. Происхождение и роль эккДНК в старении, если таковая имеется, неизвестны.
Несмотря на отсутствие связи между кольцевой ДНК и старением у высших организмов, дополнительные копии Sir2 способны продлевать продолжительность жизни как червей, так и мух (хотя у мух это открытие не было воспроизведено другими исследователями, а активатор Sir2 Ресвератрол не увеличивает продолжительность жизни воспроизводимо ни у одного из видов. [ 10 ] Неясно, играют ли гомологи Sir2 у высших организмов какую-либо роль в продолжительности жизни, но было продемонстрировано, что человеческий белок SIRT1 деацетилирует p53 , Ku70 и forkhead семейство транскрипционных факторов . SIRT1 также может регулировать ацетилаты, такие как CBP/p300 , и было показано, что он деацетилирует определенные гистонов остатки .
RAS1 и RAS2 также влияют на старение дрожжей и имеют гомолог человека. Было показано, что сверхэкспрессия RAS2 продлевает продолжительность жизни дрожжей.
Другие гены регулируют старение дрожжей, повышая устойчивость к окислительному стрессу . Супероксиддисмутаза , белок , который защищает от воздействия митохондриальных свободных радикалов , при сверхэкспрессии может продлить жизнь дрожжей в стационарной фазе.
У высших организмов старение, вероятно, частично регулируется посредством пути инсулин/IGF-1. Мутации, которые влияют на инсулиноподобную передачу сигналов у червей, мух и на ось гормон роста/IGF1 у мышей, связаны с увеличением продолжительности жизни. У дрожжей активность Sir2 регулируется никотинамидазой PNC1. Транскрипция PNC1 активируется в стрессовых условиях, таких как ограничение калорий , тепловой шок и осмотический шок . Превращая никотинамид в ниацин , никотинамид удаляется, ингибируя активность Sir2. Никотинамидаза , обнаруженная у людей, известная как PBEF , может выполнять аналогичную функцию, а секретируемая форма PBEF, известная как висфатин , может помочь регулировать уровень инсулина в сыворотке . Однако неизвестно, существуют ли эти механизмы и у человека, поскольку существуют очевидные различия в биологии человека и модельных организмов.
Было показано, что активность Sir2 увеличивается при ограничении калорий. Из-за отсутствия доступной глюкозы в клетках доступно больше НАД+, который может активировать Sir2. Сообщалось, что ресвератрол , стильбеноид, обнаруженный в кожуре красного винограда , продлевает продолжительность жизни дрожжей, червей и мух (независимые исследователи доказали, что увеличение продолжительности жизни мух и червей невоспроизводимо). [ 10 ] ). Было показано, что он активирует Sir2 и, следовательно, имитирует эффекты ограничения калорий, если принять, что ограничение калорий действительно зависит от Sir2.
насчитывается более 1800 генов, изменяющих продолжительность жизни Согласно базе данных генов, связанных со старением GenAge, у модельных организмов : 838 у почвенного аскариды ( Caenorhabditis elegans ), 883 у пекарских дрожжей ( Saccharomyces cerevisiae ), 170 у плодовой мухи ( Drosophila). melanogaster ) и 126 у мышей ( Mus musculus ). [ 11 ]
Ниже приводится список генов, связанных с долголетием согласно исследованиям. [ 11 ] на модельных организмах :
| Podospora | Сахаромицеты | Ценорхабдитис | Дрозофила | Идти |
|---|---|---|---|---|
| Гризея | ЛАГ1 | даф-2 | дерьмо1 | Проп-1 |
| LAC1 | возраст-1 / даф-23 | кот1 | p66shc (независимо проверено) | |
| яма-1 | гр | |||
| РАС1 | даф-18 | месяц | mclk1 | |
| РАС2 | акт-1 / акт-2 | |||
| ПОБ1 | даф-16 | |||
| ПХБ2 | даф-12 | |||
| CDC7 | ctl-1 | |||
| БУД1 | старый-1 | |||
| РТГ2 | спе-26 | |||
| РПД3 | клк-1 | |||
| HDA1 | МЭВ-1 | |||
| СИР2 | ||||
| аак-2 | ||||
| СИР4-42 | ||||
| UTH4 | ||||
| YGL023 | ||||
| СГС1 | ||||
| РАД52 | ||||
| ФОБ1 |

В июле 2020 года ученые, используя общедоступные биологические данные о 1,75 млн человек с известной общей продолжительностью жизни, идентифицировали 10 геномных локусов , которые, по-видимому, внутренне влияют на продолжительность здоровья , продолжительность жизни и долголетие , о половине из которых ранее не сообщалось в общегеномном значении , и большинство из них связанных с сердечно-сосудистыми заболеваниями , и определить метаболизм гема как многообещающего кандидата для дальнейших исследований в этой области. Их исследование предполагает, что высокий уровень железа в крови, вероятно, снижает, а гены, участвующие в метаболизме железа, вероятно, увеличивают продолжительность здоровой жизни у людей. [ 13 ] [ 12 ]
Нед Шарплесс и его коллеги продемонстрировали первую in vivo связь между экспрессией р16 и продолжительностью жизни. [ 14 ] Они обнаружили снижение экспрессии р16 в некоторых тканях мышей с мутациями, продлевающими продолжительность жизни, а также у мышей, продолжительность жизни которых была увеличена за счет ограничения еды. Ян ван Дерсен и Даррен Бейкер в сотрудничестве с Андре Терзиком из клиники Майо в Рочестере, штат Миннесота, представили первые in vivo доказательства причинной связи между клеточным старением и старением путем предотвращения накопления стареющих клеток у BubR1 . прогероидных мышей [ 15 ] В отсутствие стареющих клеток в тканях мышей наблюдалось значительное улучшение обычного бремени возрастных расстройств. У них не развилась катаракта , они избежали обычного истощения мышц с возрастом. Они сохранили в коже жировые прослойки, которые с возрастом обычно истончаются и у людей вызывают появление морщин. Второе исследование, проведенное Яном ван Дёрсеном в сотрудничестве с группой сотрудников из клиники Майо и Университета Гронингена, предоставило первые прямые доказательства in vivo того, что клеточное старение вызывает признаки старения за счет элиминации стареющих клеток из прогероидных мышей путем введения индуцируемого лекарством вещества. ген суицида , а затем обработать мышей препаратом для избирательного уничтожения стареющих клеток, а не для снижения уровня p16 во всем организме. [ 16 ] Другое исследование Мэйо, проведенное Джеймсом Киркландом в сотрудничестве со Скриппсом и другими группами, продемонстрировало, что сенолитики, препараты, воздействующие на сенесцентные клетки, улучшают сердечную функцию и улучшают реактивность сосудов у старых мышей, облегчают нарушения походки, вызванные радиацией у мышей, и замедляют слабость и неврологические дисфункции. и остеопороз у прогероидных мышей. Открытие сенолитических препаратов было основано на гипотезе: исследователи использовали наблюдение о том, что стареющие клетки устойчивы к апоптозу, чтобы обнаружить, что в этих клетках активируются пути выживания. Они продемонстрировали, что эти пути выживания являются «ахиллесовой пятой» стареющих клеток с использованием подходов РНК-интерференции , включая пути, связанные с Bcl-2, AKT-, p21- и тирозинкиназой. Затем они использовали препараты, которые, как известно, нацелены на выявленные пути, и показали, что эти препараты убивают сенесцентные клетки путем апоптоза в культуре и уменьшают нагрузку сенесцентных клеток во многих тканях in vivo. Важно отметить, что эти препараты имели долгосрочный эффект после однократной дозы, соответствующий удалению сенесцентных клеток, а не временный эффект, требующий постоянного присутствия лекарств. Это было первое исследование, которое показало, что очистка стареющих клеток улучшает функцию мышей хронологического возраста. [ 17 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Класс МР (1983). «Метод выделения мутантов долголетия нематоды Caenorhabditis elegans и первоначальные результаты». Механизмы старения и развития . 22 (3–4): 279–286. дои : 10.1016/0047-6374(83)90082-9 . ПМИД 6632998 . S2CID 6870538 .
- ^ Фридман Д.Б., Джонсон Т.Э. (1988). «Мутация в гене age-1 у Caenorhabditis elegans удлиняет жизнь и снижает плодовитость гермафродитов» ( PDF ) . Генетика . 118 (1): 75–86. дои : 10.1093/генетика/118.1.75 . ПМЦ 1203268 . ПМИД 8608934 .
- ^ Готлиб С., Рувкун Г. (1994). «daf-2, daf-16 и daf-23: генетически взаимодействующие гены, контролирующие образование Дауэра у Caenorhabditis elegans » . Генетика . 137 (1): 107–120. дои : 10.1093/генетика/137.1.107 . ПМЦ 1205929 . ПМИД 8056303 .
- ^ Перейти обратно: а б Кеньон С., Чанг Дж., Генш Э., Раднер А., Табтианг Р. (1993). «Мутант C. elegans, который живет в два раза дольше дикого типа». Природа . 366 (6454): 461–4. Бибкод : 1993Natur.366..461K . дои : 10.1038/366461a0 . ПМИД 8247153 . S2CID 4332206 .
- ^ Айядевара С., Алла Р., Таден Дж.Дж., Шмуклер Рейс Р.Дж. (2008). «Удивительное долголетие и стрессоустойчивость нематодных нулевых мутантов PI3K» . Стареющая клетка . 7 (1): 13–22. дои : 10.1111/j.1474-9726.2007.00348.x . ПМИД 17996009 . S2CID 2470599 .
- ^ Шмуклер Рейс Р.Дж., Бхарилл П., Тазирслан С., Айядевара С. (2009). «Мутации чрезвычайного долголетия вызывают подавление нескольких сигнальных путей» . Biochimica et Biophysical Acta (BBA) – Общие предметы . 1790 (10): 1075–83. дои : 10.1016/j.bbagen.2009.05.011 . ПМЦ 2885961 . ПМИД 19465083 .
- ^ Перейти обратно: а б с Хён М., Ли Дж., Ли К., Мэй А., Бор В.А., Ан Б. (март 2008 г.). «Долголетие и устойчивость к стрессу коррелируют со способностью восстановления ДНК у Caenorhabditis elegans » . Нуклеиновые кислоты Рез . 36 (4): 1380–9. дои : 10.1093/нар/gkm1161 . ПМК 2275101 . ПМИД 18203746 .
- ^ Татар М., Копельман А., Эпштейн Д., Ту М.П., Инь С.М., Гарофало Р.С. (1988). «Мутантный гомолог инсулинового рецептора дрозофилы, который продлевает жизнь и нарушает нейроэндокринную функцию». Наука . 292 (5514): 107–110. дои : 10.1126/science.1057987 . ПМИД 11292875 . S2CID 28565101 .
- ^ Бартке А., Райт Дж.К., Мэттисон Дж.А., Ингрэм Д.К., Миллер Р.А., Рот Г.С. (2001). «Продление продолжительности жизни мышей-долгожителей» (PDF) . Природа . 414 (6862): 412. дои : 10.1038/35106646 . hdl : 2027.42/62803 . ПМИД 11719795 . S2CID 4379930 .
- ^ Перейти обратно: а б Бас ТМ; Вайнкове Д; Хаутхофд К; Драгоценные камни Д; Партридж Л. (октябрь 2007 г.). «Влияние ресвератрола на продолжительность жизни Drosophila melanogaster и Caenorhabditis elegans ». Механизмы старения и развития . 128 (10): 546–552. дои : 10.1016/j.mad.2007.07.007 . ПМИД 17875315 . S2CID 1780784 .
- ^ Перейти обратно: а б «База данных GenAge» . Проверено 26 февраля 2011 г.
- ^ Перейти обратно: а б Тиммерс, Пол Р.Х.Дж.; Уилсон, Джеймс Ф.; Джоши, Питер К.; Дилен, Йорис (16 июля 2020 г.). «Многовариантное геномное сканирование позволяет выявить новые локусы и метаболизм гема в старении человека» . Природные коммуникации . 11 (1): 3570. Бибкод : 2020NatCo..11.3570T . дои : 10.1038/s41467-020-17312-3 . ПМЦ 7366647 . ПМИД 32678081 .
 Текст и изображения доступны по международной лицензии Creative Commons Attribution 4.0 .
Текст и изображения доступны по международной лицензии Creative Commons Attribution 4.0 .
- ^ «Уровень железа в крови может быть ключом к замедлению старения, показывают исследования генов» . физ.орг . Проверено 18 августа 2020 г.
- ^ Кришнамурти, Дж; Торрис, К; Рэмси, MR; Ковалев Г.И.; Аль-Регай, К.; Су, Л; Шарплесс, Нью-Йорк (2004). «Экспрессия Ink4a/Arf является биомаркером старения» . Дж. Клин. Инвестируйте . 114 (9): 1299–1307. дои : 10.1172/JCI22475 . ПМК 524230 . ПМИД 15520862 .
- ^ Бейкер диджей; Давлати М.М.; Виджшейк Т; Джеганатан КБ; Малуреану Л; ван Ри Дж. Х.; Креспо-Диас Р.; Рейес С; Сиберг Л; Шапиро В; Бехфар А; Терзич А; ван де Слюис Б; ван Дёрсен Дж. М. (январь 2013 г.). «Повышенная экспрессия BubR1 защищает от анеуплоидии и рака и продлевает продолжительность здоровой жизни» . Nat Cell Biol . 15 (1): 96–102. дои : 10.1038/ncb2643 . ПМК 3707109 . ПМИД 23242215 .
- ^ Бейкер, Д.; Виджшаке, Т.; Чкония, Т.; ЛеБрассер, Н.; Чайлдс, Б.; ван де Слюис, Б.; Киркланд, Дж.; ван Дёрсен, Дж. (10 ноября 2011 г.). «Очистка p16Ink4a-положительных стареющих клеток замедляет нарушения, связанные со старением» . Природа . 479 (7372): 232–6. Бибкод : 2011Natur.479..232B . дои : 10.1038/nature10600 . ПМЦ 3468323 . ПМИД 22048312 .
- ^ Чжу, Ю; Чкония, Т; Пирцхалава, Т; Гауэр, AC ; Дин, Х; Гиоргадзе, Н; Палмер, АК; Икено, Ю; Хаббард, Великобритания; Ленбург, М; О'Хара, SP; ЛаРуссо, Северная Каролина ; Миллер, доктор медицинских наук; Росс, CM; Верзоса, Греция; ЛеБрассер, Северная Каролина; Рен, JD; Фарр, Дж. Н.; Хосла, С; Стаут, МБ; Макгоуэн, С.Дж.; Фурманн-Штройсснигг, Х; Гуркар, Австралия; Чжао, Дж; Коланджело, Д; Дорронсоро, А; Линг, ГГ; Баргути, AS; Наварро, округ Колумбия; Сано, Т; Роббинс, Пенсильвания; Нидернхофер, LJ; Киркланд, Дж. Л. (9 марта 2015 г.). «Ахиллесова пята стареющих клеток: от транскриптома к сенолитическим препаратам» . Стареющая клетка . 14 (4): 644–658. дои : 10.1111/acel.12344 . ПМК 4531078 . ПМИД 25754370 .
Внешние ссылки
[ редактировать ]- Геномные ресурсы старения человека — набор баз данных и инструментов, призванных помочь исследователям изучать генетику старения человека.
- База данных NetAge — онлайн-база данных и инструменты сетевого анализа для биогеронтологических исследований.