Интервенционное лечение боли
Интервенционное лечение боли или интервенционная медицина боли — это медицинская специализация, определенная Национальным комитетом по претензиям на униформу (NUCC) как «инвазивные вмешательства, такие как медицинская дисциплина, посвященная диагностике и лечению расстройств, связанных с болью, преимущественно с применением интервенционных методов в управление подострой, хронической, постоянной и трудноизлечимой болью независимо или в сочетании с другими методами лечения». [1] Консультативная комиссия по оплате медицинской помощи (MedPAC) определила интервенционные методы как «минимально инвазивные процедуры, включая чрескожное точное введение иглы с введением лекарств в целевые области или абляцию целевых нервов; а также некоторые хирургические методы, такие как лазерная или эндоскопическая дискэктомия, интратекальные инфузионные насосы». и стимуляторы спинного мозга для диагностики и лечения хронической, постоянной или трудноизлечимой боли». [2] Минимально инвазивные вмешательства, такие как инъекции фасеточных суставов , блокады нервов (прерывание потока болевых сигналов по определенным путям нервной системы), нейроаугментация (включая стимуляцию спинного мозга и стимуляцию периферических нервов ), вертебропластика , кифопластика , нуклеопластика , эндоскопическая дискэктомия и имплантируемая доставка лекарств. системы используются для лечения подострой или хронической боли. [3] [4]
История
[ редактировать ]Первые попытки интервенционного лечения боли восходят к истокам регионарной аналгезии и блокады нервов и постепенно превратились в отдельную специализацию. Таффер описал первую терапевтическую блокаду нервов для снятия боли в 1899 году. Фон Газа разработал диагностическую блокаду для снятия боли, используя прокаин для определения путей прохождения боли. В число современных авторов входят Боника, Винни, Радж, Рац, Богдук и другие. [5] Термин «интервенционное лечение боли» был впервые использован специалистом по лечению боли Стивеном Д. Уолдманом в 1996 году для определения новой специальности. [3] [6] Специализация интервенционного лечения боли получила специальный статус от Национального комитета по единым счетам США , что позволяет практикующим врачам выставлять счета федеральным программам здравоохранения, включая Medicare и Medicaid . Врачи, практикующие интервенционное обезболивание, представлены различными организациями, занимающимися обезболиванием, включая Американское общество врачей интервенционной боли (ASIPP), основанное Лаксмайей Манчиканти, доктором медицинских наук, в 1998 году и представляющее исключительно специалистов по интервенционному обезболиванию. [4]
Радиация
[ редактировать ]Лучевая терапия используется, когда медикаментозное лечение не может контролировать боль от растущей опухоли, например, при метастазах в кости (чаще всего), проникновении в мягкие ткани или сдавлении чувствительных нервов. Часто низких доз достаточно для достижения анальгезии, которая, как полагают, возникает из-за снижения давления или, возможно, из-за вмешательства в выработку опухолью химических веществ, вызывающих боль. [7] Радиофармацевтические препараты , нацеленные на конкретные опухоли, используются для лечения боли, вызванной метастатическими заболеваниями. Облегчение может наступить в течение недели лечения и может длиться от двух до четырех месяцев. [8]
Нейролитический блок
[ редактировать ]
Нейролитическая блокада — это преднамеренное повреждение нерва путем применения химических веществ (в этом случае процедура называется « нейролиз ») или физических агентов, таких как замораживание или нагревание (« невротомия »). [9] Эти вмешательства вызывают дегенерацию нервных волокон и временное нарушение передачи болевых сигналов. При этих процедурах тонкий защитный слой вокруг нервного волокна, базальная пластинка , сохраняется, так что по мере восстановления поврежденного волокна оно проходит внутри трубки базальной пластинки и соединяется с правильным свободным концом, и функция может быть восстановлена. Хирургическое перерезание нерва перерезает эти трубочки базальной пластинки, и без них, которые будут направлять отрастающие волокна к их утраченным соединениям, может развиться болезненная неврома или деафферентационная боль . Вот почему нейролитик предпочтительнее хирургического блока. [10]
Разрез или разрушение нервной ткани.
[ редактировать ]
Хирургическое разрезание или разрушение периферической или центральной нервной ткани в настоящее время редко используется при лечении боли. [8] Процедуры включают неврэктомию, хордотомию, повреждение зоны входа дорсального корешка и цингулотомию.
Нейрэктомия предполагает перерезание нерва и (редко) используется у пациентов с короткой продолжительностью жизни, которым лекарственная терапия не подходит из-за неэффективности или непереносимости. или дорсальный корень ганглий дорсального корешка С пользой можно воздействовать на (которые несут в основном сенсорные сигналы) (так называемая ризотомия ); при этом ганглий дорсальных корешков, возможно, является более эффективной мишенью, поскольку некоторые сенсорные волокна входят в спинной мозг из ганглия дорсальных корешков через вентральный (двигательный) корешок , и они не будут прерваны неврэктомией дорсальных корешков. Поскольку нервы часто несут как сенсорные, так и двигательные волокна, возможным побочным эффектом неврэктомии является двигательное нарушение. Обычным результатом этой процедуры является «деафферентационная боль», когда через 6–9 месяцев после операции боль возвращается с большей интенсивностью. [11]
Кордотомия включает в себя разрез спиноталамических путей , которые проходят вверх по переднему/боковому (переднебоковому) квадранту спинного мозга, передавая сигналы тепла и боли в мозг. [11]
Боль при опухоли Панкоста эффективно лечат с помощью поражения зоны входа дорсального корешка (DREZ) – повреждения области спинного мозга, где периферические болевые сигналы переходят к волокнам спинного мозга. Это серьезная операция, сопряженная с риском серьезных неврологических побочных эффектов. [11]
Цингулотомия включает перерезание волокон, которые передают сигналы непосредственно от поясной извилины к энторинальной коре головного мозга. Он уменьшает неприятность боли (не влияя на ее интенсивность), но может иметь побочные когнитивные эффекты. [11]
Интратекальная инфузия
[ редактировать ]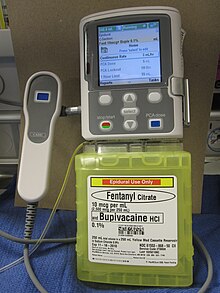
Доставка опиоидов, таких как морфин , гидроморфон , фентанил , суфентанил или меперидин, спинного мозга непосредственно в субарахноидальную полость (пространство между внутренней водонепроницаемой оболочкой и его внешними защитными оболочками) обеспечивает усиленную аналгезию с уменьшенными системными побочными эффектами и снижает риск уровень боли в трудноизлечимых случаях. анксиолитик клонидин или неопиоидный анальгетик зиконотид и местные анестетики, такие как бупивакаин , ропивакаин или тетракаин . Вместе с опиоидами также можно вводить [8] [11]
Эпидуральная инфузия
[ редактировать ]Самая внешняя защитная оболочка, окружающая спинной мозг, называется твердой мозговой оболочкой . Между ним и окружающими позвонками находится эпидуральное пространство , заполненное соединительной тканью, жиром и кровеносными сосудами и пересеченное корешками нервов спинномозговых . . В это пространство на три-шесть месяцев можно вставить катетер для введения анестетиков или анальгетиков Нить, несущая лекарство, может быть пропущена под кожу так, чтобы выйти спереди пациента. Этот процесс называется туннелированием. Это рекомендуется при длительном использовании, чтобы снизить вероятность попадания инфекции в месте выхода в эпидуральное пространство. [8]
Стимуляция спинного мозга
[ редактировать ]Электрическая стимуляция дорсальных столбов спинного мозга может вызвать аналгезию. Сначала имплантируются электроды на основании отчета пациента и результатов рентгеноскопии , а генератор носится снаружи в течение нескольких дней для оценки эффективности. Если боль уменьшилась более чем наполовину, терапия считается подходящей. В ткани под кожей верхней части ягодиц, грудной стенки или живота вырезают небольшой карман, а провода продевают под кожу от места стимуляции к карману, где они прикрепляются к плотно прилегающему генератору. [11] Кажется, что он более полезен при нейропатической и ишемической боли, чем при ноцицептивной боли , и не часто используется при лечении онкологической боли. [12]
Глубокая стимуляция мозга
[ редактировать ]Постоянная электрическая стимуляция структур глубоко внутри мозга – периакведуктального серого и перивентрикулярного серого цвета при ноцицептивной боли, а также внутренней капсулы , вентрального заднелатерального ядра и вентрального заднемедиального ядра при нейропатической боли – дала впечатляющие результаты у некоторых пациентов, но результаты варьируются и требуют соответствующего отбора пациентов. важно. Одно исследование [13] Из семнадцати пациентов с трудноизлечимыми раковыми болями выяснилось, что у тринадцати боль была практически безболезненной, и только четверым потребовались опиоидные анальгетики при выписке из больницы после вмешательства. Большинство из них в конечном итоге прибегали к опиоидам, обычно в последние несколько недель жизни. [12]
Гипофизэктомия
[ редактировать ]Гипофизэктомия представляет собой разрушение гипофиза и успешно применяется при метастатических болях при раке молочной железы и простаты. [11]
Ссылки
[ редактировать ]- ^ «Национальный комитет по единым претензиям. Специальность по интервенционному лечению боли - 09» (PDF) . Проверено 15 апреля 2021 г.
- ^ «Консультативная комиссия по оплате медицинской помощи. Отчет Конгрессу: Оплата услуг по интервенционной боли в амбулаторных условиях. Вашингтон, округ Колумбия: MedPAC. Декабрь 2001 г.» (PDF) . Проверено 15 апреля 2021 г.
- ^ Jump up to: а б Винни А. П. Предисловие. В: Интервенционное лечение боли С.Д. Уолдман и А.П. Винни (редакторы) У.Б. Сондерс, 1996.
- ^ Jump up to: а б Веб-сайт Американского общества врачей интервенционной боли (ASIPP.org)
- ^ Манчиканти Л., Босвелл М.В., Радж П.П., Рач ГБ (октябрь 2003 г.). «Эволюция интервенционного лечения боли». Врач боли . 6 (4): 485–494. ПМИД 16871301 .
- ^ Атлас интервенционного лечения боли, 3-е изд. С.Д. Уолдман (редактор) Elsevier, Филадельфия, 2010 г.
- ^ Хоскин П.Дж. (2008). «Радиотерапия». В Сайкс Н., Беннетт М.И., Юань К.С. (ред.). Клиническое лечение боли: раковая боль (2-е изд.). Лондон: Ходдер Арнольд. стр. 251–55. ISBN 978-0-340-94007-5 .
- ^ Jump up to: а б с д Аталлах Дж.Н. (2011). «Управление раковой болью». В Вадивелу Н., Урман Р.Д., Хайнс Р.Л. (ред.). Основы лечения боли . Нью-Йорк: Спрингер. стр. 597–628. дои : 10.1007/978-0-387-87579-8 . ISBN 978-0-387-87578-1 .
- ^ Фишман С., Баллантайн Дж., Ратмелл Дж. П. (январь 2010 г.). Управление болью Боники . Липпинкотт Уильямс и Уилкинс. п. 1458. ИСБН 978-0-7817-6827-6 . Проверено 15 августа 2013 г.
- ^ Уильямс Дж. Э. (2008). «Нервные блокады: химические и физические нейролитики». В Сайкс Н., Беннетт М.И., Юань К.С. (ред.). Клиническое лечение боли: раковая боль (2-е изд.). Лондон: Ходдер Арнольд. стр. 225–35. ISBN 978-0-340-94007-5 .
- ^ Jump up to: а б с д и ж г Косгроув М.А., Таунс Д.К., Фанчулло Г.Дж., Кэй А.Д. (2011). «Интервенционное лечение боли». В Вадивелу Н., Урман Р.Д., Хайнс Р.Л. (ред.). Основы лечения боли . Нью-Йорк: Спрингер. стр. 237–299. дои : 10.1007/978-0-387-87579-8 . ISBN 978-0-387-87578-1 .
- ^ Jump up to: а б Джонсон М.И., Оксберри С.Г., Робб К. (2008). «Стимуляционная аналгезия». В Сайкс Н., Беннетт М.И., Юань К.С. (ред.). Клиническое лечение боли: Раковая боль (2-е изд.). Лондон: Ходдер Арнольд. стр. 235–250. ISBN 978-0-340-94007-5 .
- ^ Молодой РФ, Брехнер Т. (март 1986 г.). «Электрическая стимуляция мозга для облегчения неизлечимых болей, вызванных раком» . Рак . 57 (6): 1266–1272. doi : 10.1002/1097-0142(19860315)57:6<1266::aid-cncr2820570634>3.0.co;2-q . ПМИД 3484665 .