Система бактериальной секреции

Системы бактериальной секреции представляют собой белковые комплексы, присутствующие на мембранах бактерий клеточных для секреции веществ. В частности, они представляют собой клеточные устройства, используемые патогенными бактериями для секреции факторов вирулентности (в основном белков) для проникновения в клетки-хозяева. Их можно разделить на различные типы в зависимости от их конкретной структуры, состава и активности. Как правило, белки могут секретироваться посредством двух разных процессов. Один процесс представляет собой одноэтапный механизм, при котором белки из цитоплазмы бактерий транспортируются и доставляются непосредственно через клеточную мембрану в клетку-хозяина. Другой включает двухэтапную активность, при которой белки сначала транспортируются из внутренней клеточной мембраны, затем откладываются в периплазме и, наконец, через внешнюю клеточную мембрану в клетку-хозяина. [ 2 ]
Эти основные различия можно различить между грамотрицательными дидермными бактериями и грамположительными монодермными бактериями . Но классификация ни в коем случае не является четкой и полной. Существует по крайней мере восемь типов, специфичных для грамотрицательных бактерий, четыре — для грамположительных бактерий, а два являются общими для обоих. [ 3 ] Кроме того, существует заметная разница между дидермными бактериями с липополисахаридом на внешней мембране (дидерм-ЛПС) и бактериями с миколевой кислотой (дидерм-миколат). [ 4 ]
Пути экспорта
[ редактировать ]Путь экспорта отвечает за прохождение внутренней клеточной мембраны у дидерм и единственной клеточной мембраны у монодерм. [ 4 ]
Система безопасности
[ редактировать ]Общая секреция (Sec) включает секрецию развернутых белков, которые сначала остаются внутри клеток. У грамотрицательных бактерий секретируемый белок направляется либо на внутреннюю мембрану, либо в периплазму. Но у грамположительных бактерий белок может оставаться в клетке или преимущественно выводится из бактерии с помощью других систем секреции. Среди грамотрицательных бактерий Escherichia coli , Vibrio cholerae , Klebsiella pneumoniae и Yersinia enterocolitica систему Sec используют . Staphylococcus aureus и Listeria monocytogenes представляют собой грамположительные бактерии, использующие систему Sec. [ 5 ]
Система Sec использует два разных пути секреции: путь SecA и путь частиц распознавания сигналов (SRP). SecA является моторным белком АТФазы и имеет множество родственных белков, включая SecD, SecE, SecF, SegG, SecM и SecY. SRP представляет собой рибонуклеопротеин (комплекс белок-РНК), который распознает и нацеливает специфические белки на эндоплазматический ретикулум у эукариот и на клеточную мембрану у прокариот. Эти два пути требуют разных молекулярных шаперонов и в конечном итоге используют канал транспортировки белков SecYEG для транспортировки белков через внутреннюю клеточную мембрану. [ 6 ] В пути SecA SecB действует как шаперон, помогая транспортировать белки в периплазму после полного синтеза пептидных цепей. В то время как в пути SRP YidC является шапероном и транспортирует белки к клеточной мембране, пока они еще подвергаются синтезу пептидов. [ 7 ] В Escherichia coli белки внутренней мембраны в основном подвергаются воздействию пути SRP, а белки внешней мембраны или периплазматические белки - пути SecA. [ 8 ] Однако недавнее исследование селективного профилирования рибосом показало, что белки внутренней мембраны с большими периплазматическими петлями подвергаются воздействию пути SecA. [ 9 ]
SecA или посттрансляционный путь
[ редактировать ]Белки синтезируются в рибосомах путем последовательного добавления аминокислот, называемого трансляцией. В пути SecA шаперонный триггерный фактор (TF) сначала связывается с открытой N-концевой сигнальной последовательностью пептидной цепи. По мере продолжения удлинения пептидной цепи TF заменяется на SecB. SecB специфически поддерживает пептид в развернутом состоянии и способствует связыванию SecA. Затем комплекс может связываться с SecYEG, посредством чего SecA активируется путем связывания с АТФ. Под действием энергии АТФ SecA продвигает белок через канал secYEG. Комплекс SecD/F также помогает вытягивать белок с другой стороны клеточной мембраны. [ 10 ]
В последние годы было высказано предположение, что путь SecA имеет котрансляционный механизм, а это означает, что SecA будет непосредственно воздействовать на полипептид во время его синтеза. [ 11 ]
Путь SRP
[ редактировать ]На этом пути SRP конкурирует с TF и связывается с N-концевой сигнальной последовательностью. Белки внутренней мембраны останавливают процесс удлинения цепи. Затем SRP связывается с мембранным рецептором FtsY. Комплекс пептидная цепь-SRP-FtsY затем транспортируется в SecY, где элонгация пептида возобновляется. [ 7 ]
Тат система
[ редактировать ]Путь твин-аргининовой транслокации (Tat-путь) аналогичен Sec в процессе секреции белков, однако он отправляет белки только в их свернутом (третичном) состоянии. Его используют все виды бактерий, а также археи, хлоропласты и митохондрии растений. [ 12 ] У бактерий система Tat экспортирует белки из цитоплазмы через внутреннюю клеточную мембрану; тогда как в хлоропластах он присутствует в тилакоидной мембране, где способствует импорту белков из стромы. [ 13 ] Белки Tat сильно различаются у разных бактерий и делятся на три основных типа, а именно TatA, TatB и TatC. Например, хотя у Bacillus subtilis есть только два функциональных белка Tat , [ 14 ] может быть более сотни Streptomyces coelicolor . [ 15 ] Сигнальные пептиды, способные узнавать белки Tat, характеризуются консенсусным мотивом Ser/Thr-Arg-Arg-X-Phe-Leu-Lys (где X может быть любой полярной аминокислотой). Именно от двух последовательных аргининов произошло название «двойная транслокация аргинина». Замена любого аргинина приводит к замедлению или срыву секреции. [ 16 ]
Путь Wss/Esx
[ редактировать ]Путь Wss/Esx ( система ESAT-6 ) иногда называют системой секреции типа VII (T7SS), несмотря на то, что он является экспортным путем. [ 4 ] Он присутствует в грамположительных бактериях (как WSS) и микобактериях (как Esx во всех дидермомиколатах), таких как M.tuberculosis , M.bovis , Streptomyces coelicolor и S.aureus . Ее также называют системой T7b у Bacillus subtilis и S. aureus . Он состоит из двух основных компонентов: мембраносвязанной гексамерной АТФазы, которая является членом семейства белков FtsK /SpoIIIE, [ 17 ] и любой из белков, родственных EsxA/EsxB, таких как EsaA, EsaD, EsxB, EsxD, а также система Ess (EssA, EssB и EsxC, обнаруженные в S. aureus ). [ 18 ] EsxA и EsxB принадлежат к суперсемейству белков WXG100 , которые образуют димерные спиральные шпильки.
У S. aureus T7SS секретирует большой токсин под названием EsaD, который является членом фермента нуклеазы . EsaD обезвреживается (детоксифицируется) во время биосинтеза с помощью своего аналога – антитоксина EsaG. Затем комплекс EsaD-EsaG связывается с EsaE. Часть EsaE связывается с EssC, который представляет собой фермент АТФазу комплекса T7SS. Во время секреции EsaG остается в цитоплазме, и только EsaD и EsaE секретируются вместе. Но у некоторых штаммов S. aureus EsaD не вырабатывается, а вместо него образуются две копии EsaG-подобных белков. Это может объяснить возникновение ССТ7 у непатогенных видов, таких как B. subtilis и S. coelicolor . [ 19 ]
Системы секреции
[ редактировать ]Системы секреции отвечают за прохождение внешней клеточной мембраны или обеих мембран в дидермах. Текущая номенклатура применима только к дидерм-ЛПС, поскольку ничего не известно о том, что используют дидермиколатные бактерии для проникновения через внешнюю мембрану. [ 4 ]
Тип I
[ редактировать ]
Система секреции типа I (T1SS или TOSS) встречается у грамотрицательных бактерий. Это зависит от активности шаперонов с использованием белков Hly и Tol. Система активируется, когда сигнальная последовательность HlyA связывает HlyB на клеточной мембране. Эта сигнальная последовательность является транспортером ABC. Комплекс HlyAB активирует HlyD, который разворачивается и перемещается к внешней клеточной мембране. Терминальный сигнал распознается TolC во внутренней мембране. HlyA секретируется из внешней мембраны через туннельный белковый канал.
ССТ1 транспортирует различные молекулы, включая ионы, углеводы, лекарства, белки. Секретируемые молекулы различаются по размеру: от небольшого Escherichia coli пептида колицина V , масса которого составляет 10 кДа, до белка клеточной адгезии LapA Pseudomonas fluorescens , масса которого составляет 520 кДа. [ 20 ] Среди наиболее известных молекул — токсины RTX и ферменты липазы.
Тип II
[ редактировать ]
Система секреции типа II (T2SS) зависит от системы Sec или Tat для начальной секреции внутри бактериальной клетки. Из периплазмы белки секретируются секретинами наружной мембраны. Секретины представляют собой мультимерный (12–14 субъединиц) комплекс порообразующих белков. Секретин поддерживается 10–15 другими белками внутренней и внешней мембраны, образуя полный аппарат секреции. [ 21 ]
Тип III
[ редактировать ]
Система секреции типа III (T3SS или TTSS) структурно аналогична и связана с базальным тельцем бактериальных жгутиков . Встречается у некоторых наиболее вирулентных грамотрицательных бактерий, таких как сальмонелла , шигелла , иерсиния , вибрион , и используется для инъекции токсичных белков в эукариотические клетки. Структуру ССТТ часто описывают как инъекционный или игольно-шприцевый аппарат. Обнаруженный у Yersinia pestis , было обнаружено, что T3SS может вводить токсины непосредственно из бактериальной цитоплазмы в цитоплазму клеток хозяина. [ 22 ]
Тип IV
[ редактировать ]
Система секреции типа IV (T4SS или TFSS) связана с системой бактериальной конъюгации , с помощью которой разные бактерии могут обмениваться своими ДНК. Участвующие бактерии могут принадлежать к одному и тому же или разным видам грамотрицательных бактерий. Он может транспортировать отдельные белки, а также белково-белковые комплексы и ДНК-белковые комплексы. Секреция переносится непосредственно из клетки-реципиента через клеточные мембраны. Agrobacterium tumefaciens , из которой он был первоначально обнаружен, использует эту систему для отправки части Т-ДНК плазмиды Ti в растительные клетки, в результате чего образуется коронковый галл (опухоль). Helicobacter pylori использует его для доставки CagA в эпителиальные клетки желудка, чтобы вызвать рак желудка. [ 23 ] Bordetella pertussis , возбудитель коклюша, секретирует свой коклюшный токсин частично через ССТ4. Legionella pneumophila имеет T4SS, называемый ICM/dot ( размножение / , вызывающая легионеллез (болезнь легионеров) , дефект в генах ) торговли органеллами внутриклеточное , который транспортирует многие бактериальные белки в эукариотического хозяина. [ 24 ] Совсем недавно было показано, что фитопатоген Xanthomonas citri использует свой T4SS для секреции эффекторов, летальных для других видов бактерий, что делает эту систему основным фактором, определяющим приспособленность межвидовой бактериальной конкуренции. [ 25 ] [ 26 ] Прототипом системы секреции типа IVA является комплекс VirB Agrobacterium tumefaciens . [ 27 ]
Тип V
[ редактировать ]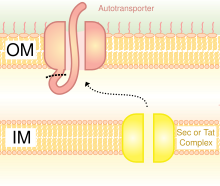
Системы секреции типа V (T5SS) отличаются от других систем секреции тем, что они секретируют сами себя и задействуют только внешнюю клеточную мембрану. Чтобы секретируемый белок прошел через внутреннюю клеточную мембрану, T5SS зависит от системы Sec. У них есть домен β-бочонка, который встраивается во внешнюю клеточную мембрану и образует канал, который может транспортировать вместе с ней секретируемый белок. За эту деятельность их еще называют автотранспортерными системами. [ 28 ] Когда секретируемые белки выходят наружу, аутотранспортеры отключаются (расщепляются), высвобождая белок из домена β-бочонка. Примером автотранспортера являются тримерные автотранспортеры . [ 29 ]
Тип VI
[ редактировать ]Системы секреции типа VI (T6SS) были обнаружены командой Джона Мекаланоса из Гарвардской медицинской школы в 2006 году у Vibrio cholerae и Pseudomonas aeruginosa . [ 30 ] [ 31 ] Они были распознаны, когда мутации в генах Vibrio Cholerae Hcp и VrgG привели к снижению вирулентности и патогенности. [ 32 ] [ 33 ] Помимо своей классической роли фактора патогенности, T6SS также участвуют в защите от простых эукариотических хищников и в межбактериальных взаимодействиях. [ 34 ] [ 35 ] Ген ССТ6 образует кластер генов, состоящий из более чем 15 генов. Гены Hcp и VgrG являются наиболее универсальными генами. Структурное сходство T6SS с хвостовым шипом фага Т4 позволяет предположить, что процесс заражения аналогичен процессу заражения фагом. [ 36 ]
Тип VII
[ редактировать ]
T7SS бактерий дидермы-ЛПС представляет собой путь шаперон-ушер . [ 4 ]
У дидермомиколатных бактерий такой системой секреции является ESAT-6 . [ 4 ]
Тип VIII
[ редактировать ]T8SS бактерий дидермы-ЛПС представляет собой внеклеточный путь нуклеации-преципитации. [ 4 ] [ 37 ]

Тип IX
[ редактировать ]Системы секреции типа IX (T9SS) регулярно обнаруживаются в линии бактерий Fibrobacteres-Chlorobi-Bacteroidetes , виды членов которой включают внешнюю мембрану. Система по-разному участвует в одном типе скользящей подвижности, в правильном нацеливании определенных факторов вирулентности на клеточную поверхность и в деградации комплекса биополимеров. [ 39 ] T9SS также известен как секреция Por (накопление порфиринов на поверхности клеток). [ 4 ] после орального возбудителя Porphyromonas gingivalis . Описано по меньшей мере шестнадцать структурных компонентов системы, включая PorU, транспептидазу, сортирующую белки , которая удаляет С-концевой сигнал сортировки из грузовых белков и вместо этого опосредует их прикрепление к липополисахариду .
Ссылки
[ редактировать ]- ^ Триведи А., Госаи Дж., Накане Д., Шривастава А. (10 мая 2022 г.). «Принципы проектирования роторной секреторной системы типа 9» . Границы микробиологии . 13 : 845563. дои : 10.3389/fmicb.2022.845563 . ПМЦ 9127263 . ПМИД 35620107 .
- ^ Боциан-Остшицкая К.М., Гжещук М.Ю., Банась А.М., Ягуштын-Крыницка Е.К. (май 2017 г.). «Бактериальные тиолоксидоредуктазы – от фундаментальных исследований к новым антибактериальным стратегиям» . Прикладная микробиология и биотехнология . 101 (10): 3977–3989. дои : 10.1007/s00253-017-8291-8 . ПМК 5403849 . ПМИД 28409380 .
- ^ Грин ER, Mecsas J (февраль 2016 г.). Кудва И.Т. (ред.). «Системы бактериальной секреции: обзор» . Микробиологический спектр . 4 (1) (5-е изд.). Издательство Американского общества микробиологии: 215–239. doi : 10.1128/microbiolspec.VMBF-0012-2015 . ISBN 9781555819286 . ПМК 4804464 . ПМИД 26999395 .
- ^ Jump up to: а б с д и ж г час Шагно С., Зоргани М.А., Астрюк Т., Дево М. (октябрь 2013 г.). «Белковые детерминанты поверхностной колонизации бактерий: бактериальная адгезия и образование биопленок с точки зрения секреции белка» . Границы микробиологии . 4 : 303. дои : 10.3389/fmicb.2013.00303 . ПМК 3796261 . ПМИД 24133488 .
- ^ Бенсинг Б.А., Сиперсауд Р., Йен Ю.Т., Саллам П.М. (август 2014 г.). «Селективный транспорт с помощью SecA2: расширяющееся семейство индивидуальных моторных белков» . Biochimica et Biophysical Acta (BBA) - Исследования молекулярных клеток . 1843 (8): 1674–1686. дои : 10.1016/j.bbamcr.2013.10.019 . ПМК 4007388 . ПМИД 24184206 .
- ^ Крейн Дж. М., Рэндалл Л. Л. (ноябрь 2017 г.). «Система Sec: экспорт белка в Escherichia coli » . ЭкоСал Плюс . 7 (2): ESP–0002–2017. doi : 10.1128/ecosalplus.ESP-0002-2017 . ПМК 5807066 . ПМИД 29165233 .
- ^ Jump up to: а б Чжу Л., Кабак Х.Р., Далбей Р.Э. (сентябрь 2013 г.). «Белок YidC, молекулярный шаперон для сворачивания белка LacY с помощью белкового механизма SecYEG» . Журнал биологической химии . 288 (39): 28180–28194. дои : 10.1074/jbc.M113.491613 . ПМЦ 3784728 . ПМИД 23928306 .
- ^ Денкс К., Фогт А., Сачелару И., Петриман Н.А., Кудва Р., Кох Х.Г. (март 2014 г.). «Транслокон Sec, опосредованный транспортом белков у прокариот и эукариотов» . Молекулярная мембранная биология . 31 (2–3): 58–84. дои : 10.3109/09687688.2014.907455 . ПМИД 24762201 .
- ^ Чжу Цзы, Ван С., Шань СО (июнь 2022 г.). «Профилирование рибосом выявило множество ролей SecA в котрансляционном экспорте белков» . Природные коммуникации . 13 (1): 3393. doi : 10.1038/s41467-022-31061-5 . ПМЦ 9192764 . ПМИД 35697696 .
- ^ Ликлама А., Ниджехольт Дж.А., Дриссен А.Дж. (апрель 2012 г.). «Бактериальная сек-транслоказа: строение и механизм действия» . Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 367 (1592): 1016–1028. дои : 10.1098/rstb.2011.0201 . ПМК 3297432 . ПМИД 22411975 .
- ^ Хубер Д., Джамшад М., Ханмер Р., Шибих Д., Деринг К., Маркомини И. и др. (январь 2017 г.). Силхави Т.Дж. (ред.). «SecA котрансляционно взаимодействует с возникающими белками-субстратами in vivo» . Журнал бактериологии . 199 (2). дои : 10.1128/JB.00622-16 . ПМК 5198489 . ПМИД 27795329 .
- ^ Йен М.Р., Ценг Ю.Х., Нгуен Э.Х., Ву Л.Ф., Сайер М.Х. (июнь 2002 г.). «Последовательность и филогенетический анализ системы экспорта белков, нацеленных на твин-аргинин (Tat)». Архив микробиологии . 177 (6): 441–450. дои : 10.1007/s00203-002-0408-4 . ПМИД 12029389 . S2CID 25129008 .
- ^ Ли П.А., Таллман-Эрчек Д., Георгиу Г. (2006). «Бактериальный путь транслокации двойного аргинина» . Ежегодный обзор микробиологии . 60 : 373–395. дои : 10.1146/annurev.micro.60.080805.142212 . ПМЦ 2654714 . ПМИД 16756481 .
- ^ Йонгблуд Дж.Д., Григер У., Антельманн Х., Хекер М., Найланд Р., Брон С., ван Дийл Дж.М. (декабрь 2004 г.). «Две минимальные транслоказы Tat в Bacillus» . Молекулярная микробиология . 54 (5): 1319–1325. дои : 10.1111/j.1365-2958.2004.04341.x . ПМИД 15554971 .
- ^ Ли Х, Жак Пе, Гине М.Г., Бжезинский Р., Морозоли Р. (июль 2005 г.). «Определение функциональности предполагаемых Tat-зависимых сигнальных пептидов в Streptomyces coelicolor A3 (2) с использованием двух разных репортерных белков» . Микробиология . 151 (Часть 7): 2189–2198. дои : 10.1099/mic.0.27893-0 . ПМИД 16000709 .
- ^ Стэнли Н.Р., Палмер Т., Беркс, Британская Колумбия (апрель 2000 г.). «Двойной аргининовый консенсусный мотив сигнальных пептидов Tat участвует в Sec-независимом нацеливании на белок в Escherichia coli» . Журнал биологической химии . 275 (16): 11591–11596. дои : 10.1074/jbc.275.16.11591 . PMID 10766774 .
- ^ Али К.А., Андерсон М., Ор Р.Дж., Миссиакас Д. (декабрь 2017 г.). «Выделение мембранного белкового комплекса для секреции типа VII у Staphylococcus aureus» . Журнал бактериологии . 199 (23): e00482–17. дои : 10.1128/JB.00482-17 . ПМЦ 5686593 . ПМИД 28874412 .
- ^ Кнеупер Х., Цао З.П., Туоми К.Б., Золтнер М., Ягер Ф., Каргилл Дж.С. и др. (сентябрь 2014 г.). «Гетерогенность в организации транскрипции ess и переменный вклад системы секреции белка Ess/типа VII в вирулентность близкородственных штаммов Staphylocccus aureus» . Молекулярная микробиология . 93 (5): 928–943. дои : 10.1111/mmi.12707 . ПМК 4285178 . ПМИД 25040609 .
- ^ Цао З., Касабона М.Г., Кнойпер Х., Чалмерс Дж.Д., Палмер Т. (октябрь 2016 г.). «Система секреции Staphylococcus aureus типа VII секретирует нуклеазный токсин, который поражает бактерии-конкуренты» . Природная микробиология . 2 : 16183. doi : 10.1038/nmicrobiol.2016.183 . ПМЦ 5325307 . ПМИД 27723728 .
- ^ Бойд С.Д., Смит Т.Дж., Эль-Кират-Шатель С., Ньюэлл П.Д., Дюфрен Ю.Ф., О'Тул Г.А. (август 2014 г.). «Структурные особенности адгезина биопленки Pseudomonas fluorescens LapA, необходимого для LapG-зависимого расщепления, образования биопленки и локализации на клеточной поверхности» . Журнал бактериологии . 196 (15): 2775–2788. дои : 10.1128/JB.01629-14 . ПМЦ 4135675 . ПМИД 24837291 .
- ^ Коротков К.В., Сандквист М., Хол В.Г. (апрель 2012 г.). «Система секреции типа II: биогенез, молекулярная архитектура и механизм» . Обзоры природы. Микробиология . 10 (5): 336–351. дои : 10.1038/nrmicro2762 . ПМЦ 3705712 . ПМИД 22466878 .
- ^ Бюттнер Д. (июнь 2012 г.). «Экспорт белка по графику: архитектура, сборка и регуляция систем секреции III типа из растительных и животных патогенных бактерий» . Обзоры микробиологии и молекулярной биологии . 76 (2): 262–310. дои : 10.1128/MMBR.05017-11 . ПМЦ 3372255 . ПМИД 22688814 .
- ^ Хатакеяма М., Хигаси Х. (декабрь 2005 г.). «Helicobacter pylori CagA: новая парадигма бактериального канцерогенеза» . Раковая наука . 96 (12): 835–843. дои : 10.1111/j.1349-7006.2005.00130.x . ПМЦ 11159386 . ПМИД 16367902 . S2CID 5721063 .
- ^ Каскалес Э., Кристи П.Дж. (ноябрь 2003 г.). «Универсальные системы секреции бактерий IV типа» . Обзоры природы. Микробиология . 1 (2): 137–149. дои : 10.1038/nrmicro753 . ПМЦ 3873781 . ПМИД 15035043 .
- ^ Соуза Д.П., Ока Г.У., Альварес-Мартинес С.Э., Биссон-Фильо А.В., Дунгер Г., Хобейка Л. и др. (март 2015 г.). «Уничтожение бактерий через систему секреции типа IV» . Природные коммуникации . 6 : 6453. Бибкод : 2015NatCo...6.6453S . дои : 10.1038/ncomms7453 . ПМИД 25743609 .
- ^ Сгро Г.Г., Коста Т.Р., Сененс В., Соуза Д.П., Кассаго А., Коутиньо де Оливейра Л. и др. (декабрь 2018 г.). «Крио-ЭМ структура основного комплекса системы секреции IV типа, убивающей бактерии, из Xanthomonas citri» . Природная микробиология . 3 (12): 1429–1440. дои : 10.1038/s41564-018-0262-z . ПМК 6264810 . ПМИД 30349081 .
- ^ Кристи П.Дж., Атмакури К., Кришнамурти В., Якубовски С., Каскалес Э. (2005). «Биогенез, архитектура и функции систем секреции бактерий IV типа» . Ежегодный обзор микробиологии . 59 : 451–485. дои : 10.1146/annurev.micro.58.030603.123630 . ПМЦ 3872966 . ПМИД 16153176 .
- ^ Танасси Д.Г., Статопулос С., Каркал А., Ли Х. (2005). «Секреция белка в отсутствие АТФ: аутотранспортер, двухпартнерская секреция и шаперонно-проводниковые пути грамотрицательных бактерий (обзор)». Молекулярная мембранная биология . 22 (1–2): 63–72. дои : 10.1080/09687860500063290 . ПМИД 16092525 . S2CID 2708575 .
- ^ Герлах Р.Г., Хензель М. (октябрь 2007 г.). «Системы секреции белков и адгезины: молекулярный арсенал грамотрицательных патогенов». Международный журнал медицинской микробиологии . 297 (6): 401–415. дои : 10.1016/j.ijmm.2007.03.017 . ПМИД 17482513 .
- ^ Пукацки С., Ма А.Т., Стертевант Д., Крастинс Б., Саррачино Д., Нельсон В.К. и др. (январь 2006 г.). «Идентификация консервативной системы секреции бактериального белка в Vibrio cholerae с использованием модельной системы хозяина Dictyostelium» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (5): 1528–1533. Бибкод : 2006PNAS..103.1528P . дои : 10.1073/pnas.0510322103 . JSTOR 30048406 . ПМЦ 1345711 . ПМИД 16432199 .
- ^ Mougous JD, Cuff ME, Raunser S, Shen A, Zhou M, Gifford CA и др. (июнь 2006 г.). «Локус вирулентности Pseudomonas aeruginosa кодирует аппарат секреции белка» . Наука . 312 (5779): 1526–1530. Бибкод : 2006Sci...312.1526M . дои : 10.1126/science.1128393 . ПМК 2800167 . ПМИД 16763151 .
- ^ Бингл Л.Е., Бейли С.М., Паллен М.Дж. (февраль 2008 г.). «Секреция типа VI: руководство для начинающих» (PDF) . Современное мнение в микробиологии . 11 (1): 3–8. дои : 10.1016/j.mib.2008.01.006 . ПМИД 18289922 .
- ^ Каскалес Э (август 2008 г.). «Набор инструментов для секреции типа VI» . Отчеты ЭМБО . 9 (8): 735–741. дои : 10.1038/embor.2008.131 . ПМК 2515208 . ПМИД 18617888 .
- ^ Шварц С., Худ Р.Д., Мугас Дж.Д. (декабрь 2010 г.). «Что делает секреция типа VI во всех этих жуках?» . Тенденции в микробиологии . 18 (12): 531–537. дои : 10.1016/j.tim.2010.09.001 . ПМЦ 2991376 . ПМИД 20961764 .
- ^ Кулхерст С.Дж. (2013). «Система секреции типа VI — широко распространенная и универсальная система нацеливания на клетки» . Исследования в области микробиологии . 164 (6): 640–654. дои : 10.1016/j.resmic.2013.03.017 . ПМИД 23542428 .
- ^ Сильверман Дж. М., Брюне Ю. Р., Каскальс Э., Мугус Дж. Д. (2012). «Строение и регуляция системы секреции VI типа» . Ежегодный обзор микробиологии . 66 : 453–472. doi : 10.1146/annurev-micro-121809-151619 . ПМК 3595004 . ПМИД 22746332 .
- ^ Барнхарт М.М., Чепмен М.Р. (2006). «Биогенез и функция курли» . Анну Рев Микробиол . 60 : 131–47. дои : 10.1146/annurev.micro.60.080805.142106 . ПМЦ 2838481 . ПМИД 16704339 .
- ^ Триведи А., Госаи Дж., Накане Д., Шривастава А. (2022). «Принципы проектирования роторной секреторной системы типа 9» . Границы микробиологии . 13 : 845563. дои : 10.3389/fmicb.2022.845563 . ПМЦ 9127263 . ПМИД 35620107 .
- ^ Вейт П.Д., Глю М.Д., Горасия Д.Г., Рейнольдс Э.К. (октябрь 2017 г.). «Секреция типа IX: образование покрытий на поверхности бактериальных клеток, участвующих в вирулентности, скользящей подвижности и деградации сложных биополимеров». Молекулярная микробиология . 106 (1): 35–53. дои : 10.1111/mmi.13752 . hdl : 11343/208056 . ПМИД 28714554 . S2CID 19387266 .