Легионелла пневмофила
| Легионелла пневмофила | |
|---|---|
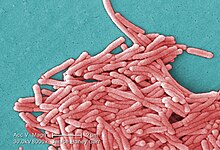 | |
| Цветная растровая электронная микрофотография L. pneumophila | |
| Научная классификация | |
| Домен: | Бактерии |
| Тип: | Псевдомонадота |
| Сорт: | Гаммапротеобактерии |
| Заказ: | Легионеллы |
| Семья: | легионелловые |
| Род: | Легионелла |
| Разновидность: | Л. пневмофила |
| Биномиальное имя | |
| Легионелла пневмофила Бреннер DJ, Steigerwalt AG, McDade JE 1979 | |
Legionella pneumophila — аэробная , плеоморфная, жгутиковая , неспорообразующая, грамотрицательная бактерия рода Legionella . [1] [2] L. pneumophila является основным патогеном человека из рода Legionella . В природе L. pneumophila заражает почвенные амебы рода Acanthamoeba и пресноводные амебофлагелляты рода Naegleria . [3] Таким образом, этот патоген обычно встречается вблизи пресноводных сред. [4] и вторгается в одноклеточную жизнь , обнаруженную в этих средах, используя их для выполнения метаболических функций. [5]
L. pneumophila также является возбудителем болезни легионеров , также известной как легионеллез. Благодаря способности L. pneumophila процветать в воде, она может расти в системах фильтрации воды, попадая в краны, душевые и другие приспособления, а затем распространяться через аэрозольные капли воды. [5] После заражения эта бактерия может вызвать пневмонию с такими симптомами, как лихорадка, делирий, диарея и снижение функции печени и почек. [6]
После первоначального открытия было обнаружено, что легионелла размножается внутри амебы и амебофлагеллят, что позволяет предположить, что бактерии, реплицирующиеся в простейших окружающей среды, обладают способностью использовать сигнальные пути в макрофагах человека. [7]
Характеристика
[ редактировать ]L. pneumophila представляет собой коккобациллу . Это грамотрицательная аэробная бактерия, неспособная гидролизовать желатин или вырабатывать уреазу . Он также неферментативен . L. pneumophila не пигментирована и не автофлуоресцирует . Он положителен к оксидазе и каталазе и продуцирует бета-лактамазу . Морфология колоний L. pneumophila серо-белая, с текстурой, напоминающей хрустальное стекло; для его развития также необходимы цистеин и железо . Он растет на агаре с дрожжевым экстрактом , а также во влажной среде, например, в водопроводной воде, в «опалоподобных» колониях.
Структура клеточной мембраны
[ редактировать ]Хотя L. pneumophila относится к грамотрицательным организмам, она плохо окрашивается из-за уникального содержания липополисахаридов во внешнем листке внешней клеточной мембраны. [8] Основы соматической антигенной специфичности этого организма расположены на боковых цепях его клеточной стенки. Химический состав этих боковых цепей как по компонентам, так и по расположению различных сахаров определяет природу соматических или О- антигенных детерминант , которые являются важным средством серологической классификации многих грамотрицательных бактерий. не менее 35 различных сероваров L. pneumophila , а также несколько других видов, разделенных на ряд сероваров. Описано [ нужна ссылка ]
Экология и водоемы
[ редактировать ]
L. pneumophila — это бактерия, которую можно обнаружить в самых разных условиях окружающей среды. Он может существовать при температуре 0–63 ° C, диапазоне pH 5,0–8,5 и уровне растворенного кислорода 0,2–15,0 мг/литр. [4]
Его можно найти в пресноводной среде с широким диапазоном температур. Хотя его можно найти и в этом более широком диапазоне, его количество размножается только при температуре 25 и 42 °C. [4] Благодаря своей способности обитать в воде, они также могут противостоять хлорированию воды и легко проникать в системы контроля воды. [4] Благодаря этой способности проникать в водные системы они могут образовывать биопленки на стенках труб, что может привести к распылению этих бактерий через краны, душевые, разбрызгиватели и другие приспособления, что приводит к заражению после длительного воздействия. [5] Основной причиной заражения L. pneumophila является сеть водоснабжения, что позволило L. pneumophila расти и размножаться в таких местах, как градирни, системы водоснабжения больниц, отелей и круизных судов. [4]
Как факультативный внутриклеточный паразит , L. pneumophila может проникать и размножаться внутри простейших в окружающей среде, особенно среди видов родов Acanthamoeba и Naegleria , которые, таким образом, могут служить резервуаром для L. pneumophila. Эти хозяева затем обеспечат защиту от неблагоприятных физических и химических условий, таких как хлорирование. [3]
Биопленки
[ редактировать ]Биопленки — это специализированные сообщества, прикрепляющиеся к поверхности, которые могут состоять из одного или нескольких разных микробов, начиная от бактерий , водорослей и простейших . Биопленки на водопроводных системах и в системах водоснабжения – это то место, где L. pneumophila может выжить. [4] В период с 2009 по 2010 год L. pneumophila стала причиной 58% всех вспышек заболеваний, передающихся через воду, связанных с питьевой водой в Соединенных Штатах, что привело к увеличению количества исследований, касающихся L. pneumophila . биопленок и распространения [9] Материал также играет роль в пролиферации биопленок. В водопроводах L. pneumophila чаще обнаруживалась в пластиковых трубах при температуре 40 °C, а не в медных трубах, что фактически подавляло рост. [4]
Экологические простейшие
[ редактировать ]Legionella — это род, который, как известно, заражает и размножается внутри видов экологических простейших. Нам известно как минимум 20 различных видов простейших, которые поддерживают внутриклеточную репликацию L. pneumophila. [10] Эта бактерия может инфицировать и выживать в таких родах простейших, как Acanthamoeba , Vermamoeba и Naegleria . Бактерии окружены устойчивой кистой, находясь внутри клетки-хозяина, что позволяет им выживать в суровых условиях окружающей среды, таких как хлор, который обычно используется в системах очистки воды. [11]
Хотя известно, что простейшие играют важную роль в экологии L. pneumophila , мало данных о том, как эти организмы взаимодействуют с другими микробами в окружающей среде и как это влияет на L. pneumophila в целом. [10]
Частота встречаемости
[ редактировать ]L. pneumophila является основным (>90%) возбудителем болезни легионеров . [12] Ежегодно в ЕС заражаются примерно 2 человека на 100 000 человек. [13] L. pneumophila часто заражает людей через источники воды низкого качества. Примерно 20% зарегистрированных случаев болезни легионеров происходят в медицинских учреждениях, домах престарелых или туристических учреждениях, которые подвергались воздействию воды, загрязненной L. pneumophila. [12] Также может существовать повышенный риск заражения L. pneumophila из частных колодцев, поскольку они часто не регулируются и не подвергаются такой тщательной дезинфекции, как муниципальные системы водоснабжения. [14] Несколько крупных вспышек болезни легионеров произошли в общественных гидромассажных ваннах из-за того, что температурный диапазон воды идеален для роста легионеллы . [15] [16]
Патогенез
[ редактировать ]
У людей L. pneumophila проникает и размножается внутри макрофагов . Интернализация бактерий может быть усилена присутствием антител и комплемента , но это не является абсолютно необходимым. Интернализация бактерий, по-видимому, происходит посредством фагоцитоза . Однако L. pneumophila также способна инфицировать нефагоцитарные клетки неизвестным механизмом. Редкая форма фагоцитоза, известная как спиральный фагоцитоз, была описана для L. pneumophila , но она не зависит от системы бактериальной секреции Dot/Icm (дефект в генах транспортировки органелл/внутриклеточного размножения) и наблюдалась для других патогенов. [17] После интернализации система Dot/Icm начинает секретировать бактериальные эффекторные белки, которые рекрутируют факторы хозяина в вакуоль, содержащую легионеллу (LCV), превращая мембрану в мембрану, неотличимую от мембраны ЭР. Этот процесс предотвращает слияние LCV с лизосомами , которые в противном случае могли бы разрушить бактерии. Именно внутри LCV происходит репликация бактерий. Целостность мембраны LCV требует постоянного снабжения липидами хозяина. [18] Исследования показали, что клеточный холестерин и цис-мононенасыщенная жирная кислота, пальмитолеиновая кислота, являются важными липидами хозяина, которые способствуют расширению мембраны LCV. [19] [20]
Факторы вирулентности
[ редактировать ]L. pneumophila обладает уникальной липополисахаридной (ЛПС) структурой, которая обладает высокой гидрофобностью из-за плотной упаковки разветвленных жирных кислот и повышенного уровня O -ацетильных и N -ацетильных групп. [21] Эта структура помогает предотвратить взаимодействие с общим корецептором иммунной системы ЛПС, CD14. [21] Существует также корреляция между ЛПС с высокой молекулярной массой и ингибированием слияния фагосом-лизосом. [21] L. pneumophila образует пили различной длины. Два белка пилей: PilE и препилинпептидаза (PilD) ответственны за образование пилей IV типа и последующую внутриклеточную пролиферацию. [22] L. pneumophila обладает единственным полярным жгутиком , который используется для подвижности клеток, адгезии, инвазии в хозяина и образования биопленок. [21] Те же самые регуляторы, которые контролируют жгутикование, также контролируют избегание лизосом и цитотоксичность . [21] Потенциатор инфекционности макрофагов является еще одним ключевым компонентом инвазии клетки-хозяина и внутриклеточной репликации. MIP демонстрирует активность пептидил-пролил- цис/транс -изомеразы (PPIase), которая имеет решающее значение для выживания внутри макрофагов, а также для трансмиграции через эпителиальный барьер легких. [21] [22]
Система секреции Dot/Icm типа IV
[ редактировать ]Бактерии используют систему секреции типа IVB, известную как Dot/Icm, для инъекции эффекторных белков в хозяина. Эти эффекторы участвуют в повышении способности бактерий выживать внутри клетки-хозяина. L. pneumophila кодирует более 330 «эффекторных» белков. [23] которые секретируются системой транслокации Dot/Icm, вмешиваясь в процессы в клетках-хозяевах и способствуя выживанию бактерий. Было предсказано, что род Legionella кодирует более 10 000, а возможно, и до ~ 18 000 эффекторов, которые с высокой вероятностью секретируются в клетки-хозяева. [24] [25]
Одним из основных способов использования L. pneumophila своих эффекторных белков является вмешательство в слияние вакуоли, содержащей легионеллу, хозяина с эндосомами и, таким образом, защита от лизиса. [26] Исследования нокаута транслоцированных эффекторов Dot/Icm показывают, что они жизненно важны для внутриклеточного выживания бактерий, но считается, что многие отдельные эффекторные белки функционируют избыточно, поскольку нокауты одного эффектора редко препятствуют внутриклеточному выживанию. Такое большое количество транслоцированных эффекторных белков и их избыточность, вероятно, являются результатом того, что бактерия эволюционировала во многих различных простейших хозяевах. [27]
легионеллу Вакуоль, содержащая
[ редактировать ]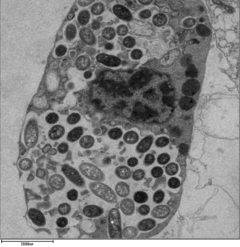
Чтобы легионелла выжила в макрофагах и простейших, она должна создать специализированный отсек, известный как вакуоль, содержащая легионеллу (LCV). Благодаря действию системы секреции Dot/Icm бактерии способны предотвращать деградацию по обычному пути эндосомального транспорта и вместо этого размножаться. Вскоре после интернализации бактерии специфически рекрутируют происходящие из эндоплазматического ретикулума везикулы и митохондрии, , в LCV, одновременно предотвращая рекрутирование эндосомальных маркеров, таких как Rab5a и Rab7a . Формирование и поддержание вакуолей имеют решающее значение для патогенеза; Бактерии, у которых отсутствует система секреции Dot/Icm, непатогенны и не могут реплицироваться внутри клеток, тогда как удаление эффектора Dot/Icm SdhA приводит к дестабилизации вакуолярной мембраны и отсутствию репликации бактерий. [28] [29]
Метаболизм
[ редактировать ]L. pneumophila использует гликолиз , путь Энтнера-Дудорова (ED), пентозофосфатный путь (PP) и цикл лимонной кислоты (TCA). [30] Хотя L. pneumophila также может осуществлять глюконеогенез , у нее нет генов, кодирующих 1,6-бифосфатазы. Поэтому для завершения глюконеогенеза используются другие ферменты. Вместо этого используется один фермент — фруктозо-6-фосфатальдолаза. [30] Эта тенденция также присутствует, когда речь идет о пути PP, который может происходить без таких субстратов, как 6-фосфоглюконатдегидрогеназа. [30] Пути ED и PP являются основными путями метаболизма глюкозы в этом организме. Было обнаружено, что наряду с этими путями серин является основным питательным веществом из-за его способности превращаться в пируват, который является важным промежуточным продуктом метаболических путей у L. pneumophila . [30]
Хотя метаболизм глюкозы используется, он не является одним из основных путей синтеза в организме. При использовании сред, содержащих глюкозу, рост L. pneumophila не увеличивался, а углеводы не считались важным источником углерода для L. pneumophila. Глюкоза может выступать ко-субстратом только при определенных условиях, так как этот микроб использует аминокислоты чаще и эффективнее. [30]
Приобретение питательных веществ
[ редактировать ]Легионелла ауксотрофна по семи аминокислотам: цистеину, лейцину, метионину, валину, треонину, изолейцину и аргинину. Попав в клетку-хозяина, легионелла нуждается в питательных веществах для роста и размножения. Внутри вакуоли доступность питательных веществ низкая; Высокая потребность в аминокислотах не покрывается за счет транспорта свободных аминокислот, находящихся в цитоплазме хозяина . Чтобы улучшить доступность аминокислот, паразит стимулирует механизмы протеасомной деградации хозяина. Этот процесс у L. pneumophila включает SCF1 убиквитинлигазу и эффектор F-Box AnkB , который фарнезилируется под действием трех ферментов хозяина, локализованных в мембране LCV: фарнезилтрансферазы , Ras-превращающего фермента-1 протеазы и ICMT . Фарнезилирование позволяет AnkB закрепиться на цитоплазматической стороне вакуоли. SCF1 и AnkB взаимодействуют друг с другом, разрушая Lys-связанные полиубиквитинированные белки. [31] Это приводит к образованию избытка свободных аминокислот в цитоплазме клеток, инфицированных L. pneumophila , которые можно использовать для внутривакуолярной пролиферации паразита.
K48-связанное полиубиквитинирование является маркером протеасомной деградации, которая высвобождает пептиды длиной от 2 до 24 аминокислот, которые быстро разлагаются до аминокислот различными олигопептидазами и аминопептидазами, присутствующими в цитоплазме. Аминокислоты импортируются в LCV через различные переносчики аминокислот, такие как переносчик нейтральных аминокислот B(0) . [31]
Аминокислоты являются основным источником углерода и энергии для L. pneumophila , у которой есть почти 12 классов ABC-транспортеров , пермеазы аминокислот и множество протеаз для их использования. Импортированные аминокислоты используются L. pneumophila для выработки энергии в рамках цикла ТСА (цикл Кребса), а также в качестве источников углерода и азота. Поскольку расщепление аминокислот действует как основной источник углерода для L. pneumophila, этот микроб не так сильно зависит от глюкозы. Несмотря на это, L. pneumophila содержит несколько амилаз, таких как LamB, которые гидролизуют полисахариды до мономеров глюкозы для метаболизма. Потеря LamB может привести к серьезным проблемам с ростом L. pneumophila. [32]
Однако стимулирование протеасомной деградации для получения аминокислот и гидролиза полисахаридов может быть не единственной стратегией вирулентности для получения источников углерода и энергии от хозяина. Деградационные ферменты, секретируемые типом II, могут обеспечить дополнительную стратегию генерации источников углерода и энергии. [33] L. pneumophila — единственный известный внутриклеточный патоген, имеющий систему секреции типа II (секретом). При секреции типа II белки сначала транслоцируются через внутреннюю мембрану в периплазматическое пространство. Этот процесс опосредован либо Sec, либо Tat путем. Вскоре после этого те же белки транспортируются через определенную пору во внешней мембране наружу клетки. Считается, что этот секретом включает в себя до 60 белков. [33]
Геномика
[ редактировать ]| NCBI Идентификатор генома | 416 |
|---|---|
| Плоидность | гаплоидный |
| Размер генома | 3,44 Мб |
| Количество хромосом | 1 |
| Год завершения | 2004 |
Определение и публикация полных последовательностей генома трех клинических изолятов L. pneumophila в 2004 г. проложили путь к пониманию молекулярной биологии L. pneumophila в частности и Legionella в целом. В 2007 году был обнаружен четвертый штамм: штамм L. pneumophila Corby. [34] Эти четыре штамма очень похожи по размеру: штамм Lens имеет размер около 3,3 МБ, а штамм Paris и Corby - около 3,5 МБ. Этот больший размер отражает большее количество генов, что соответствует способности легионеллы адаптироваться к различным хозяевам и окружающей среде. Во всех четырех штаммах L. pneumophila наблюдается относительно высокое содержание эукариотоподобных белков (ELP), что позволяет предположить, что эти ELP полезны для их повседневной функции. Фактически, ожидается, что многие из этих ELP принесут пользу патогену в модуляции клетки-хозяина. Углубленный сравнительный анализ генома с использованием массивов ДНК для изучения содержания генов 180 штаммов Legionella выявил высокую геномную пластичность и частые случаи горизонтального переноса генов . Дальнейшее понимание L. pneumophila жизненного цикла было получено путем изучения профиля экспрессии генов L. pneumophila у Acanthamoeba castellanii , распространенного вида-хозяина. L. pneumophila имеет двухфазный жизненный цикл и определяет трансмиссивные и репликативные признаки в соответствии с профилями экспрессии генов. [2]
Генетическая трансформация
[ редактировать ]Трансформация — бактериальная адаптация, заключающаяся в переносе ДНК от одной бактерии к другой через окружающую жидкую среду. Трансформация — бактериальная форма полового размножения . [35] Чтобы бактерия могла связать, принять и рекомбинировать экзогенную ДНК в свою хромосому, она должна войти в особое физиологическое состояние, называемое « компетентностью ».
Чтобы определить, какие молекулы могут вызывать компетентность у L. pneumophila , были протестированы 64 токсичные молекулы. [36] Только шесть из этих молекул, все агенты, повреждающие ДНК, вызвали сильную индукцию компетентности. Это митомицин С (который создает межцепочечные поперечные связи ДНК), норфлоксацин , офлоксацин и налидиксовая кислота (ингибиторы ДНК-гиразы , вызывающие двухцепочечные разрывы), бицикломицин (вызывает двухцепочечные разрывы) и гидроксимочевина (вызывает окисление ДНК). базы). Эти результаты позволяют предположить, что способность к трансформации у L. pneumophila развилась как ответ на повреждение ДНК . [36] Возможно, индукция компетентности обеспечивает преимущество выживания у естественного хозяина, как это происходит с другими патогенными бактериями. [35]
Цели по наркотикам
[ редактировать ]Несколько ферментов бактерий были предложены в качестве потенциальных мишеней для лекарств. Например, ферменты пути поглощения железа были предложены в качестве важных мишеней для лекарств. [37] Кроме того, класс cN-II специфичной для IMP/GMP 5´-нуклеотидазы , которая была тщательно охарактеризована кинетически. Тетрамерный фермент демонстрирует аспекты положительной гомотропной кооперативности , активации субстрата и представляет собой уникальный аллостерический сайт , который можно использовать для разработки эффективных лекарств против фермента и, следовательно, против организма. Более того, этот фермент отличается от своего человеческого аналога, что делает его привлекательной мишенью для разработки лекарств.
Обнаружение и лечение
[ редактировать ]Антисыворотки использовались как для исследований агглютинации на предметных стеклах , так и для прямого обнаружения бактерий в тканях с использованием иммунофлуоресценции с помощью флуоресцентно -меченных антител . Специфические антитела у пациентов можно определить с помощью непрямого флуоресцентного теста на антитела. ИФА и тесты микроагглютинации. Также успешно применяются [38]
Легионелла плохо окрашивается по Граму, положительно окрашивается серебром и культивируется на угольно-дрожжевом экстракте с железом и цистеином. [ нужна ссылка ] Последовательным методом, который использовался для выявления заболевания, является тест на антиген в моче. [39]
Эффективное лечение антибиотиками легионеллезной пневмонии включает фторхинолоны ( левофлоксацин или моксифлоксацин ) или, альтернативно, азитромицин . [39] Не было обнаружено существенных различий между использованием фторхинолонов и азитромицина для лечения легионеллезной пневмонии. [39] Комбинированное лечение с рифампицином тестируется как ответ на устойчивость к антибиотикам при монотерапии, хотя его эффективность остается неопределенной. [39]
Эти антибиотики действуют лучше всего, поскольку L. pneumophila является внутриклеточным патогеном . [40] Левофлоксацин и азитромицин обладают большой внутриклеточной активностью и способны проникать в клетки, инфицированные легионеллами . Американское общество инфекционистов рекомендует 5–10 дней лечения левофлоксацином или 3–5 дней лечения азитромицином, однако пациентам с ослабленным иммунитетом или тяжелым заболеванием может потребоваться расширенный курс лечения. [40]
Ссылки
[ редактировать ]- ^ Мэдиган М., Мартинко Дж., ред. (2005). Брок Биология микроорганизмов (11-е изд.). Прентис Холл. ISBN 0-13-144329-1 .
- ^ Jump up to: а б Хойнер К., Суонсон М., ред. (2008). Легионелла: Молекулярная микробиология . Кайстер Академик Пресс. ISBN 978-1-904455-26-4 .
- ^ Jump up to: а б Роуботэм Т.Дж. (декабрь 1980 г.). «Предварительное сообщение о патогенности Legionella pneumophila для пресноводных и почвенных амеб» . Журнал клинической патологии . 33 (12): 1179–1183. дои : 10.1136/jcp.33.12.1179 . ПМЦ 1146371 . ПМИД 7451664 .
- ^ Jump up to: а б с д и ж г Узел А, Хамес-Коджабас Э.Э. (2010). Legionella Pneumophila: от окружающей среды к болезни . Издательство NOVA Science. стр. 5–8. hdl : 11454/19520 . ISBN 978-1-60876-947-6 .
- ^ Jump up to: а б с Абдель-Нур М., Дункан С., Лоу Д.Э., Гайард С. (октябрь 2013 г.). «Биопленки: оплот Legionella pneumophila» . Международный журнал молекулярных наук . 14 (11): 21660–21675. дои : 10.3390/ijms141121660 . ПМЦ 3856027 . ПМИД 24185913 .
- ^ Джорджевич З., Фолик М., Петрович И., Зорник С., Стойкович А., Милянович А. и др. (май 2022 г.). «Вспышка болезни легионеров у новорожденных в Сербии». Педиатрия и международное здоровье детей . 42 (2): 59–66. дои : 10.1080/20469047.2022.2108672 . ПМИД 35944175 . S2CID 251468797 .
- ^ Гомес-Валеро Л., Бухризер С. (июнь 2013 г.). «Динамика генома легионеллы: основа универсальности и адаптации к внутриклеточной репликации» . Перспективы Колд-Спринг-Харбора в медицине . 3 (6): а009993. doi : 10.1101/cshperspect.a009993 . ПМЦ 3662349 . ПМИД 23732852 .
- ^ Райан К.Дж., Рэй К.Г., ред. (2004). «Глава 26: Легионелла». Медицинская микробиология Шерриса (4-е изд.). МакГроу Хилл. ISBN 978-0-8385-8529-0 .
- ^ Шен Ю., Монрой Г.Л., Дерлон Н., Джанджароен Д., Хуанг С., Моргенрот Э. и др. (апрель 2015 г.). «Роль шероховатости биопленки и гидродинамических условий в адгезии Legionella pneumophila к моделируемым биопленкам питьевой воды и их отделении от них» . Экологические науки и технологии . 49 (7): 4274–4282. Бибкод : 2015EnST...49.4274S . дои : 10.1021/es505842v . ПМЦ 4472476 . ПМИД 25699403 .
- ^ Jump up to: а б Дей Р., Мамери М.Р., Трайкович-Боденнец С., Боденнец Дж., Пернин П. (сентябрь 2020 г.). «Влияние межамебного фагоцитоза на рост L. pneumophila». Письма FEMS по микробиологии . 367 (18). дои : 10.1093/femsle/fnaa147 . ПМИД 32860684 .
- ^ Мучеса П., Лейфельс М., Юрзик Л., Барнард Т.Г., Барти С. (2018). «Обнаружение амебоассоциированной Legionella pneumophila в больничных водопроводных сетях Йоханнесбурга» . Южноафриканский журнал инфекционных заболеваний . 33 (3): 72–75. дои : 10.1080/23120053.2018.1434060 . S2CID 90027194 – через SAJID.
- ^ Jump up to: а б Донохью М.Дж., Фам М., Браун С., Исваран К.М., Веспер С., Мистри Дж.Х. (июнь 2023 г.). «Качество воды влияет на определение Legionella pneumophila» . Исследования воды . 238 : 119989. Бибкод : 2023WatRe.23819989D . дои : 10.1016/j.watres.2023.119989 . ПМЦ 10351031 . ПМИД 37137207 .
- ^ Лупия Т., Корчионе С., Шбакло Н., Риццелло Б., Де Бенедетто И., Консиальди Е. и др. (февраль 2023 г.). « Инфекции Legionella pneumophila в ходе 7-летнего ретроспективного анализа (2016-2022 гг.): эпидемиологические, клинические особенности и результаты у пациентов с болезнью легионеров» . Микроорганизмы . 11 (2): 498. doi : 10.3390/microorganisms11020498 . ПМЦ 9965988 . ПМИД 36838463 .
- ^ Мапили К., Пипер К.Дж., Дай Д., Пруден А., Эдвардс М.А., Тан М., Роудс У.Дж. (апрель 2020 г.). «Встречаемость Legionella pneumophila в питьевой воде, подаваемой из частных колодцев». Письма по прикладной микробиологии . 70 (4): 232–240. дои : 10.1111/lam.13273 . ПМИД 31904109 . S2CID 209894300 .
- ^ Куроки Т., Амемура-Маэкава Дж., Охья Х., Фурукава И., Сузуки М., Масаока Т. и др. (февраль 2017 г.). «Вспышка болезни легионеров, вызванная Legionella pneumophila серогрупп 1 и 13» . Новые инфекционные заболевания . 23 (2): 349–351. дои : 10.3201/eid2302.161012 . ПМК 5324795 . ПМИД 28098535 .
- ^ Донован К.В., Макфаркуар Дж.К., Уилсон Э., Средл М., Танц Л.Дж., Маллендор Дж. и др. (март 2023 г.). «Вспышка болезни легионеров, связанная с выставкой гидромассажных ванн на ярмарке штата Северная Каролина, сентябрь 2019 г.» Отчеты общественного здравоохранения . 139 (1): 79–87. дои : 10.1177/00333549231159159 . ПМЦ 10905752. ПМИД 36971250 . S2CID 257765345 .
- ^ Риттиг М.Г., Краузе А., Хойпл Т., Шайбл У.Е., Моделл М., Крамер М.Д. и др. (октябрь 1992 г.). «Спиральный фагоцитоз является предпочтительным фагоцитарным механизмом для Borrelia burgdorferi» . Инфекция и иммунитет . 60 (10): 4205–4212. дои : 10.1128/iai.60.10.4205-4212.1992 . ПМК 257454 . ПМИД 1398932 .
- ^ Абшир, Флорида; Драгой, AM; Рой, ЧР; Иванов, С.С. (2016). «Метаболическое перепрограммирование, управляемое MTOR, регулирует гомеостаз внутриклеточной ниши Legionella pneumophila» . ПЛОС Патогены . 12 (12): e1006088. doi : 10.1371/journal.ppat.1006088 . ПМК 5179073 . ПМИД 27942021 .
- ^ Ондари, Э.; Уилкинс, А.; Латимер, Б.; Драгой, AM; Иванов, С.С. (2023). «Клеточный холестерин лицензирует внутриклеточную репликацию Legionella pneumophila в макрофагах» . Microbial Cell (Грац, Австрия) . 10 (1): 1–17. дои : 10.15698/mic2023.01.789 . ПМЦ 9806796 . ПМИД 36636491 .
- ^ Уилкинс, Эшли А.; Шварц, Бенджамин; Торрес-Эскобар, Вознесение; Касторе, Рено; Лэндри, Лейн; Латимер, Брайан; Борнсен, Эрик; Босио, Катарина М.; Драгой, Ана-Мария; Иванов, Станимир С. (2024). «Внутриклеточный рост вакуолярного патогена Legionella pneumophila зависит от состава ацильной цепи мембран хозяина» . Границы в бактериологии . 3 . дои : 10.3389/fbrio.2024.1322138 .
- ^ Jump up to: а б с д и ж Шевчук О., Ягер Дж., Штайнерт М. (2011). «Вирулентные свойства клеточной оболочки легионеллы пневмофилы» . Границы микробиологии . 2 : 74. дои : 10.3389/fmicb.2011.00074 . ПМК 3129009 . ПМИД 21747794 .
- ^ Jump up to: а б Талапко Дж., Фрауэнхайм Э., Юзбашич М., Томас М., Матич С., Юкич М. и др. (январь 2022 г.). « Legionella pneumophila – Факторы вирулентности и возможность заражения в стоматологической практике» . Микроорганизмы . 10 (2): 255. doi : 10.3390/microorganisms10020255 . ПМЦ 8879694 . ПМИД 35208710 .
- ^ Энсмингер А.В. (февраль 2016 г.). «Legionella pneumophila, вооруженная до упора: оправдание самого большого арсенала эффекторов в бактериальном мире». Современное мнение в микробиологии . 29 : 74–80. дои : 10.1016/j.mib.2015.11.002 . ПМИД 26709975 .
- ^ Бурштейн Д., Амаро Ф., Зусман Т., Лифшиц З., Коэн О., Гилберт Дж.А. и др. (февраль 2016 г.). «Геномный анализ 38 видов Legionella выявил большой и разнообразный репертуар эффекторов» . Природная генетика . 48 (2): 167–175. дои : 10.1038/ng.3481 . ПМК 5050043 . ПМИД 26752266 .
- ^ Гомес-Валеро Л., Русник С., Карсон Д., Мондино С., Перес-Кобас А.Е., Роландо М. и др. (февраль 2019 г.). «Более 18 000 эффекторов в геноме рода Legionella обеспечивают множество независимых комбинаций для репликации в клетках человека» . Труды Национальной академии наук Соединенных Штатов Америки . 116 (6): 2265–2273. Бибкод : 2019PNAS..116.2265G . дои : 10.1073/pnas.1808016116 . ПМК 6369783 . ПМИД 30659146 .
- ^ Пан X, Люрманн А., Сато А., Ласковски-Арсе М.А., Рой Ч.Р. (июнь 2008 г.). «Белки с повторами анкирина составляют разнообразное семейство бактериальных эффекторов IV типа» . Наука . 320 (5883): 1651–1654. Бибкод : 2008Sci...320.1651P . дои : 10.1126/science.1158160 . ПМК 2514061 . ПМИД 18566289 .
- ^ Жюль М., Бухризер С. (июнь 2007 г.). «Адаптация Legionella pneumophila к внутриклеточной жизни и реакция хозяина: данные геномики и транскриптомики» . Письма ФЭБС . 581 (15): 2829–2838. Бибкод : 2007FEBSL.581.2829J . дои : 10.1016/j.febslet.2007.05.026 . ПМИД 17531986 . S2CID 23203471 .
- ^ Хардинг Ч.Р., Стоунхэм К.А., Шуэлейн Р., Ньютон Х., Оутс К.В., Хартланд Э.Л. и др. (июль 2013 г.). «Эффектор Dot/Icm SdhA необходим для вирулентности Legionella pneumophila у мышей Galleria mellonella и A/J» . Инфекция и иммунитет . 81 (7): 2598–2605. дои : 10.1128/IAI.00296-13 . ПМЦ 3697626 . ПМИД 23649096 .
- ^ Кризи Э.А., Исберг Р.Р. (февраль 2012 г.). «Белок SdhA поддерживает целостность вакуоли, содержащей легионеллу» . Труды Национальной академии наук Соединенных Штатов Америки . 109 (9): 3481–3486. дои : 10.1073/pnas.1121286109 . ПМК 3295292 . ПМИД 22308473 .
- ^ Jump up to: а б с д и Эйзенрайх В., Хойнер К. (ноябрь 2016 г.). «Патометаболизм Legionella pneumophila на разных стадиях жизни» . Письма ФЭБС . 590 (21): 3868–3886. дои : 10.1002/1873-3468.12326 . ПМИД 27455397 . S2CID 8187321 .
- ^ Jump up to: а б Прайс Коннектикут, Ричардс А.М., Абу Квайк Ю. (26 августа 2014 г.). «Получение и извлечение питательных веществ из цитозоля клетки-хозяина внутривакуолярной Legionella pneumophila» . Границы клеточной и инфекционной микробиологии . 4 : 111. дои : 10.3389/fcimb.2014.00111 . ПМК 4143614 . ПМИД 25207263 .
- ^ Бест А, Прайс С, Озаник М, Сантик М, Джонс С, Абу Квайк Ю (апрель 2018 г.). «Амилаза Legionella pneumophila необходима для внутриклеточной репликации в макрофагах и амебах человека» . Научные отчеты . 8 (1): 6340. Бибкод : 2018НатСР...8.6340Б . дои : 10.1038/s41598-018-24724-1 . ПМК 5910436 . ПМИД 29679057 .
- ^ Jump up to: а б Минц CS (декабрь 1999 г.). «Перенос генов у Legionella pneumophila». Микробы и инфекции . 1 (14): 1203–1209. дои : 10.1016/s1286-4579(99)00241-5 . ПМИД 10580276 .
- ^ Штайнерт М., Хойнер К., Бухризер С., Альберт-Вайссенбергер С., Глёкнер Г. (ноябрь 2007 г.). «Патогенность легионеллы: структура генома, регуляторные сети и реакция клетки-хозяина». Международный журнал медицинской микробиологии . Спецвыпуск: Патогеномика. 297 (7–8): 577–587. дои : 10.1016/j.ijmm.2007.03.009 . ПМИД 17467337 .
- ^ Jump up to: а б Мишод Р.Э., Бернштейн Х., Недельку А.М. (май 2008 г.). «Адаптационное значение пола у микробных патогенов». Инфекция, генетика и эволюция . 8 (3): 267–285. Бибкод : 2008InfGE...8..267M . дои : 10.1016/j.meegid.2008.01.002 . ПМИД 18295550 .
- ^ Jump up to: а б Шарпантье X, Кей Э, Шнайдер Д, Шуман ХА (март 2011 г.). «Антибиотики и УФ-излучение вызывают способность к естественной трансформации Legionella pneumophila» . Журнал бактериологии . 193 (5): 1114–1121. дои : 10.1128/JB.01146-10 . ПМК 3067580 . ПМИД 21169481 .
- ^ Чианчиотто НП (май 2015 г.). «Обновленная информация о приобретении железа Legionella pneumophila: новые пути поглощения сидерофоров и восстановления трехвалентного железа» . Будущая микробиология . 10 (5): 841–851. дои : 10.2217/fmb.15.21 . ПМЦ 4461365 . ПМИД 26000653 .
- ^ Конвей де Макарио Э., Макарио А.Дж., Волин М.Дж. (январь 1982 г.). «Специфические антисыворотки и иммунологические процедуры для характеристики метаногенных бактерий» . Журнал бактериологии . 149 (1): 320–328. дои : 10.1128/jb.149.1.320-328.1982 . ПМК 216625 . ПМИД 6172417 .
- ^ Jump up to: а б с д Виасус Д, Гайя В, Манзур-Барбур С, Карратала Дж (июнь 2022 г.). «Болезнь легионеров: обновленная информация о диагностике и лечении» . Инфекционные болезни и терапия . 11 (3): 973–986. дои : 10.1007/s40121-022-00635-7 . ПМЦ 9124264 . ПМИД 35505000 .
- ^ Jump up to: а б Кунья Б.А., Бурильо А., Буза Э. (январь 2016 г.). "Болезнь легионеров". Ланцет . 387 (10016): 376–385. дои : 10.1016/s0140-6736(15)60078-2 . ПМИД 26231463 . S2CID 38821013 .