Ориентия цуцугамуси
| Ориентия цуцугамуси | |
|---|---|
 | |
| Ориентия цуцугамуси | |
| Научная классификация | |
| Домен: | |
| Тип: | |
| Сорт: | |
| Заказ: | |
| Семья: | |
| Род: | |
| Разновидность: | О. цуцугамуси |
| Биномиальное имя | |
| Ориентия цуцугамуси (Хаяси, 1920) (Огата, 1929) Тамура и др. , 1995 г. | |
Orientia tsutsugamushi (от японского tsutsuga, означающего «болезнь», и mushi, означающего «насекомое») — это клещами переносимая бактерия, принадлежащая к семейству Rickettsiaceae , которая вызывает у людей заболевание, называемое кустарниковым тифом . [1] Это естественный и облигатный внутриклеточный паразит клещей семейства Trombiculidae . [2] [3] Имея размер генома всего 2,0–2,7 МБ, он имеет наиболее повторяющиеся последовательности ДНК среди секвенированных на данный момент бактериальных геномов. Заболевание, скрабовый тиф, возникает, когда зараженные личинки клещей случайно кусают человека. Эта инфекция может оказаться фатальной, если доксициклином не начать немедленную терапию .
Инфекция Orientia tsutsugamushi впервые была зарегистрирована в Японии Хакудзю Хасимото в 1810 году и в западном мире Теобальдом Адрианом Палмом в 1878 году. Наосукэ Хаяси впервые описал ее в 1920 году, дав название Theileria tsutsugamushi . Благодаря своим уникальным свойствам он был переименован в Orientia tsutsugamushi в 1995 году . В отличие от других грамотрицательных бактерий , его нелегко окрашивать красителем по Граму , поскольку его клеточная стенка лишена липофосфогликанов и пептидогликана . Благодаря высоковариабельному мембранному белку массой 56 кДа бактерию можно разделить по антигенному признаку на множество штаммов (подтипов). Классическими штаммами являются Карп (на долю которого приходится около 50% всех инфекций), Гиллиам (25%), Като (менее 10%), Симокоши, Куроки и Кавасаки. [4] Внутри каждого штамма существует огромная изменчивость.
Orientia tsutsugamushi естественным образом сохраняется в популяции клещей путем передачи от самки к яйцам (трансовариальная передача), а также от яиц к личинкам и затем к взрослым особям (транстадиальная передача). Личинки клещей, называемые чиггерами , являются естественными эктопаразитами грызунов. Человек заражается при случайном контакте с зараженными чиггерами. Похожий на рубец струп, называемый струпом, является хорошим индикатором инфекции, но не является повсеместным. Бактерия является эндемичной для так называемого треугольника Цуцугамуси — региона, охватывающего Дальний Восток России на севере, Японию на востоке, северную Австралию на юге и Афганистан на западе. По оценкам, ежегодно происходит один миллион инфекций. Антибиотики, такие как азитромицин и доксициклин, являются основными лекарствами, отпускаемыми по рецепту; хлорамфеникол и тетрациклин также эффективны. Диагностика инфекции сложна и требует трудоемких методов, таких как тест Вейля-Феликса , быстрый иммунохроматографический тест, иммунофлуоресцентный анализ и полимеразная цепная реакция. . Вакцины от этой инфекции не существует.
История
[ редактировать ]Самая ранняя запись об инфекции O. tsutsugamushi относится к III веку (313 г. н. э.) в Китае. [5] Японцам также была известна связь между инфекцией и клещами на протяжении веков. Они дали несколько названий, таких как сима-муси , акамуси (красный клещ) или кэдани (волосатый клещ) болезнь северной Японии, и наиболее популярное название - цуцугамуси (от цуцуга, означающего лихорадку, вред или болезнь, и муси, означающего насекомое или насекомое). Японский врач Хакудзю Хашимото дал первое медицинское заключение из префектуры Ниигата в 1810 году. Он зафиксировал распространение инфекции по берегам верхних притоков реки Синано . [6] Первый отчет западному миру сделал Теобальд Адриан Палм, врач Эдинбургского медицинского миссионерского общества в Ниигате в 1878 году. Описывая свой опыт из первых рук, Палм писал:
Прошлым летом [т. е. 1877 г.] мне представилась возможность наблюдать болезнь, которая, насколько мне известно, характерна только для Японии и еще не описана. Более того, это происходит в некоторых хорошо заметных районах и в определенное время года, так что возможности исследовать его не часто представляются. Здесь оно известно как сима-муси , или болезнь островных насекомых, и названо так из-за поверья, что оно вызвано укусом какого-то насекомого, свойственного определенным островам на реке, известной как Синагава, которая опорожняется. в море в Ниигате. [7]
Этиология заболевания была неизвестна до начала 20 века. В 1908 году Тайчи Киташима и Микиносуке Миядзима выдвинули теорию передачи болезни цуцугамуси, вызванную клещами. [8] В 1915 году британский зоолог Стэнли Херст предположил, что личинки клеща Microtrombidium akamushi (позже переименованного в Leptotrombidium akamushi ), которых он обнаружил на ушах полевых мышей, могут переносить и передавать инфекцию. [9] В 1917 году Матаро Нагайо и его коллеги дали первое полное описание стадий развития, таких как яйцо, нимфа, личинка и взрослая особь клеща. Они также утверждали, что млекопитающих кусают только личинки и, таким образом, являются единственными переносчиками паразитов. [10] Но тогда настоящий инфекционный агент не был известен, и его обычно приписывали либо вирусу, либо простейшим. [11]
Возбудитель заболевания был впервые идентифицирован Наосукэ Хаяси в 1920 году. Уверенный в том, что этот организм был простейшим, Хаяси заключил, заявив: «Я пришел к выводу, что вирусом заболевания является вид Piroplasma рассматриваемый [простейших]... Я считаю микроорганизм, вызывающий болезнь Цуцугамуши, до сих пор неописанным видом и по предложению доктора Генри Б. Уорда называю его Theileria tsutsugamushi ». [12] Обнаружив сходство с бактерией R. prowazekii , Матаро Нагайо и его коллеги в 1930 году дали новую классификацию под названием Rickettsia orientalis . [13] [14] ( R. prowazekii — бактерия, вызывающая эпидемический сыпной тиф, впервые обнаруженная американскими врачами Говардом Тейлором Рикеттсом и Расселом М. Уайлдером в 1910 году и описанная бразильским врачом Энрике да Роча Лимой в 1916 году. [15] )
Таксономическая путаница усилилась. В 1931 году Норио Огата дал название Rickettsia tsutsugamushi , [16] в то время как Ринья Кавамура и Ёсо Имагава независимо друг от друга ввели название Rickettsia akamushi . [17] Кавамура и Имагава обнаружили, что бактерии сохраняются в слюнных железах клещей и что клещи питаются жидкостью организма (лимфой), тем самым установив тот факт, что клещи передают паразитов во время питания. [18]
Более 60 лет не было единого мнения о выборе названия – и R. orientalis , и R. tsutsugamushi в равной степени использовались . Акира Тамура и его коллеги сообщили в 1991 году о структурных различиях бактерий от видов Rickettsia , которые потребовали выделения в отдельный род, и предложили название Orientia tsutsugamushi . [19] Наконец, в 1995 году они сделали новую классификацию, основанную на морфологических и биохимических свойствах, формально создав новое название O. tsutsugamushi . [20]
Биология
[ редактировать ]
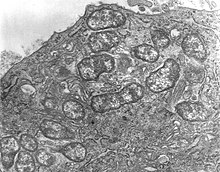
Orientia tsutsugamushi — грамотрицательная бактерия, постоянный (облигатный) паразит клещей. Внутри одной клетки-хозяина O. tsutsugamushi быстро делится на множество особей, как показано на рисунке 1 . Это одноклеточный организм, он имеет овальную форму, ширину от 0,5 до 0,8 мкм и длину от 1,2 до 3,0 мкм. Из-за сходства ее ранее отнесли к роду Rickettsia среди других бактерий, но позже выделили в отдельный род Orientia . [20] который он разделяет (по состоянию на 2010 год) только с Candidatus Orientia chuto . [21] Он шире, но короче, чем у других риккетсиозных бактерий, которые имеют палочковидную форму и в среднем имеют ширину от 0,25 до 0,3 мкм и длину от 0,8 до 1 мкм. [22] Во время размножения она делится (путем бинарного деления ) на две дочерние клетки в процессе почкования. Во время почкования он накапливается на поверхности клетки-хозяина, в отличие от других бактерий. Один полный цикл бутонизации занимает от 9 до 18 часов. [23]
Строение O. tsutsugamushi (выявленное с помощью просвечивающей электронной микроскопии ) показано на рисунке 2 . Бактерия окружена клеточной стенкой снаружи и клеточной мембраной изнутри. Покрытие клеток впитывает такие пятна, как пятна Гимзы и Хименеса . Хотя его клеточная стенка имеет классический двойной слой бактерий, его внешний листок намного толще внутреннего, что у Rickettsia прямо противоположно. видов [24] Слой капсулы, образующий сферический ореол, у других бактерий отсутствует. Клеточная стенка менее жесткая из-за отсутствия пептидогликана, который в остальном характерен для жестких клеточных стенок других бактерий. Классические бактериальные липофосфогликаны, такие как мураминовая кислота , глюкозамин , оксижирные кислоты, гептоза и 2-кето-3-дезоксиоктоновая кислота, также отсутствуют в клеточной стенке. Из-за отсутствия пептидогликана бактерия естественным образом устойчива ко всем β-лактамным антибиотикам (таким как пенициллин ), к которым Rickettsia . обычно чувствительны виды [25] В его геноме полностью отсутствуют гены синтеза липофосфогликанов, но есть некоторые гены пептидогликана. Важные гены, необходимые для синтеза пептидогликана, такие как alr , dapF и PBP1, отсутствуют: alr кодирует фермент L-аланинрацемазу, которая превращает L-аланин в D-аланин на первом этапе пути синтеза пептидогликана; dapF кодирует диаминопимелатэпимеразу, которая превращает LL-2,6-диаминогептандиоат (L,L-DAP) в мезодиаминогептандиоат (мезо-DAP); а PBP1 кодирует пенициллинсвязывающий белок-1 (PBP1), который превращает периплазматический липид II в пептидогликан. Таким образом, бактерия не может синтезировать типичную пептидогликановую клеточную стенку, а вместо этого образует на ее поверхности пептидогликаноподобную структуру. [26] Клеточная мембрана также химически различна по своему белковому составу, и это различие приводит к вариациям штаммов внутри самого вида. [27] Цитоплазма прозрачная, с отчетливыми ДНК и рибосомами.
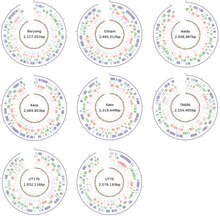
Бактерия обладает высокой вирулентностью, поэтому ее выделение и культивирование клеток проводятся только в лабораторных условиях с уровнем биобезопасности 3 . В отличие от других бактерий, которые легко растут на различных питательных средах, риккетсиалы можно культивировать только в живых клетках. В частности, O. tsutsugamushi можно выращивать только в желточных мешках развивающихся куриных эмбрионов и в культивируемых клеточных линиях, таких как HeLa , BHK , Vero и L929 . [28] В отличие от видов Rickettsia , которые обитают в ядре клетки-хозяина, O. tsutsugamushi в основном растет в цитоплазме клетки-хозяина. [19] Генетически она отличается от других риккетсий всего на 9%. [29] Несмотря на то, что адаптация к облигатному внутриклеточному паразитизму среди бактерий обычно приводит к уменьшению генома, размер генома бактерий составляет около 2,0–2,7 Мб в зависимости от штамма ( рис. 3 ), что сравнительно больше, чем у других риккетсиалей – в два раза больше, чем у бактерий. это Rickettsia prowazekii , [30] самый известный участник. Весь геном распределен в одной кольцевой хромосоме. Полногеномные последовательности доступны только для штаммов Ikeda и Boryong, оба из Республики Корея. Геном штамма Икеда имеет длину 2 008 987 пар оснований (п.н.) и содержит 1 967 генов, кодирующих белки. [31] Штамм Boryong крупнее: у него 2 127 051 п.н. и 2 179 генов, кодирующих белок. [32]
Сравнение геномов показывает только 657 основных генов среди разных штаммов. [33] имеет около 42–47% повторяющихся последовательностей и По состоянию на 2013 год O. tsutsugamushi имеет наиболее повторяющийся секвенированный бактериальный геном. [34] Повторяющаяся последовательность ДНК включает короткие повторяющиеся последовательности , мобильные элементы (включая элементы инсерционной последовательности, миниатюрные мобильные элементы с инвертированным повтором, интрон группы II ) и сильно амплифицированный интегративный и конъюгативный элемент (ICE), называемый риккетсиозным амплифицированным генетическим элементом (RAGE). . [32] RAGE также обнаружен у других риккетсиозных бактерий. Однако у O. tsutsugamushi RAGE содержит ряд генов, включая tra- гены, типичные для систем секреции типа IV, и ген белка, содержащего анкириновые повторы . Белки, содержащие анкириновые повторы, секретируются через систему секреции типа I в клетку-хозяина. Точная роль системы секреции типа IV у O. tsutsugamushi неизвестна. Он может участвовать в горизонтальном переносе генов между различными штаммами. [1]
Жизненный цикл и передача
[ редактировать ]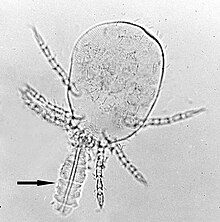
Orientia tsutsugamushi естественным путем передается через популяцию клещей, принадлежащих к роду Leptotrombidium . Он может передаваться от самки своим яйцам посредством процесса, называемого трансовариальной передачей, а также от яиц к личинкам и взрослым особям посредством процесса трансстадиальной передачи. Таким образом, жизненный цикл бактерий полностью сохраняется у клещей. Заражение грызунов и человека происходит случайно при укусе личинок клещей и не требуется для размножения или выживания бактерии. Фактически у человека передача прекращается, и бактерия заходит в тупик. [27] Однако неинфицированные клещи могут заразиться от зараженных грызунов. [35]
При инфекциях у грызунов и человека является Leptotrombidium deliense наиболее распространенным переносчиком O. tsutsugamushi . L. pallidum , L. fletcheri и L. scutellare также являются переносчиками во многих странах. Кроме того, L. akamushi является эндемичным переносчиком в Японии, L. chiangraiensis и L. imphalum в Таиланде, L. gaohuensis в Китае и L. arenicola в Малайзии и Индонезии. [3] В некоторых частях Индии другой вид клещей Schoengastiella ligula . основным переносчиком также является [36] Жизненный цикл клещей состоит из яйца, предличинки, личинки, протонимфы, дейтонимфы, тритонимфы и взрослой особи. Личинки, обычно называемые чиггерами ( рис. 4 ), являются единственной эктопаразитической стадией, питающейся жидкостями организма грызунов и других условно-патогенных млекопитающих. Таким образом, они являются единственным этапом в жизни клещей, передающим инфекцию. Дикие крысы рода Rattus являются основными естественными хозяевами чиггеров. [37] Чиггеры питаются млекопитающими-хозяевами только один раз. Кормление обычно занимает от 2 до 4 дней. В отличие от большинства паразитов, они питаются не кровью, а жидкостями организма через волосяные фолликулы или поры кожи. В процессе питания у них создается шилостома , представляющая собой трубку, образованную затвердевшей слюной. Их слюна может растворять ткани хозяина вокруг места питания, и они проглатывают разжиженную ткань. O. tsutsugamushi присутствует в слюнных железах клещей и выделяется в ткани хозяина во время этого питания. [38]
Клеточное вторжение
[ редактировать ]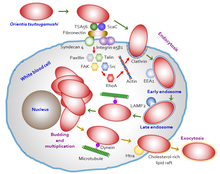
Orientia tsutsugamushi сначала атакует миелоциты (молодые лейкоциты) в области инокуляции, а затем эндотелиальные клетки, выстилающие сосуды . Процесс клеточной инвазии показан на рисунке 5 . В кровообращении он нацелен на профессиональные фагоциты («пожиратели клеток», лейкоциты), такие как дендритные клетки и макрофаги во всех органах, в качестве вторичных мишеней. Паразит сначала прикрепляется к клеткам-мишеням с помощью поверхностных протеогликанов, присутствующих на клетке-хозяине, и поверхностных белков бактерий, таких как типоспецифический белок 56 (или типоспецифический антиген, TSA56) и поверхностные клеточные антигены (ScaA и ScaC, которые являются мембранными белками-переносчиками). . [39] [40] хозяина Эти белки взаимодействуют с фибронектином , вызывая фагоцитоз (процесс поглощения бактерии). Способность фактически проникать в клетку-хозяина зависит от опосредованной интегрином передачи сигналов и реорганизации актинового цитоскелета . [41]
Orientia tsutsugamushi обладает особой адаптацией к выживанию в клетке-хозяине, уклоняясь от иммунной реакции хозяина. Как только он взаимодействует с клетками-хозяевами, он заставляет мембрану клетки-хозяина образовывать транспортный пузырь, называемый покрытой клатрином везикулой , с помощью которого он транспортируется в цитоплазму. Внутри цитоплазмы он выходит из пузырька (теперь известного как эндосома ) до того, как эндосома разрушается (в процессе поедания клеток, называемом аутофагией ) лизосомами . [42] Затем он движется к ядру, особенно в перинуклеарной области, где начинает расти и размножаться. В отличие от других близкородственных бактерий, которые используют актин-опосредованные процессы для перемещения в цитоплазме (так называемый внутриклеточный транспорт или транспорт ), O. tsutsugamushi необычно использует процессы, опосредованные микротрубочками, аналогичные тем, которые используются вирусами, такими как аденовирусы и вирусы простого герпеса . выход ( экзоцитоз Кроме того, необычен также ) из инфицированной клетки-хозяина. Он образует еще один везикулу, используя мембрану клетки-хозяина, дает начало небольшому зачатку и освобождается от поверхности клетки-хозяина, все еще заключенный в везикуле. Мембраносвязанная бактерия образуется в результате взаимодействия богатых холестерином липидных рафтов, а также HtrA, белка массой 47 кДа на бактериальной поверхности. [43] Однако процесс почкования и важность мембраносвязанных бактерий еще не изучены.
Штаммы
[ редактировать ]Orientia tsutsugamushi — это разнообразный вид бактерий. Ида А. Бенгтсон из Службы общественного здравоохранения США была первой, кто отметил существование различных штаммов, использующих взаимодействие антиген-антитело ( тест фиксации комплемента ) в 1944 году. [44] Она заметила, что разные штаммы обладают разной степенью вирулентности и что антитела в сыворотке крови пациентов перекрестно реагируют на разные штаммы. К 1946 году она установила, что существует три основных штамма (серотипа), а именно Карп (из Новой Гвинеи), Гиллиам (из Индии) и Сирангай (из Британской Малайи). [45] Акира Шишидо описал штамм Като, помимо Гиллиама и Карпа, в Японии в 1958 году. [46] С тех пор признано шесть основных антигенных штаммов, а именно Гиллиам, Карп, Като, Симокоши, Кавасаки и Куроки. Карп — наиболее распространенный штамм, на него приходится около 50% всех инфекций. [3] В Корее основным штаммом является Борёнг. [47] По состоянию на 2009 год у людей было обнаружено более 20 различных штаммов на основе антигенных вариаций с использованием серологических тестов, таких как фиксация комплемента и иммунофлуоресцентный анализ. [3] Это число намного выше, если принять во внимание штаммы грызунов и клещей. Например, исследование, проведенное в Японии в 1994 году, выявило 32 штамма: 14 от пациентов-людей, 12 от диких грызунов и 6 от тромбикулидных клещей. Различные штаммы обладают разным уровнем вирулентности, наиболее вирулентным является KN-3, преобладающий среди диких грызунов. [48] Другое исследование, проведенное в 1996 году, выявило 40 штаммов. [49] Генетические методы выявили еще большую сложность, чем было описано ранее (например, Гиллиам подразделяется на типы Гиллиам и JG). Из-за иммунологических различий серотипов возможно одновременное и повторное заражение разными штаммами. [50] [51]
Антигенная вариация
[ редактировать ]Orientia tsutsugamushi содержит четыре основных поверхностно-мембранных белка ( антигена ) с молекулярной массой 22 кДа, 47 кДа, 56 кДа и 110 кДа. Типоспецифический антиген массой 56 кДа (TSA56) является наиболее важным, поскольку он не продуцируется никакими другими бактериями и отвечает за создание генетического разнообразия в различных штаммах. [52] На его долю приходится около 10–15% общего количества клеточных белков. Антигены массой 22 кДа, 47 кДа или 110 кДа не являются штаммоспецифичными, поэтому TSA56 является основной мишенью в сложных диагностических тестах, таких как иммуноблоттинг, ИФА и анализ ДНК. [53] Белок способствует адгезии и проникновению бактерии в клетки-хозяева, а также уклонению от иммунной реакции хозяина. Размер его варьируется от 516 до 540 аминокислотных остатков у разных штаммов, а длина его гена составляет примерно 1550 пар оснований. Его ген содержит четыре гипервариабельных участка, что указывает на то, что он синтезирует множество антигенно различных белков. [49] Внутри бактерии также имеются белки массой 11 кДа и 60 кДа, которые очень похожи на GroES и GroEL бактерии Escherichia coli , но не на белки видов Rickettsia . [54] GroES и GroEL — белки теплового шока, принадлежащие к семейству молекулярных шаперонов бактерий. Анализ ДНК показал, что гены GroES и GroEL действительно присутствуют у O. tsutsugamushi с небольшими вариациями у разных штаммов и продуцируют белки массой 11 кДа и 60 кДа. [55]
Болезнь
[ редактировать ]Orientia tsutsugamushi вызывает сложное и потенциально опасное для жизни заболевание, известное как кустарниковый тиф. Заражение начинается, когда чиггеры кусают кожу во время кормления. Бактерии откладываются в месте кормления (прививки), где и размножаются. Они вызывают прогрессирующее повреждение тканей ( некроз ), что приводит к образованию струпа на коже. Некроз прогрессирует до воспаления кровеносных сосудов, называемого васкулитом . Это, в свою очередь, вызывает воспаление лимфатических узлов, называемое лимфаденопатией . В течение нескольких дней васкулит распространяется на различные органы, включая печень, мозг, почки, мозговые оболочки и легкие. [56] Это заболевание является причиной почти четверти всех лихорадочных заболеваний (высокой температуры) в эндемичных районах. Смертность в тяжелых случаях или из-за неправильного лечения или неправильного диагноза может достигать 30–70%. [57] Около 6% инфицированных умирают без лечения, а 1,4% пациентов умирают даже при медикаментозном лечении. Более того, среди пролеченных пациентов уровень смертности может достигать 14% при неврологических проблемах и 24% при полиорганной дисфункции. [58] В случаях ошибочного диагноза и неэффективности лечения быстро развиваются системные осложнения, в том числе острый респираторный дистресс-синдром , острая почечная недостаточность, энцефалит , желудочно-кишечные кровотечения, гепатит , менингит , миокардит , панкреатит , пневмония , септический шок , подострый тиреоидит и синдром полиорганной дисфункции . [59] Вредные последствия, включающие полиорганную недостаточность и неврологические нарушения, трудно поддаются лечению и могут вызвать пожизненное истощение или привести к летальному исходу. [59] Часто поражается центральная нервная система, что приводит к различным осложнениям, включая мозжечок , паралич черепно-мозговых нервов , менингоэнцефалит , плексопатию , поперечный миелит и синдром Гийана-Барре . [60] Смертность вследствие осложнений может достигать 14% при инфекциях головного мозга и 24% при полиорганной недостаточности. [58] В Индии кустарниковый тиф стал основной причиной синдрома острого энцефалита, который ранее вызывался преимущественно вирусной инфекцией — японским энцефалитом . [61]
Эпидемиология
[ редактировать ]
Всемирная организация здравоохранения в 1999 году заявила, что:
Скрабовый тиф, вероятно, является одним из наиболее недостаточно диагностируемых и недостаточно регистрируемых лихорадочных заболеваний, требующих госпитализации в регионе. Отсутствие четких признаков и симптомов в сочетании с общей зависимостью от серологических тестов делает дифференциацию кустарникового сыпного тифа от других распространенных лихорадочных заболеваний, таких как мышиный тиф, брюшной тиф и лептоспироз, весьма трудной. [62]
Кустарниковый тиф исторически эндемичен для Азиатско-Тихоокеанского региона, охватывающего Дальний Восток России и Корею на севере, северную Австралию на юге и Афганистан на западе, включая острова западной части Тихого океана, такие как Япония, Тайвань, Филиппины. , Папуа-Новая Гвинея, Индонезия, Шри-Ланка и Индийский субконтинент. Этот географический регион в народе называют Треугольником Цуцугамуси, как показано на рисунке 6 . [56] Однако он распространился на Африку, Европу и Южную Америку. [63] По оценкам, один миллиард человек подвергается риску заражения в любой момент, и в Треугольнике Цуцугамуси ежегодно регистрируется в среднем один миллион случаев. [38] Бремя кустарникового сыпного тифа в сельских районах Азии огромно: на его долю приходится до 20% лихорадочных заболеваний в больницах, а серораспространенность (положительная инфекция при анализе крови) наблюдается у более чем 50% населения. [64] Более одной пятой населения являются носителями бактериальных антител, т.е. они были инфицированы в эндемичных районах. В Южной Корее самый высокий уровень заболеваемости (самый высокий показатель - 59,7 инфекций на 100 000 человек в 2013 году), за ним следуют Япония, Таиланд и Китай, возглавляющие список. Возрастная группа 60–69 лет подвергается наибольшему риску заражения. Более высокий уровень инфицирования (57,3%) наблюдается у женщин по сравнению с мужчинами (42,7%). Фермеры наиболее уязвимы, на их долю приходится 70% случаев в Китае. Заболевание более распространено в сельской местности, но наблюдается быстрый рост заболеваемости в городских районах. Например, в Корее годовая заболеваемость увеличилась в 21 раз в период с 2003 по 2013 год в крупных городах. [58]
Диагностика
[ редактировать ]Симптом
[ редактировать ]Основным симптомом инфекции O. tsutsugamushi является высокая (фебрильная) лихорадка; однако симптом аналогичен другим трансмиссивным тропическим болезням, таким как малярия , лептоспироз , брюшной тиф , мышиный тиф , чикунгунья и лихорадка денге . [65] [66] Это затрудняет точную клиническую диагностику, что часто приводит к ошибочному диагнозу. Первоначальными показаниями являются лихорадка с ознобом, сопровождающаяся головной болью, мышечной болью ( миалгией ), потливостью и рвотой. Появление симптомов ( инкубационный период ) занимает от 6 до 21 дня. [56] Простой визуальный диагноз заключается в наличии воспаленного рубцового струпа, называемого струпом, который считается «наиболее полезным диагностическим признаком у пациентов с острым лихорадочным заболеванием». Струп образуется на коже в месте укуса инфицированного клеща, обычно его можно обнаружить в подмышках, паху или в любой области живота ( рис. 7 ). В редких случаях его можно увидеть на щеке, мочке уха и тыльной поверхности стоп . [67] Но проблема в том, что струп присутствует не всегда; Согласно самым высоким показателям, только у 55% пациентов с сыпным тифом во время вспышки на юге Индии был струп. [68] Кроме того, струп неспецифичен для сыпного тифа, возникающего при других риккетсиозных заболеваниях, таких как пятнистая лихорадка Скалистых гор , [69] Бразильская пятнистая лихорадка, [70] и индийский клещевой тиф. [71] [72] Используя анализ ДНК с помощью расширенной полимеразной цепной реакции, по струпам можно идентифицировать различные риккетсиозные инфекции. [73]
Анализ крови
[ редактировать ]Подозрение на инфекцию подтверждается серологическими тестами. O. tsutsugamushi чаще всего выявляют в сыворотке крови с помощью теста Вейля-Феликса . Вейля-Феликса — самый простой и быстрый тест, но он не чувствителен и не специфичен, так как выявляет любые виды риккетсиозной инфекции. Используются более чувствительные тесты, такие как быстрый иммунохроматографический тест (RICT), иммунофлуоресцентный анализ (IFA), ELISA и анализ ДНК с использованием полимеразной цепной реакции (PCR). [37] [28] IFA считается золотым стандартом теста, поскольку дает надежный результат; однако он дорог и неспецифичен для различных риккетсиозных бактерий. [74] ИФА и ПЦР позволяют обнаружить специфичные для O. tsutsugamushi белки, такие как TSA56 и GroEL, поэтому они обладают высокой специфичностью и чувствительностью. [75] С другой стороны, это очень сложные и дорогие методы.
Уход
[ редактировать ]Инфекцию Orientia tsutsugamushi можно лечить такими антибиотиками, как азитромицин , хлорамфеникол , доксициклин , рифампицин , рокситромицин и тетрациклин . Доксициклин используется чаще всего и считается препаратом выбора из-за его высокой эффективности и быстрого действия. Но беременным и младенцам он противопоказан , а препаратом выбора является азитромицин. В Юго-Восточной Азии, где наблюдалась резистентность к доксициклину и хлорамфениколу, всем пациентам рекомендуется азитромицин. [76] Рандомизированное контролируемое исследование и систематический обзор показали, что азитромицин является самым безопасным препаратом. [77] [78]
Вакцина
[ редактировать ]В настоящее время лицензированных вакцин против O. tsutsugamushi не существует. Первые вакцины были разработаны в конце 1940-х годов, но клинические испытания не прошли. [79] [80] Уникальный TSA56, считающийся идеальной мишенью, сам по себе сильно различается по химическому составу у разных штаммов. Эффективная вакцина для одного штамма бесполезна для другого. Идеальная вакцина должна обеспечивать защиту всех местных штаммов. Эта сложность затрудняет производство пригодной для использования вакцины. [81] Вакцина, нацеленная на белок внешней мембраны 47 кДа (OMP), является многообещающим кандидатом, добившимся экспериментальных успехов на мышах против штамма Boryong. [82] Комбинированное воздействие на TSA56 и ScaA также является хорошим кандидатом на инфекцию смешанного штамма. [40]
Иммунитет
[ редактировать ]не существует Стойкого иммунитета к инфекции O. tsutsugamushi . Антигенная изменчивость предотвращает развитие перекрестного иммунитета к различным штаммам O. tsutsugamushi . У инфицированного человека может развиться кратковременный иммунитет, но он исчезает через несколько месяцев, а иммунитет к одному штамму не дает иммунитета к другому. [81] В 1950 году был проведен эксперимент по иммунизации, в ходе которого у 16 добровольцев инфекция все же развилась через 11–25 месяцев после первичного заражения. [83] Сейчас известно, что долговечность иммунитета зависит от штамма бактерии. При повторном заражении тем же штаммом, что и предыдущее заражение, у обезьян может сохраняться иммунитет в течение 5–6 лет. [84] Но у человека иммунитет снижается через год и исчезает в течение двух лет. [85]
Ссылки
[ редактировать ]![]() Эта статья была отправлена в WikiJournal of Medicine на внешнее академическое рецензирование в 2018 году ( отчеты рецензентов ). Обновленный контент был реинтегрирован на страницу Википедии по лицензии CC-BY-SA-3.0 ( 2019 ). Проверенная версия записи: Холхринг Лалчандама; и др. (13 сентября 2019 г.). «Ориентия цуцугамуси, возбудитель кустарникового тифа » . Викижурнал медицины . 6 (1): 4. doi : 10.15347/WJM/2019.004 . ISSN 2002-4436 . Викиданные Q73054107 .
Эта статья была отправлена в WikiJournal of Medicine на внешнее академическое рецензирование в 2018 году ( отчеты рецензентов ). Обновленный контент был реинтегрирован на страницу Википедии по лицензии CC-BY-SA-3.0 ( 2019 ). Проверенная версия записи: Холхринг Лалчандама; и др. (13 сентября 2019 г.). «Ориентия цуцугамуси, возбудитель кустарникового тифа » . Викижурнал медицины . 6 (1): 4. doi : 10.15347/WJM/2019.004 . ISSN 2002-4436 . Викиданные Q73054107 .
- ^ Jump up to: а б Салье, Дж.; Клайн, Калифорния (2017). « Ориентия цуцугамуси : забытый, но интересный облигатный внутриклеточный бактериальный патоген» . ПЛОС Патогены . 13 (12): e1006657. дои : 10.1371/journal.ppat.1006657 . ПМК 5720522 . ПМИД 29216334 .
- ^ Ватт, Г.; Парола, П. (2003). «Крабовый сыпной тиф и тропические риккетсиозы». Современное мнение об инфекционных заболеваниях . 16 (5): 429–436. дои : 10.1097/00001432-200310000-00009 . ПМИД 14501995 . S2CID 24087729 .
- ^ Jump up to: а б с д Келли, диджей; Фюрст, Пенсильвания; Чинг, В.М.; Ричардс, Алабама (2009). «Кустарниковый сыпной тиф: географическое распространение фенотипических и генотипических вариантов Orientia tsutsugamushi » . Клинические инфекционные болезни . 48 Дополнение (Дополнение): S203–S230. дои : 10.1086/596576 . ПМИД 19220144 .
- ^ Ямамото, С.; Кавабата, Н.; Тамура, А.; Ураками, Х.; Охаси, Н.; Мурата, М.; Ёсида, Ю.; Кавамура А. младший (1986). «Иммунологические свойства Rickettsia tsutsugamushi , штамм Кавасаки, выделенных от пациента на острове Кюсю». Микробиология и иммунология . 30 (7): 611–620. дои : 10.1111/j.1348-0421.1986.tb02988.x . ПМИД 3095612 . S2CID 2968436 .
- ^ Фан, МОЙ; Уокер, Д.Х.; Ю, СР; Лю, QH (1987). «Эпидемиология и экология риккетсиозов в Китайской Народной Республике». Обзоры инфекционных болезней . 9 (4): 823–840. дои : 10.1093/clinids/9.4.823 . ПМИД 3326129 .
- ^ Кавамура, Р. (1926). Исследования болезни цуцугамуси (японской кровавой лихорадки) . Цинциннати, Огайо (США): Представитель типографии. п. 2.
- ^ Палм, штат Техас (1878 г.). «Некоторые сообщения о болезни, называемой туземцами Японии «сима-муси», или «болезнь островных насекомых», свойственной, как полагают, этой стране и до сих пор не описанной» . Эдинбургский медицинский журнал . 24 (2): 128–132. ПМК 5317505 . ПМИД 29640208 .
- ^ Миядзима, М.; Окумура, Т. (1917). «О жизненном цикле переносчика японской речной лихорадки «Акамуси». Китасато Архив экспериментальной медицины . 1 (1): 1–14.
- ^ Херст, С. (1915). «О Цуцугамуси ( Microtrombidium akamushi , Brumpt), переносчике японской речной лихорадки». Журнал экономической биологии . 10 (4): 79–82.
- ^ Нагайо, М. (1917). «О нимфе и прозопоне цуцугамуси, Leptotrombidium akamushi, N. Sp. ( Trombidium akamushi Brumpt), переносчике болезни цуцугамуси» . Журнал экспериментальной медицины . 25 (2): 255–272. дои : 10.1084/jem.25.2.255 . ПМК 2125768 . ПМИД 19868085 .
- ^ Лалчхандама, К. (2018). «Сага о кустарниковом тифе с примечаниями о вспышках в Мизораме» . Научное видение . 18 (2): 50–57. дои : 10.33493/scivis.18.02.01 .
- ^ Хаяси, Н. (1920). «Этиология болезни цуцугамуси» . Журнал паразитологии . 7 (2): 52–68. дои : 10.2307/3270957 . JSTOR 3270957 .
- ^ Нагайо, М.; Тамия, Т.; Митамура, Т.; Сато, К. (1930). «О вирусе болезни цуцугамуши и его демонстрации новым методом» Джиккен Игаку Засси (Японский журнал экспериментальной медицины) . 8 (4): 309–318.
- ^ Нагайо, М.; Тамия, Т.; Митамура, Т.; Сато, К. (1930). «О вирусе болезни Цуцугамуси [О вирусе цуцугамуси]». Отчеты, полученные с заседаний Биологического общества . 104 : 637–641.
- ^ да Роша Лима, Х. (1916). «Исследования по сыпному тифу». Мюнхенский медицинский еженедельник . 63 (39): 1381–1384.
- ^ Огата, Н. (1931). «Этиология болезни цуцугамуси: Rickettsia tsutsugamushi [Этиология болезни цуцугамуси: Rickettsia tsutsugamushi ». Центральный журнал бактериологии, паразитологии, инфекционных болезней и гигиены . 122 : 249–253.
- ^ Кавамура, Р.; Имагава, Ю. (1931). «О распространении риккетсий в организме животных при болезни цуцугамуши [Размножение риккетсий, возбудителя болезни цуцугамуши у животных]». Труды Японского общества патологии . 21 : 455–461.
- ^ Кавамура, Р.; Имагава, Ю. (1931). «Подтверждение инфекционного агента болезни цуцугамуси». Центральный журнал бактериологии, паразитологии, инфекционных болезней и гигиены . 122 (4/5): 253–261.
- ^ Jump up to: а б Тамура, А.; Ураками, Х.; Охаси, Н. (1991). «Сравнительный вид Rickettsia tsutsugamushi и других групп Rickettsiae». Европейский журнал эпидемиологии . 7 (3): 259–269. дои : 10.1007/BF00145675 . ПМИД 1909244 . S2CID 12298540 .
- ^ Jump up to: а б Тамура, А.; Охаси, Н.; Ураками, Х.; Миямура, С. (1995). «Классификация Rickettsia tsutsugamushi в новый род Orientia gen. nov., как Orientia tsutsugamushi com. nov .» Международный журнал систематической бактериологии . 45 (3): 589–591. дои : 10.1099/00207713-45-3-589 . ПМИД 8590688 .
- ^ Иззард, Л. (2010). «Выделение нового вида Orientia ( O. chuto sp. nov.) от пациента, инфицированного в Дубае» . Журнал клинической микробиологии . 48 (12): 4404–4409. дои : 10.1128/JCM.01526-10 . ПМК 3008486 . ПМИД 20926708 .
- ^ Суньякумторн, П.; Бурчукарн, А.; Порнвирун, В.; Дэвид, К.; Баркер, ЮАР; Макалузо, КР (2008 г.). «Характеристика и рост полиморфной Rickettsia felis в линии клеток клеща» . Прикладная и экологическая микробиология . 74 (10): 3151–3158. Бибкод : 2008ApEnM..74.3151S . дои : 10.1128/AEM.00025-08 . ПМК 2394910 . ПМИД 18359823 .
- ^ Мори, МФ; Хэнсон, Б. (1992). «Характеристики роста и белки очищенных от бляшек штаммов Rickettsia tsutsugamushi » . Инфекция и иммунитет . 60 (8): 3405–3415. дои : 10.1128/IAI.60.8.3405-3415.1992 . ПМЦ 257328 . ПМИД 1379212 .
- ^ Сильверман, диджей; Виссеман, CL младший (1978). «Сравнительное ультраструктурное исследование клеточных оболочек Rickettsia prowazekii , Rickettsia rickettsii и Rickettsia tsutsugamushi » . Инфекция и иммунитет . 21 (3): 1020–1023. дои : 10.1128/IAI.21.3.1020-1023.1978 . ПМК 422098 . ПМИД 101465 .
- ^ Амано, К.; Тамура, А.; Охаси, Н.; Ураками, Х.; Кая, С.; Фукуши, К. (1987). «Дефицит пептидогликана и липополисахаридных компонентов у Rickettsia tsutsugamushi » . Инфекция и иммунитет . 55 (9): 2290–2292. дои : 10.1128/IAI.55.9.2290-2292.1987 . ПМК 260693 . ПМИД 3114150 .
- ^ Атвал, С.; Гиенгкам, С.; Чаемчуэн, С.; Дорлинг, Дж.; Косайсаве, Н.; ВанНьевензе, М.; Сампаттаванич, С.; Шуман, П.; Салье, Дж. (2017). «Доказательства пептидогликаноподобной структуры у Orientia tsutsugamushi » . Молекулярная микробиология . 105 (3): 440–452. дои : 10.1111/мм.13709 . ПМЦ 5523937 . ПМИД 28513097 .
- ^ Jump up to: а б Лалчхандама, К. (2017). «Риккетсиоз как критическое возникающее инфекционное заболевание в Индии» . Научное видение . 17 (4): 250–259. дои : 10.33493/scivis.17.04.09 .
- ^ Jump up to: а б Кох, GC; Мод, Р.Дж.; Париж, DH; Ньютон, Пенсильвания; Блэкселл, С.Д. (2010). «Диагностика кустарникового тифа» . Американский журнал тропической медицины и гигиены . 82 (3): 368–370. дои : 10.4269/ajtmh.2010.09-0233 . ПМЦ 2829893 . ПМИД 20207857 .
- ^ Охаси, Н.; Фукухара, М.; Шимада, М.; Тамура, А. (1995). «Филогенетическое положение Rickettsia tsutsugamushi и взаимосвязь между ее антигенными вариантами по результатам анализа последовательностей гена 16S рРНК» . Письма FEMS по микробиологии . 125 (2–3): 299–304. дои : 10.1111/j.1574-6968.1995.tb07372.x . ПМИД 7875578 .
- ^ Бишоп-Лилли, Калифорния; Ге, Х.; Бутани, А.; Осборн, Б.; Верратти, К.; Мокаши, В.; Нагараджан, Н.; Поп, М.; Читай, ТД; Ричардс, Алабама (2013). «Секвенирование генома четырех штаммов Rickettsia prowazekii , возбудителя эпидемического сыпного тифа, включая один изолят белки-летяги» . Геномные объявления . 1 (3): e00399-13. doi : 10.1128/genomeA.00399-13 . ПМЦ 3695431 . ПМИД 23814035 .
- ^ Накаяма, К.; Ямасита, А.; Курокава, К.; Моримото, Т.; Огава, М.; Фукухара, М.; Ураками, Х.; Ониши, М.; Утияма, И.; Огура, Ю.; Оока, Т.; Осима, К.; Тамура, А.; Хаттори, М.; Хаяши, Т. (2008). «Полногеномное секвенирование облигатной внутриклеточной бактерии Orientia tsutsugamushi выявило массивную амплификацию генов во время редуктивной эволюции генома» . Исследование ДНК . 15 (4): 185–199. дои : 10.1093/dnares/dsn011 . ПМЦ 2575882 . ПМИД 18508905 .
- ^ Jump up to: а б Чо, Н.-Х.; Ким, Х.-Р.; Ли, Дж.-Х.; Ким, С.-Ю.; Ким, Дж.; Ча, С.; Ким, С.-Ю.; Дарби, AC; Фукселиус, Х.-Х.; Инь, Дж.; Ким, Дж. Х.; Ким, Дж.; Ли, С.Дж.; Кох, Ю.-С.; Джанг, В.-Дж.; Парк, К.-Х.; Андерссон, SGE; Цой, М.-С.; Ким, И.-С. (2007). « Геном Orientia tsutsugamushi демонстрирует массовую пролиферацию конъюгативной системы секреции IV типа и генов взаимодействия клетки-хозяина» . Труды Национальной академии наук . 104 (19): 7981–7986. Бибкод : 2007PNAS..104.7981C . дои : 10.1073/pnas.0611553104 . ПМЦ 1876558 . ПМИД 17483455 .
- ^ Бэтти, Э.М.; Чаемчуен, С.; Блэкселл, С.; Ричардс, Алабама; Пэрис, Д.; Боуден, Р.; Чан, К.; Лачуманан, Р.; День, Н.; Доннелли, П.; Чен, С.; Салье, Дж.; Рек, Дж. (2018). «Длительное полногеномное секвенирование и сравнительный анализ шести штаммов человеческого возбудителя Orientia tsutsugamushi » . PLOS Забытые тропические болезни . 12 (6): e0006566. дои : 10.1371/journal.pntd.0006566 . ПМК 6005640 . ПМИД 29874223 .
- ^ Вишванатан, С.; Мутху, В.; Икбал, Н.; Ремалаям, Б.; Джордж, Т (2013). «Крабовый сыпной менингит в Южной Индии — ретроспективное исследование» . ПЛОС ОДИН . 8 (6): e66595. Бибкод : 2013PLoSO...866595V . дои : 10.1371/journal.pone.0066595 . ПМЦ 3682970 . ПМИД 23799119 .
- ^ Тахампунья, Р.; Коркусол, А.; Промсатапорн, С.; Типпаячай, Б.; Липитакрат, С.; Ричардс, Алабама; Дэвидсон, ЮАР; Смолл, ПЛК (2018). «Гетерогенность генотипов Orientia tsutsugamushi у тромбикулидных клещей, собранных в полевых условиях у мелких млекопитающих, пойманных в дикой природе в Таиланде» . PLOS Забытые тропические болезни . 12 (7): e0006632. дои : 10.1371/journal.pntd.0006632 . ПМК 6062101 . ПМИД 30011267 .
- ^ Тилак, Р.; Ванкхаде, У.; Кунвар, Р.; Тилак, VW (2011). «Появление Schoengastiella ligula как переносчика вспышки кустарникового тифа в Дарджилинге: ли Leptotrombidium deliense заменен ?» . Индийский журнал общественного здравоохранения . 55 (2): 92–99. дои : 10.4103/0019-557X.85239 . ПМИД 21941043 .
- ^ Jump up to: а б Люсе-Федроу, А.; Леман, М.; Келли, Д.; Маллинз, К.; Майна, А.; Стюарт, Р.; Ге, Х.; Джон, Х.; Цзян, Дж.; Ричардс, Аллен (2018). «Обзор кустарникового сыпного тифа ( Orientia tsutsugamushi и родственных ему организмов): тогда, сейчас и завтра» . Тропическая медицина и инфекционные болезни . 3 (1): 8. doi : 10.3390/tropicalmed3010008 . ПМК 6136631 . ПМИД 30274407 .
- ^ Jump up to: а б Сюй, Г.; Уокер, Д.Х.; Юпитер, Д.; Мелби, ПК; Аркари, CM; День, НП (2017). «Обзор глобальной эпидемиологии кустарникового тифа» . PLOS Забытые тропические болезни . 11 (11): e0006062. дои : 10.1371/journal.pntd.0006062 . ПМЦ 5687757 . ПМИД 29099844 .
- ^ Ге, Ю.; Рикихиса, Ю. (2011). «Подрыв передачи сигналов клетки-хозяина с помощью Orientia tsutsugamushi » . Микробы и инфекции . 13 (7): 638–648. дои : 10.1016/j.micinf.2011.03.003 . ПМИД 21458586 .
- ^ Jump up to: а б Ха, Нью-Йорк; Шарма, П.; Ким, Г.; Ким, Ю.; Мин, СК; Чой, М.С.; Ким, И.С.; Чо, Нью-Хэмпшир (2015). «Иммунизация белком-автотранспортером Orientia tsutsugamushi обеспечивает защитный иммунитет против кустарникового тифа» . PLOS Забытые тропические болезни . 9 (3): e0003585. дои : 10.1371/journal.pntd.0003585 . ПМЦ 4359152 . ПМИД 25768004 .
- ^ Чо, бакалавр; Чо, Нью-Хэмпшир; Сон, Ю.Ю.; Чой, М.С.; Ким, И.С. (2010). «Внутриклеточная инвазия Orientia tsutsugamushi опосредована передачей сигналов интегрина и перестройками актинового цитоскелета» . Инфекция и иммунитет . 78 (5): 1915–1923. дои : 10.1128/IAI.01316-09 . ПМЦ 2863532 . ПМИД 20160019 .
- ^ Ко, Ю.; Чой, Дж. Х.; Ха, Нью-Йорк; Ким, И.С.; Чо, Нью-Хэмпшир; Чой, М.С.; Боймлер, AJ (2013). «Активный побег Orientia цуцугамуси от клеточной аутофагии» . Инфекция и иммунитет . 81 (2): 552–559. дои : 10.1128/IAI.00861-12 . ПМЦ 3553808 . ПМИД 23230293 .
- ^ Ким, MJ; Ким, МК; Канг, Дж. С. (2013). «Участие липидных рафтов в почковании Orientia tsutsugamushi ». Микробный патогенез . 63 : 37–43. дои : 10.1016/j.micpath.2013.06.002 . ПМИД 23791848 .
- ^ Бенгстон, Айова (1945). «Очевидная серологическая гетерогенность среди штаммов болезни Цуцугамуши (кустарниковый тиф)». Отчеты общественного здравоохранения . 60 (50): 1483–1488. дои : 10.2307/4585496 . JSTOR 4585496 . ПМИД 21004496 . S2CID 41472189 .
- ^ Бенгстон, Айова (1946). «Серологическое исследование 37 случаев болезни цуцугамуси (кустарникового тифа), возникшей в Бирме и на Филиппинских островах». Отчеты общественного здравоохранения . 61 (24): 887–894. дои : 10.2307/4585717 . JSTOR 4585717 . ПМИД 20987857 .
- ^ Шишидо, А.; Отавара, М.; Татено, С.; Мизуно, С.; Огура, М.; Китаока, М. (1958). «Природа иммунитета против кустарникового сыпного тифа у мышей, т. е. устойчивость мышей, переживших подкожное заражение кустарниковым сыпным риккетсием, к внутрибрюшинному повторному заражению тем же возбудителем». Японский журнал медицинских наук и биологии . 11 (5): 383–399. дои : 10.7883/yoken1952.11.383 . S2CID 87963514 .
- ^ Джанг, М.С.; Неупан, врач общей практики; Ли, Ю.М.; Ким, DM; Ли, SH (2011). «Филогенетический анализ генов белка массой 56 кДа Orientia tsutsugamushi в юго-западной части Кореи» . Американский журнал тропической медицины и гигиены . 84 (2): 250–254. дои : 10.4269/ajtmh.2011.09-0601 . ПМК 3029177 . ПМИД 21292894 .
- ^ Ямасита, Т.; Касуя, С.; Нода, Н.; Нагано, И.; Канг, Дж. С. (1994). «Передача штаммов Rickettsia tsutsugamushi среди людей, диких грызунов и тромбикулидных клещей в районе Японии, где болезнь цуцугамуши стала новой эндемической» . Журнал клинической микробиологии . 32 (11): 2780–2785. doi : 10.1128/JCM.32.11.2780-2785.1994 . ПМК 264159 . ПМИД 7852572 .
- ^ Jump up to: а б Охаси, Н.; Кояма, Ю.; Ураками, Х.; Фукухара, М.; Тамура, А.; Кавамори, Ф.; Ямамото, С.; Касуя, С.; Ёсимура, К. (1996). «Демонстрация антигенных и генотипических вариаций у Orientia tsutsugamushi , выделенных в Японии, и их классификация на тип и подтип» . Микробиология и иммунология . 40 (9): 627–638. дои : 10.1111/j.1348-0421.1996.tb01120.x . ПМИД 8908607 . S2CID 22112557 .
- ^ Бакши, Д.; Сингхал, П.; Махаджан, СК; Субраманиам, П.; Тутея, У.; Батра, Х.В. (2007). «Разработка метода ПЦР в реальном времени для диагностики случаев кустарникового сыпного тифа в Индии и доказательство распространенности нового генотипа O. tsutsugamushi ». Акта Тропика . 104 (1): 63–71. doi : 10.1016/j.actatropica.2007.07.013 . ПМИД 17870041 .
- ^ Парола, П.; Блэкселл, SD; Петсуван, Р.; Фонгмани, С.; Ролен, Дж. М.; День, НП; Ньютон, Пенсильвания; Рауль, Д. (2008). «Генотипирование Orientia цуцугамуси от людей, больных кустарниковым тифом, Лаос» . Новые инфекционные заболевания . 14 (9): 1483–1485. дои : 10.3201/eid1409.071259 . ПМК 2603112 . ПМИД 18760027 .
- ^ Тамура, А; Охаси, Н; Ураками, Х; Такахаши, К; Оянаги, М (1985). «Анализ полипептидного состава и антигенных компонентов Rickettsia tsutsugamushi методами электрофореза в полиакриламидном геле и иммуноблоттинга» . Инфекция и иммунитет . 48 (3): 671–675. дои : 10.1128/IAI.48.3.671-675.1985 . ПМК 261225 . ПМИД 3922893 .
- ^ Стовер, СК; Марана, ДП; Картер, Дж. М.; Роу, бакалавр; Мардис, Э; Оукс, Э.В. (1990). массой 56 килодальтон «Основной белковый антиген Rickettsia tsutsugamushi : молекулярное клонирование и анализ последовательности гена sta56 и точная идентификация штамм-специфического эпитопа» . Инфекция и иммунитет . 58 (7): 2076–2084. дои : 10.1128/IAI.58.7.2076-2084.1990 . ПМЦ 258779 . ПМИД 1694818 .
- ^ Стовер, СК; Марана, ДП; Даш, Джорджия; Оукс, Э.В. (1990). «Молекулярное клонирование и анализ последовательности главного антигенного гена Sta58 Rickettsia tsutsugamushi : гомология последовательностей и антигенное сравнение Sta58 с семейством стрессовых белков массой 60 килодальтон» . Инфекция и иммунитет . 58 (5): 1360–1368. дои : 10.1128/IAI.58.5.1360-1368.1990 . ПМЦ 258633 . ПМИД 2108930 .
- ^ Арай, С.; Табара, К.; Ямамото, Н.; Фудзита, Х.; Итагаки, А.; Кон, М.; Сато, Х.; Араки, К.; Танака-Тая, К.; Такада, Н.; Ёсикава, Ю.; Исихара, К.; Окабе, Н.; Оиси, К. (2013). «Молекулярно-филогенетический анализ Orientia tsutsugamushi на основе генов groES и groEL » . Трансмиссивные и зоонозные болезни . 13 (11): 825–829. дои : 10.1089/vbz.2012.1155 . ПМЦ 3822374 . ПМИД 24107204 .
- ^ Jump up to: а б с Питер, СП; Сударсан, Техас; Пракаш, Джей Джей; Варгезе, генеральный директор (2015). «Тяжелая инфекция кустарникового сыпного тифа: клинические особенности, проблемы диагностики и лечение» . Всемирный журнал медицины критических состояний . 4 (3): 244–250. дои : 10.5492/wjccm.v4.i3.244 . ПМК 4524821 . ПМИД 26261776 .
- ^ Тейлор, Эй Джей; Париж, DH; Ньютон, Пенсильвания; Уокер, Д.Х. (2015). «Систематический обзор смертности от нелеченного кустарникового сыпного тифа ( Orientia tsutsugamushi )» . PLOS Забытые тропические болезни . 9 (8): e0003971. дои : 10.1371/journal.pntd.0003971 . ПМЦ 4537241 . ПМИД 26274584 .
- ^ Jump up to: а б с Бонелл, А.; Любелл, Ю.; Ньютон, Пенсильвания; Крамп, Дж.А.; Париж, DH (2017). «Оценка бремени кустарникового сыпного тифа: систематический обзор» . PLOS Забытые тропические болезни . 11 (9): e0005838. дои : 10.1371/journal.pntd.0005838 . ПМЦ 5634655 . ПМИД 28945755 .
- ^ Jump up to: а б Раджапаксе, С.; Виратунга, П.; Шивайоганатан, С.; Фернандо, SD (2017). «Клинические проявления кустарникового тифа». Труды Королевского общества тропической медицины и гигиены . 111 (2): 43–54. дои : 10.1093/trstmh/trx017 . ПМИД 28449088 . S2CID 3751821 .
- ^ Махаджан, СК (2017). «Нервно-психические проявления кустарникового сыпного тифа» . Журнал нейронаук в сельской практике . 8 (3): 421–426. дои : 10.4103/jnrp.jnrp_44_17 . ПМЦ 5488565 . ПМИД 28694624 .
- ^ Джайн, П.; Пракаш, С.; Трипати, ПК; Чаухан, А.; Гупта, С.; Шарма, У.; Джайсвал, АК; Шарма, Д.; Джайн, А. (2018). «Появление Orientia цуцугамуси как важной причины синдрома острого энцефалита в Индии» . PLOS Забытые тропические болезни . 12 (3): e0006346. дои : 10.1371/journal.pntd.0006346 . ПМК 5891077 . ПМИД 29590177 .
- ^ ВОЗ (1999). «Рекомендованные ВОЗ стандарты надзора (второе издание)» . ВОЗ/CDS/CSR/ISR/99.2 . Всемирная организация здравоохранения, Женева. п. 124. Архивировано из оригинала 18 апреля 2003 года.
- ^ Цзян, Дж.; Ричардс, Алабама (2018). «Крабовый тиф: больше не ограничивается Треугольником Цуцугамуси» . Тропическая медицина и инфекционные болезни . 3 (1): 11. doi : 10.3390/tropicalmed3010011 . ПМК 6136623 . ПМИД 30274409 .
- ^ Уокер, Д.Х.; Париж, DH; День, НП; Шелите, ТР (2013). «Нерешенные проблемы, связанные с сыпным тифом: серьезно забытое опасное для жизни заболевание» . Американский журнал тропической медицины и гигиены . 89 (2): 301–307. дои : 10.4269/ajtmh.13-0064 . ПМЦ 3741252 . ПМИД 23926142 .
- ^ Мёрх, К.; Манохаран, А.; Чанди, С.; Чако, Н.; Альварес-Урия, Г.; Патил, С.; Генри, А.; Несарадж, Дж.; Куриакосе, К.; Сингх, А.; Куриан, С.; Джилл Хааншуус, К.; Лангеланд, Н.; Бломберг, Б.; Васантан Энтони, Г.; Матай, Д. (2017). «Острая недифференцированная лихорадка в Индии: многоцентровое исследование этиологии и точности диагностики» . БМК Инфекционные болезни . 17 (1): 665. doi : 10.1186/s12879-017-2764-3 . ПМЦ 5628453 . ПМИД 28978319 .
- ^ Вангрангимакул, Т.; Альтхаус, Т.; Мукака, М.; Кантипонг, П.; Вутиканун, В.; Чиеракул, В.; Блэкселл, SD; День, НП; Лаонгнуальпанич, А.; Париж, DH (2018). «Причины острой недифференцированной лихорадки и полезность биомаркеров в Чианграй, северный Таиланд» . PLOS Забытые тропические болезни . 12 (5): e0006477. дои : 10.1371/journal.pntd.0006477 . ПМЦ 5978881 . ПМИД 29852003 .
- ^ Кундаварам, AP; Джонатан, AJ; Натаниэль, SD; Варгезе, генеральный директор (2013). «Слез при кустарниковом тифе: ценный ключ к диагностике» . Журнал последипломной медицины . 59 (3): 177–178. дои : 10.4103/0022-3859.118033 . ПМИД 24029193 .
- ^ Варгезе, генеральный менеджер; Джанарданан, Дж.; Троубридж, П.; Питер, СП; Пракаш, Дж.А.; Сатьендра, С.; Томас, К.; Дэвид, ТС; Кавита, МЛ; Авраам, ОК; Матай, Д. (2013). «Крабовый тиф в Южной Индии: клинические и лабораторные проявления, генетическая изменчивость и исход» . Международный журнал инфекционных заболеваний . 17 (11): e981-987. дои : 10.1016/j.ijid.2013.05.017 . ПМИД 23891643 .
- ^ Кельман, П.; Томпсон, штат Вашингтон; Хайнс, В.; Бергман, К.; Ленахан, К.; Бреннер, Дж. С.; Бреннер, МГ; Гудман, Б.; Борхес, Д.; Филак, М.; Гафф, Х. (2018). « Инфекции Rickettsia parkeri , диагностированные с помощью биопсии струпа, Вирджиния, США». Инфекция . 46 (4): 559–563. дои : 10.1007/s15010-018-1120-x . ПМИД 29383651 . S2CID 30442009 .
- ^ Сильва, Н.; Еремеева М.Э.; Розенталь, Т.; Рибейро, GS; Пэддок, CD; Рамос, Э.А.; Фавачо, Арканзас; Рейс, МГ; Даш, Джорджия; де Лемос, ER; Ко, А.И. (2011). «Риккетсиоз пятнистой лихорадки, связанный со струпом, Баия, Бразилия» . Новые инфекционные заболевания . 17 (2): 275–278. дои : 10.3201/eid1702.100859 . ПМК 3204763 . ПМИД 21291605 .
- ^ Хулмани, М.; Алекья, П.; Кумар, виджей (2017). «Индийский клещевой тиф, проявляющийся молниеносной пурпурой, с обзором риккетсиозных инфекций» . Индийский журнал дерматологии . 62 (1): 1–6. дои : 10.4103/0019-5154.198030 . ПМК 5286740 . ПМИД 28216718 .
- ^ Уокер, Д.Х. (1989). «Риккетсиозы группы пятнистых лихорадок мира». Журнал дерматологии . 16 (3): 169–177. дои : 10.1111/j.1346-8138.1989.tb01244.x . ПМИД 2677080 . S2CID 21977403 .
- ^ Денисон, AM; Амин, Б.Д.; Николсон, WL; Пэддок, компакт-диск (2014). «Обнаружение Rickettsia rickettsii , Rickettsia parkeri и Rickettsia akari в образцах биопсии кожи с использованием мультиплексного анализа полимеразной цепной реакции в реальном времени» . Клинические инфекционные болезни . 59 (5): 635–642. дои : 10.1093/cid/ciu358 . ПМК 4568984 . ПМИД 24829214 .
- ^ Коралуру, М.; Байри, И.; Варма, М.; Видьясагар, С. (2015). «Диагностическая валидация избранных серологических тестов для выявления кустарникового сыпного тифа» . Микробиология и иммунология . 59 (7): 371–374. дои : 10.1111/1348-0421.12268 . ПМИД 26011315 . S2CID 49921 .
- ^ Патрисия, Калифорния; Хоти, СЛ; Канунго, Р.; Джамбулингам, П.; Шашикала, Н.; Наик, AC (2017). «Улучшение диагностики сыпного тифа путем объединения полимеразной цепной реакции на основе groEL и ИФА IgM» . Журнал клинических и диагностических исследований . 11 (8): DC27–DC31. дои : 10.7860/JCDR/2017/26523.10519 . ПМЦ 5620764 . ПМИД 28969124 .
- ^ Рахи, М.; Гупте, доктор медицины; Бхаргава, А.; Варгезе, Г.Мм; Арора, Р. (2015). «Руководство DHR-ICMR по диагностике и лечению риккетсиозных заболеваний в Индии» . Индийский журнал медицинских исследований . 141 (4): 417–22. дои : 10.4103/0971-5916.159279 . ПМЦ 4510721 . ПМИД 26112842 .
- ^ Чанта, К.; Флоэнчайванит, П. (2015). «Рандомизированное контролируемое исследование азитромицина по сравнению с доксициклином или хлорамфениколом для лечения неосложненного детского сыпного тифа». Журнал Медицинской ассоциации Таиланда . 98 (8): 756–760. ПМИД 26437532 .
- ^ Ли, Южная Каролина; Ченг, Ю.Дж.; Лин, Швейцария; Лей, WT; Чанг, Хай; Ли, доктор медицины; Лю, Дж. М.; Сюй, Р.Дж.; Чиу, Северная Каролина; Чи, Х.; Пэн, CC; Цай, ТЛ; Лин, CY (2017). «Сравнительная эффективность азитромицина при лечении сыпного тифа» . Лекарство . 96 (36): е7992. дои : 10.1097/MD.0000000000007992 . ПМК 6392745 . ПМИД 28885357 .
- ^ Кард, Висконсин; Уокер, Дж. М. (1947). «Вакцина против брюшного тифа; полевые испытания в Юго-Восточной Азии». Ланцет . 1 (6450): 481–483. дои : 10.1016/S0140-6736(47)91989-2 . ПМИД 20294827 .
- ^ Берге, ТО; Голд, РЛ; Китаока, М. (1949). «Полевые испытания вакцины, приготовленной из штамма Вольнера риккетсии цуцугамуси ». Американский журнал гигиены . 50 (3): 337–342. doi : 10.1093/oxfordjournals.aje.a119366 . ПМИД 15391985 .
- ^ Jump up to: а б Вальбуэна, Г.; Уокер, Д.Х. (2013). «Подходы к вакцинам против Orientia цуцугамуси » . Границы клеточной и инфекционной микробиологии . 2 : 127. дои : 10.3389/fcimb.2012.00170 . ПМК 3539663 . ПМИД 23316486 .
- ^ Чой, С.; Чон, HJ; Хван, Кей Джей; Гилл, Б.; Джу, Ю.Р.; Ли, Ю.С.; Ли, Дж. (2017). «Рекомбинантный белок внешней мембраны массой 47 кДа индуцирует иммунный ответ против Orientia tsutsugamushi штамма Boryong» . Американский журнал тропической медицины и гигиены . 97 (1): 30–37. дои : 10.4269/ajtmh.15-0771 . ПМЦ 5508880 . ПМИД 28719308 .
- ^ Смадел, Дж. Э.; Лей, HLJr.; Диркс, Ф.Х.; Трауб, Р. (1950). «Иммунитет при кустарниковом тифе: устойчивость к индуцированному реинфекции». Архивы патологии АМА . 50 (6): 847–861. ПМИД 14789327 .
- ^ Макмиллан, Дж.Г.; Райс, РМ; Джеррелс, Т.Р. (1985). «Развитие антигенспецифических клеточно-опосредованных иммунных ответов после заражения яванских макак ( Macaca fascicleis ) Rickettsia tsutsugamushi ». Журнал инфекционных болезней . 152 (4): 739–749. дои : 10.1093/infdis/152.4.739 . ПМИД 2413138 .
- ^ Ха, Нью-Йорк; Ким, Ю.; Мин, СК; Ким, Привет; йена, NTH; Чой, М.С.; Канг, Дж. С.; Ким, Ю.С.; Чо, Нью-Хэмпшир (2017). «Продолжительность жизни антител и Т-клеточных ответов против антигенов внешней мембраны Orientia tsutsugamushi у пациентов с сыпным тифом» . Новые микробы и инфекции . 6 (12): е116. дои : 10.1038/emi.2017.106 . ПМК 5750460 . ПМИД 29259327 .