полуторный сульфид фосфора
| |||
 | |||
| Имена | |||
|---|---|---|---|
| ИЮПАК имена Трисульфид тетрафосфора или 3,5,7-тритиа-1,2,4,6-тетрафосфаттрицикло[2.2.1.0 2,6 ]гептан | |||
| Другие имена трисульфид фосфора, полуторасульфид фосфора, сульфид фосфора | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.013.860 | ||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| П 4 С 3 | |||
| Молярная масса | 220.093 g/mol | ||
| Появление | Желтое, желто-зеленое или серое твердое вещество | ||
| Плотность | 2.08 g.cm 3 , [1] твердый | ||
| Температура плавления | 172,5 ° С (342,5 ° F; 445,6 К) | ||
| Точка кипения | 408 ° С (766 ° F, 681 К) | ||
| Структура | |||
| орторомбический , обозначение Шёнфлиса D 2h | |||
| Пмнб | |||
| С 3В | |||
| Родственные соединения | |||
Родственные соединения | П 4 С 10 П 4 О 6 | ||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности | Раздражающий | ||
| СГС Маркировка : | |||
 | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Сесквисульфид фосфора представляет собой соединение формулы неорганическое П 4 С 3 . Он был разработан Анри Севеном и Эмилем Давидом Каэном в 1898 году как часть изобретения фрикционных спичек , которые не представляли опасности для здоровья, свойственной белому фосфору . [2] [3] Это желтое твердое вещество является одним из двух сульфидов фосфора, выпускаемых промышленностью . Это компонент матчей «Ударь куда угодно».
В зависимости от чистоты образцы могут иметь цвет от желто-зеленого до серого. Соединение было обнаружено Г. Лемуаном и впервые безопасно произведено в коммерческих количествах в 1898 году Олбрайтом и Уилсоном . Растворяется в равной массе сероуглерода ( CS 2 в весовом соотношении 1:50 ) и бензола . В отличие от некоторых других сульфидов фосфора, P 4 S 3 медленно гидролизуется и имеет четко определенную температуру плавления.
Структура и синтез
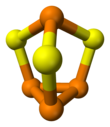
[ редактировать ]Молекула имеет C3v симметрию . Это производное от тетраэдра ( P 4 ) агрегат внедрения серы в три связи ПП. Расстояния PS и PP составляют 2,090 и 2,235 Å соответственно. P 4 Se 3 и P 4 S 3 принимают те же структуры. [1] Эти соединения могут плавиться вместе и образовывать смешанные кристаллы одного, растворенного в другом. [4] При более высоких температурах смешанные молекулы халькогенидов P 4 S 2 Se и P 4 SSe 2 сформируется. [5]
P 4 S 3 получают реакцией красного или белого фосфора с серой. Избыток серы дает пентасульфид фосфора ( П 4 С 10 ). По оценкам, в 1989 году было произведено 150 тонн в год. [6]
Приложения
[ редактировать ]P 4 S 3 и хлорат калия вместе с другими материалами составляют головки «зажигаемых спичек ». [7]
Безопасность
[ редактировать ]Его температура вспышки составляет около 100°С. [8]
Влияние на здоровье
[ редактировать ]Воздействие спичек, содержащих полуторный сульфид фосфора, которые можно ударить куда угодно, может вызвать контактный дерматит , обычно в области карманов, но также и на лице. [9] Воздействие в течение длительного периода времени горящих кончиков спичек (содержащих фосфор).сесквисульфид) может привести к рецидивирующему тяжелому первичному дерматиту вокруг глаз и лица. Сообщалось также о расшатывании зубов, что могло быть связано с отравлением фосфором. [10]
Ссылки
[ редактировать ]- ^ Jump up to: а б Люнг, ЮК; Васер, Дж.; ван Хаутен, С.; Вос, А.; Вигерс, Джорджия; Вибенга, Э.Х. (1957). «Кристаллическая структура P 4 S 3 » . Акта Кристаллографика . 10 (9): 574–582. дои : 10.1107/S0365110X57002042 .
- ^ патент США 614350 , Сейен, Х.; Каэн, Эд, «Состав матча», выпущено 15 ноября 1898 г.
- ^ США 614350
- ^ Бернс, Гэри Р.; Сарфати, Джонатан Д. (1988). «Спектры комбинационного рассеяния триселенида тетрафосфора, легированного трисульфидом тетрафосфора». Твердотельные коммуникации . 66 (4): 347–349. Бибкод : 1988SSCom..66..347B . дои : 10.1016/0038-1098(88)90854-X .
- ^ Бернс, Гэри Р.; Ролло, Джоан Р.; Сарфати, Джонатан Д. (1989). «Спектры комбинационного рассеяния света каркасных молекул трихалькогенида тетрафосфора P 4 S 2 Se и P 4 SSe 2 ». Неорганика Химика Акта . 161 : 35–38. дои : 10.1016/S0020-1693(00)90111-7 .
- ^ Беттерманн, Г.; Краузе, В.; Рисс, Г.; Хофманн, Т. «Неорганические соединения фосфора». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a19_527 . ISBN 978-3527306732 .
- ^ Корбридж, Декабрь (1995). Фосфор: очерк химии, биохимии и технологии (5-е изд.). Амстердам: Эльзевир. стр. 115–116. ISBN 0-444-89307-5 .
- ^ Льюис, Р.Дж. старший (2007). Сокращенный химический словарь Хоули (15-е изд.). Нью-Йорк, штат Нью-Йорк: John Wiley & Sons, Inc., с. 987.
- ^ Берджесс, Дж. Ф.; Форси, Р. Рой (1951). «Контактный дерматит лица из-за спичек». AMA Arch Дерматол Сифилол . 64 (5). Американская медицинская ассоциация: 636–637. дои : 10.1001/archderm.1951.01570110106016 .
- ^ Берджесс, Дж. Фредерик (декабрь 1951 г.). «Отравление сесквисульфидом фосфора» . Может ли Med Assoc J. 65 (6). Канадская медицинская ассоциация: 567–568. ПМЦ 1822299 . ПМИД 14886853 .
Эта статья содержит цитируемый общедоступный текст NOAA.