Генный драйв
Генный драйв — естественный процесс [1] и технология генной инженерии , которая распространяет определенный набор генов среди населения. [2] путем изменения вероятности того, что конкретный аллель будет передан потомству (вместо менделевской вероятности 50% ). Генные драйвы могут возникать посредством множества механизмов. [3] [4] Было предложено, чтобы они стали эффективным средством генетической модификации конкретных популяций и целых видов.
Этот метод может включать добавление, удаление, разрушение или модификацию генов. [5] [6]
Предлагаемые применения включают уничтожение насекомых-переносчиков болезнетворных микроорганизмов (особенно комаров, переносящих возбудители малярии , лихорадки денге и Зика ), контроль инвазивных видов или устранение к гербицидам или устойчивости пестицидам . [7] [5] [8] [9]
Как и любой потенциально мощный метод, генный драйв может быть использован различными способами или вызвать непредвиденные последствия . Например, генный драйв, предназначенный для воздействия только на местную популяцию, может распространиться на весь вид. Генные драйвы, уничтожающие популяции инвазивных видов в их чужеродных средах обитания, могут иметь последствия для популяции вида в целом, даже в его естественной среде обитания. Любое случайное возвращение особей этого вида в первоначальные места обитания в результате естественной миграции, нарушения окружающей среды (ураганы, наводнения и т. д.), случайной транспортировки людей или целенаправленного перемещения может непреднамеренно привести к исчезновению вида, если переселившиеся особи несут вредный ген. диски. [10]
Генные драйвы могут быть построены из многих природных эгоистичных генетических элементов , использующих различные молекулярные механизмы. [3] Эти естественные механизмы вызывают аналогичные нарушения сегрегации в дикой природе, возникающие, когда аллели развивают молекулярные механизмы, которые дают им вероятность передачи, превышающую нормальные 50%.
Большинство генных драйвов было разработано у насекомых, особенно у комаров, как способ борьбы с патогенами, передающимися насекомыми. Недавние разработки позволили разработать генные драйвы непосредственно в вирусах, особенно в герпесвирусах . Эти вирусные генные драйвы могут распространять модификации в популяции вирусов и направлены на снижение инфекционности вируса. [11] [12]
Механизм
[ редактировать ]У видов, размножающихся половым путем , большинство генов присутствуют в двух копиях (которые могут представлять собой одинаковые или разные аллели ), каждая из которых имеет 50% вероятность передачи потомку. Изменяя наследование определенных измененных генов, синтетические генные драйвы могли бы более эффективно распространять изменения в популяции. [5] [6]
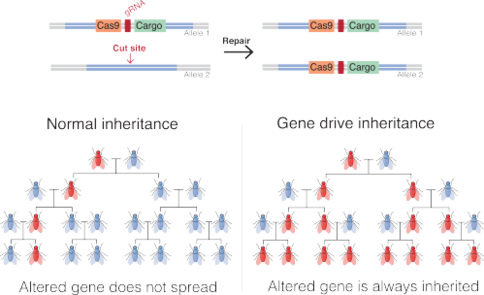
Обычно ученые встраивают генный драйв в ДНК организма вместе с механизмом CRISPR-Cas9. Когда модифицированный организм спаривается и его ДНК смешивается с ДНК партнера, инструмент CRISPR-Cas9 разрезает ДНК партнера в том же месте, где в первом организме находится генный драйв. Клетка восстанавливает разрезанную ДНК, копируя генный драйв первого организма в соответствующее место в ДНК потомка. Это означает, что обе копии гена (по одной от каждого родителя) теперь содержат генный драйв.
Молекулярные механизмы
[ редактировать ]
На молекулярном уровне генный драйв эндонуклеазы работает путем разрезания хромосомы в определенном участке, который не кодирует этот драйв, побуждая клетку восстанавливать повреждения путем копирования последовательности драйва на поврежденную хромосому. Тогда ячейка имеет две копии последовательности импульсов. Этот метод основан на методах редактирования генома и основан на гомологичной рекомбинации . Для достижения такого поведения генные драйвы эндонуклеаз состоят из двух вложенных элементов:
- Эндонуклеаза , которая избирательно разрезает «целевую последовательность», т.е. конкурирующую аллель. Это может быть одно из:
- Самонаводящаяся эндонуклеаза , которую природные интеины используют для размножения. Однако их очень сложно, если не невозможно, переориентировать. [5]
- РНК-ориентированная эндонуклеаза (например, Cas9 или Cas12a [13] ) и его направляющую РНК , которую можно легко изменить для установки цели. [5] Cas9 — наиболее многообещающая технология, указанная в обзоре 2014 года. [5] Генные драйвы Cas9 были успешно протестированы в 2015 году. [14] и Cas12a в 2023 году. [15]
- Любая другая программируемая эндонуклеазная система, такая как модульные нуклеазы с цинковыми пальцами и TALEN . [5] Один из таких стимулов был успешно протестирован на плодовых мушках, но оказался эволюционно нестабильным из-за многоповторяющейся природы этих эндонуклеаз. [5]
- Матричная последовательность , используемая механизмом репарации ДНК после разрезания целевой последовательности. Для достижения саморазмножающейся природы генных драйвов эта матрица репарации содержит по крайней мере последовательность эндонуклеазы. Поскольку матрица должна использоваться для восстановления двухцепочечного разрыва в месте разреза, ее стороны гомологичны последовательностям, прилегающим к месту разреза в геноме хозяина. Направляя генный драйв на кодирующую последовательность гена, этот ген будет инактивирован; в генный драйв могут быть введены дополнительные последовательности для кодирования новых функций.
В результате вставка генного драйва в геном будет повторяться в каждом организме, который унаследует одну копию модификации и одну копию гена дикого типа. Если генный драйв уже присутствует в яйцеклетке (например, при получении от одного родителя), все гаметы особи будут нести генный драйв (вместо 50% в случае нормального гена). [5]
Распространение среди населения
[ редактировать ]Этот раздел нуждается в дополнительных цитатах для проверки . ( Ноябрь 2017 г. ) |
Поскольку его частота никогда не может более чем удваиваться с каждым поколением, генный драйв, внедренный в одного человека, обычно требует десятков поколений, чтобы повлиять на значительную часть популяции. Альтернативно, высвобождение в достаточном количестве организмов, содержащих побуждения, может повлиять на остальных в течение нескольких поколений; например, если ввести его в каждую тысячную особь, потребуется всего лишь 12–15 поколений, чтобы он присутствовал у всех особей. [16] Сможет ли генный драйв в конечном итоге закрепиться в популяции и с какой скоростью, зависит от его влияния на индивидуальную приспособленность, на скорость конверсии аллелей и на структуру популяции. Популяционная генетика предсказывает, что в хорошо смешанной популяции и с реалистичной частотой конверсии аллелей (≈90%) генные драйвы фиксируются при коэффициенте отбора меньше 0,3; [16] другими словами, генный драйв можно использовать для распространения модификаций до тех пор, пока репродуктивный успех не снизится более чем на 30%. Это контрастирует с нормальными генами, которые могут распространяться среди больших популяций только в том случае, если повышают приспособленность.
Генный драйв в вирусах
[ редактировать ]Поскольку эта стратегия обычно основана на одновременном присутствии немодифицированной аллели и аллели генного драйва в одном и том же клеточном ядре , обычно предполагалось, что генный драйв можно создать только в организмах, размножающихся половым путем, за исключением бактерий и вирусов . Однако во время вирусной инфекции вирусы могут накапливать в инфицированных клетках сотни или тысячи копий генома. Клетки часто одновременно заражаются несколькими вирионами, и рекомбинация вирусных геномов является хорошо известным и широко распространенным источником разнообразия для многих вирусов. В частности, герпесвирусы реплицирующиеся в ядре представляют собой ДНК-вирусы, , с большими геномами двухцепочечной ДНК и часто подвергаются гомологичной рекомбинации во время цикла репликации.
Эти свойства позволили разработать стратегию генного драйва, которая не предполагает полового размножения, а вместо этого опирается на совместное заражение данной клетки природным и искусственно созданным вирусом. При коинфекции немодифицированный геном разрезается и восстанавливается путем гомологичной рекомбинации, в результате чего образуются новые вирусы с генным драйвом, которые могут постепенно заменить естественную популяцию. В экспериментах на клеточных культурах было показано, что вирусный генный драйв может распространяться на вирусную популяцию и сильно снижать инфекционность вируса, что открывает новые терапевтические стратегии против герпевирусов. [11]
Технические ограничения
[ редактировать ]Поскольку генные драйвы распространяются путем замены других аллелей, содержащих участок разреза и соответствующие гомологии, их применение в основном ограничивается видами, размножающимися половым путем (поскольку они диплоидны или полиплоидны , и аллели смешиваются в каждом поколении). В качестве побочного эффекта инбридинг в принципе может стать механизмом бегства, но степень, в которой это может произойти на практике, трудно оценить. [17]
Из-за количества поколений, необходимых для того, чтобы генный драйв затронул всю популяцию, время достижения универсальности варьируется в зависимости от репродуктивного цикла каждого вида: для некоторых беспозвоночных это может занять менее года, но для организмов с многолетними интервалами может потребоваться менее года. между рождением и половой зрелостью , например, у человека. [18] Следовательно, эта технология наиболее полезна для быстро размножающихся видов.
Эффективность в реальной практике варьируется в зависимости от метода, особенно в зависимости от выбора промотора зародышевой линии . Lin and Potter 2016 (a) раскрывает технологию гомологии промотора с помощью нокина CRISPR (HACK), а Lin and Potter 2016 (b) демонстрирует фактическое использование, достигая высокой доли измененного потомства от каждой измененной матери -дрозофилы . [19]
Проблемы
[ редактировать ]К проблемам, поднятым исследователями, относятся: [20]
- Мутации: Мутация может произойти в середине пути, что потенциально может позволить нежелательным чертам «пройти дальше».
- Побег: скрещивание или поток генов потенциально позволяют стремлению выйти за пределы целевой популяции.
- Экологическое воздействие: даже когда понятно прямое влияние новых черт на цель, это стремление может иметь побочные эффекты на окружающую среду.
Институт Броуда Массачусетского технологического института и Гарварда добавил генные драйвы в список применений технологий редактирования генов, которые, по его мнению, компаниям не следует использовать. [21] [ нужен лучший источник ]
Проблемы биоэтики
[ редактировать ]Генные драйвы влияют на все будущие поколения и открывают возможность более масштабных изменений в живых видах, чем это было возможно раньше. [22]
В декабре 2015 года ученые крупнейших мировых академий призвали ввести мораторий на наследуемые правки генома человека , которые могут повлиять на зародышевую линию, в том числе связанные с CRISPR-Cas9 . технологиями [23] но поддержал продолжение фундаментальных исследований и редактирования генов, которые не повлияют на будущие поколения. [24] В феврале 2016 года регулирующие органы дали британским ученым разрешение на генетическую модификацию человеческих эмбрионов с помощью CRISPR-Cas9 и связанных с ним методов при условии, что эмбрионы будут уничтожены в течение семи дней. [25] [26] США В июне 2016 года Национальные академии наук, техники и медицины опубликовали отчет о своих «Рекомендациях по ответственному поведению» в области генных драйвов. [27]
Исследования по математическому моделированию, проведенные в 2018 году, показывают, что, несмотря на ранее существовавшую и развивающуюся устойчивость генного драйва (вызванную мутациями в месте разреза), даже неэффективный генный драйв CRISPR «альтерационного типа» может добиться фиксации в небольших популяциях. При небольшом, но ненулевом объеме потока генов среди многих местных популяций генный драйв может ускользнуть и преобразовать и внешние популяции. [28]
Кевин М. Эсвелт заявил, что необходим открытый разговор о безопасности генных драйвов: «На наш взгляд, разумно предположить, что инвазивные и саморазмножающиеся системы генного драйва, скорее всего, распространятся на каждую популяцию целевых видов на протяжении всего человечества. Соответственно, их следует создавать только для борьбы с настоящими эпидемиями, такими как малярия, против которой у нас мало адекватных мер противодействия и которые открывают реалистичный путь к международному соглашению, которое можно будет развернуть среди всех пострадавших стран». [29] Он перешел к открытой модели для своего собственного исследования по использованию генных драйвов для искоренения болезни Лайма в Нантакете и Мартас-Виньярд . [30] Эсвелт и его коллеги предположили, что CRISPR можно использовать для спасения находящихся под угрозой исчезновения диких животных от вымирания. Позже Эсвелт отказался от своей поддержки этой идеи, за исключением чрезвычайно опасных популяций, таких как комары-переносчики малярии, и изолированных островов, которые не позволяли распространиться за пределы целевой территории. [31]
История
[ редактировать ]Остин Берт, эволюционный генетик из Имперского колледжа Лондона , в 2003 году представил возможность проведения генных драйвов на основе эгоистичных генетических элементов естественной самонаводящейся эндонуклеазы . [6]
Исследователи уже показали, что такие гены могут действовать эгоистично , быстро распространяясь среди последующих поколений. Берт предположил, что генные драйвы можно использовать для предотвращения передачи малярийного паразита через популяцию комаров или для уничтожения популяции комаров. Генные драйвы, основанные на самонаведении эндонуклеаз, были продемонстрированы в лаборатории на трансгенных популяциях комаров. [32] и плодовые мухи. [33] [34] Однако хоминг-эндонуклеазы специфичны для последовательности. Изменение их специфичности для нацеливания на другие представляющие интерес последовательности остается серьезной проблемой. [3] Возможные применения генного драйва оставались ограниченными до открытия CRISPR и связанных с ним РНК-ориентированных эндонуклеаз, таких как Cas9 и Cas12a .
В июне 2014 года Специальная программа Всемирной организации здравоохранения (ВОЗ) по исследованиям и обучению в области тропических болезней [35] выпущенные руководящие принципы [36] для оценки генетически модифицированных комаров. В 2013 году Европейское агентство по безопасности пищевых продуктов выпустило протокол. [37] для экологической оценки всех генетически модифицированных организмов .
Финансирование
[ редактировать ]Target Malaria , проект, финансируемый Фондом Билла и Мелинды Гейтс , инвестировал 75 миллионов долларов в технологию генного драйва. Первоначально фонд предполагал, что технология будет готова к использованию в полевых условиях где-нибудь в Африке к 2029 году. Однако в 2016 году Гейтс изменил эту оценку на некоторое время в течение следующих двух лет. [38] В декабре 2017 года документы, опубликованные в соответствии с Законом о свободе информации, показали, что DARPA инвестировало 100 миллионов долларов в исследования генного драйва. [39]
Стратегии контроля
[ редактировать ]Ученые разработали множество стратегий для сохранения контроля над генными драйвами. [ нужна ссылка ]
В 2020 году исследователи сообщили о разработке двух элементов, содержащих только активную направляющую РНК , которые, согласно их исследованию, могут позволить остановить или удалить генные драйвы, введенные в популяции в дикой природе с помощью редактирования генов CRISPR-Cas9 . Старший автор статьи предупреждает, что две нейтрализующие системы, которые они продемонстрировали в экспериментах в клетках, «не следует использовать с ложным чувством безопасности для генных драйвов, реализуемых в полевых условиях». [40] [41]
Если в ликвидации нет необходимости, может быть желательно намеренно сохранить целевую популяцию на более низком уровне, используя менее суровую технологию генного драйва. Это работает путем поддержания полудефектной популяции на неопределенный срок в целевой области, тем самым вытесняя потенциальные близлежащие дикие популяции, которые в противном случае вернулись бы, чтобы заполнить пустоту. [42]
КРИСПР
[ редактировать ]КРИСПР [43] является ведущим методом генной инженерии . [44] В 2014 году Эсвелт и его коллеги впервые предположили, что CRISPR/Cas9 можно использовать для создания генных драйвов. [5] В 2015 году исследователи сообщили об успешной разработке генных драйвов на основе CRISPR у Saccharomyces. [45] , Дрозофила , [46] и комары . [47] [48] Они сообщили об эффективном искажении наследования в последующих поколениях, при этом одно исследование продемонстрировало распространение гена в лабораторных популяциях. [48] Ожидалось, что аллели, устойчивые к вождению, возникнут для каждого из описанных генных драйвов; однако это можно было бы отложить или предотвратить, нацеливаясь на высококонсервативные сайты, устойчивость которых, как ожидается, будет иметь серьезные последствия для приспособленности.
Благодаря гибкости нацеливания CRISPR, генные драйвы теоретически можно использовать для создания практически любого признака. В отличие от предыдущих подходов, их можно адаптировать для блокирования развития сопротивления влечению, воздействуя на несколько последовательностей. CRISPR также может создать архитектуру генного драйва, которая будет контролировать, а не уничтожать популяции. [ нужна ссылка ]
В 2022 году t-CRISPR был использован для передачи гена «t-гаплотипа» примерно 95% потомков. Этот подход распространяет дефектные копии гена женской фертильности на потомство, делая его бесплодным. Исследователи сообщили, что их модели предполагают, что добавление 256 измененных животных на остров с популяцией в 200 000 мышей приведет к уничтожению популяции примерно через 25 лет. Традиционные подходы с использованием ядов и ловушек не потребовались. [49]
Приложения
[ редактировать ]Генные драйвы имеют два основных класса применения, которые имеют разное значение:
- внедрить генетическую модификацию в лабораторных популяциях; как только получен штамм или линия, несущая генный драйв, этот драйв можно передать любой другой линии путем скрещивания. Здесь генный драйв используется для гораздо более легкого решения задачи, которую можно было бы выполнить с помощью других методов.
- внедрить генетическую модификацию в дикие популяции. Генные драйвы представляют собой важное достижение, которое делает возможными ранее недостижимые изменения.
Из-за беспрецедентного потенциального риска были предложены и протестированы защитные механизмы. [45] [50]
Виды переносчиков болезней
[ редактировать ]Одним из возможных применений является генетическая модификация комаров , мышей и других переносчиков болезней, чтобы они не могли передавать такие заболевания, как малярия и лихорадка денге в случае комаров и клещевые заболевания в случае мышей. [51] Исследователи утверждают, что, применив эту технику к 1% дикой популяции комаров, они смогут искоренить малярию в течение года. [52]
Контроль инвазивных видов
[ редактировать ]Генный драйв может быть использован для уничтожения инвазивных видов и, например, был предложен в качестве способа уничтожения инвазивных видов в Новой Зеландии . [53] Генные драйвы для целей сохранения биоразнообразия изучаются в рамках программы «Генетический биоконтроль инвазивных грызунов» (GBIRd), поскольку они предлагают потенциал для снижения риска для нецелевых видов и снижения затрат по сравнению с традиционными методами удаления инвазивных видов. Учитывая риски такого подхода, описанные ниже, партнерство GBIRd стремится к обдуманному, поэтапному процессу, который будет осуществляться только после общественного согласия, как рекомендуют ведущие мировые исследователи генного драйва из Национальной академии генного драйва Австралии и США. наук и многие другие. [54] Существует более широкая информационно-пропагандистская сеть исследований генного драйва, призванная повысить осведомленность о ценности исследований генного драйва для общественного блага. [55]
Некоторые ученые обеспокоены этим методом, опасаясь, что он может распространиться и уничтожить виды в естественной среде обитания. [56] Ген может мутировать, потенциально вызывая непредвиденные проблемы (как и любой другой ген). [57] Многие неместные виды могут гибридизоваться с местными видами, так что генный драйв, поражающий чужеродное растение или животное, которое гибридизуется с местным видом, может обречь аборигенный вид на гибель. Многие неместные виды настолько хорошо прижились в новой среде обитания, что сельскохозяйственные культуры и/или местные виды приспособились зависеть от них. [58]
Хищник бесплатно 2050
[ редактировать ]Проект Predator Free 2050 — это правительственная программа Новой Зеландии, направленная на уничтожение в стране восьми инвазивных видов хищников-млекопитающих (включая крыс, короткохвостых ласк и опоссумов) к 2050 году. [59] [60] Впервые о проекте было объявлено в 2016 году премьер-министром Новой Зеландии Джоном Ки , а в январе 2017 года было объявлено, что в рамках проекта будет рассматриваться генный драйв, но это еще не реализовано. [60] В 2017 году одна группа в Австралии и другая в Техасе опубликовали предварительное исследование по созданию «мышей без дочерей» с использованием генных драйвов у млекопитающих. [61]
Калифорния
[ редактировать ]В 2017 году ученые из Калифорнийского университета в Риверсайде разработали генный драйв, способный атаковать инвазивную пятнистокрылую дрозофилу , разновидность плодовой мухи, обитающую в Азии, которая обходится калифорнийским вишневым фермам в 700 миллионов долларов в год из-за яйцеклада с острыми краями на хвосте . губящее незапятнанные плоды. Основная альтернативная стратегия борьбы включает использование инсектицидов , называемых пиретроидами , которые убивают почти всех насекомых, с которыми они контактируют. [21]
Защита диких животных
[ редактировать ]Философ-трансгуманист Дэвид Пирс выступает за использование генных драйвов на основе CRISPR для уменьшения страданий диких животных . [62] Кевин М. Эсвелт , американский биолог, который участвовал в разработке технологии генного драйва, утверждал, что существует моральное обоснование для уничтожения гусеницы Нового Света с помощью таких технологий, поскольку дикие животные испытывают огромные страдания, когда их едят живьем. . [63]
См. также
[ редактировать ]- Биологические машины
- Красный9
- Кас12а
- Мейотический драйв
- Редактирование генома
- Контроль численности населения
- Техника стерильных насекомых
- Синтетическая биология
- Цель борьбы с малярией
Ссылки
[ редактировать ]- ^ Алфи, Люк С.; Крисанти, Андреа; Рандаццо, Филиппо (Фил); Акбари, Омар С. (18 ноября 2020 г.). «Мнение: стандартизация определения генного драйва» . Труды Национальной академии наук . 117 (49): 30864–30867. дои : 10.1073/pnas.2020417117 . ISSN 0027-8424 . ПМЦ 7733814 . ПМИД 33208534 .
- ^ Каллауэй Э (21 июля 2017 г.). «Агенства обороны США борются с генным драйвом» . Природа . Проверено 24 апреля 2018 г.
- ^ Jump up to: а б с Чампер Дж., Бухман А., Акбари ОС (март 2016 г.). «Обман эволюции: создание генных двигателей для манипулирования судьбой диких популяций» . Обзоры природы. Генетика . 17 (3): 146–59. дои : 10.1038/nrg.2015.34 . ПМИД 26875679 .
- ^ Лефтвич П.Т., Эджингтон М.П., Харви-Сэмюэл Т., Карабахал Паладино Л.З., Норман В.К., Алфи Л. (октябрь 2018 г.). «Последние достижения в области пороговых генных драйвов комаров» . Труды Биохимического общества . 46 (5): 1203–1212. дои : 10.1042/BST20180076 . ПМК 6195636 . ПМИД 30190331 .
- ^ Jump up to: а б с д и ж г час я дж Эсвелт К.М. , Смидлер А.Л., Каттеручча Ф. , генеральный директор Черча (июль 2014 г.). «О управляемых РНК генных двигателях для изменения диких популяций» . электронная жизнь . 3 : e03401. doi : 10.7554/eLife.03401 . ПМК 4117217 . ПМИД 25035423 .
- ^ Jump up to: а б с Берт А. (май 2003 г.). «Местоспецифичные эгоистичные гены как инструменты контроля и генной инженерии природных популяций» . Слушания. Биологические науки . 270 (1518): 921–8. дои : 10.1098/rspb.2002.2319 . ПМК 1691325 . ПМИД 12803906 .
- ^ «Американские исследователи призывают к усилению контроля над мощными генетическими технологиями | Наука/AAAS | Новости» . News.sciencemag.org. 17 июля 2014 года . Проверено 18 июля 2014 г.
- ^ Бенедикт М., Д'Аббс П., Добсон С., Готлиб М., Харрингтон Л., Хиггс С. и др. (апрель 2008 г.). «Руководство по полевым испытаниям комаров-переносчиков, созданных для сдерживания системы генного драйва: рекомендации научной рабочей группы». Трансмиссивные и зоонозные болезни . 8 (2): 127–66. дои : 10.1089/vbz.2007.0273 . ПМИД 18452399 .
- ^ Редфорд К.Х., Брукс Т.М., Макфарлейн Н.Б., Адамс Дж.С. (2019). Генетические границы сохранения...техническая оценка . дои : 10.2305/iucn.ch.2019.05.en . ISBN 978-2-8317-1974-0 . S2CID 212870281 .
- ^ «Эта технология редактирования генов может быть слишком опасной, чтобы ее можно было использовать» . Проводной .
- ^ Jump up to: а б Уолтер, Мариус; Вердин, Эрик (28 сентября 2020 г.). «Вирусный генный драйв герпесвирусов» . Природные коммуникации . 11 (1): 4884. Бибкод : 2020NatCo..11.4884W . дои : 10.1038/s41467-020-18678-0 . ISSN 2041-1723 . ПМЦ 7522973 . ПМИД 32985507 .
- ^ «Генные драйвы могут убивать комаров и подавлять герпесвирусные инфекции» . Американский совет по науке и здоровью . 30 сентября 2020 г. Проверено 7 октября 2020 г.
- ^ « Даже CRISPR ». Экономист. ISSN 0013-0613. Проверено 3 мая 2016 г. Примечание. Cas12a ранее был известен как Cpf1. Последнее имя используется в этой статье 2015 года.
- ^ Хаммонд, Эндрю; Гализи, Роберто; Киру, Кирос; Симони, Алекос; Синискальки, Карла; Кацанос, Димитрис; Гриббл, Мэтью; Бейкер, Дин; Маруа, Эрик; Рассел, Стивен; Берт, Остин; Виндбихлер, Николай; Крисанти, Андреа; Нолан, Тони (январь 2016 г.). «Система генного драйва CRISPR-Cas9, направленная на воспроизводство самок у комаров-переносчиков малярии Anopheles gambiae» . Природная биотехнология . 34 (1): 78–83. дои : 10.1038/nbt.3439 . ПМЦ 4913862 .
- ^ Санс Жюсте, Сара; Окамото, Эмили М.; Нгуен, Кристина; Фэн, Сюэчунь; Лопес Дель Амо, Виктор (12 октября 2023 г.). «Системы генного драйва CRISPR следующего поколения с использованием нуклеазы Cas12a» . Природные коммуникации . 14 (1). дои : 10.1038/s41467-023-42183-9 . ПМЦ 10567717 .
- ^ Jump up to: а б Унклесс Р.Л., Мессер П.В., Конналлон Т., Кларк А.Г. (октябрь 2015 г.). «Моделирование манипуляции природными популяциями с помощью мутагенной цепной реакции» . Генетика . 201 (2): 425–31. дои : 10.1534/genetics.115.177592 . ПМК 4596658 . ПМИД 26232409 .
- ^ Булл Джей-Джей (2 апреля 2016 г.). «Смертельный генный драйв позволяет избежать инбридинга». bioRxiv 10.1101/046847 .
- ^ Ой К.А., Эсвелт К., Эпплтон Э., Каттеручча Ф., Черч Г., Куикен Т. и др. (август 2014 г.). «Биотехнология. Регулирование генных драйвов» . Наука . 345 (6197): 626–8. Бибкод : 2014Sci...345..626O . дои : 10.1126/science.1254287 . ПМИД 25035410 .
- ^ Хэй, Брюс А.; Оберхофер, Георг; Го, Мин (07 января 2021 г.). «Инженерия состава и судьбы диких популяций с помощью генного драйва» . Ежегодный обзор энтомологии . 66 (1). Годовые обзоры : 407–434. doi : 10.1146/annurev-ento-020117-043154 . ISSN 0066-4170 . ПМИД 33035437 . S2CID 222257628 .
- ^ Дринкуотер К., Куикен Т., Лайтфут С., Макнамара Дж., Ой К. (май 2014 г.). «Создание программы исследований экологических последствий синтетической биологии» . Кембридж, Массачусетс, и Вашингтон, округ Колумбия: Центр международных исследований Массачусетского технологического института и Международный центр ученых Вудро Вильсона. Архивировано из оригинала (PDF) 30 июля 2014 г. Проверено 20 июля 2014 г.
- ^ Jump up to: а б Регаладо А (12 декабря 2017 г.). «Калифорнийские фермеры рассматривают спорный генетический инструмент для уничтожения плодовых мух» . Обзор технологий Массачусетского технологического института . Проверено 28 апреля 2018 г.
- ^ «Генная инженерия почти всего» . ПБС. 17 июля 2014 г. «Мне все равно, сорняк это или болезнь, люди все равно будут говорить, что это слишком масштабный проект генной инженерии», - говорит [биоэтик] Каплан. «Во-вторых, это изменяет то, что передается по наследству, и это всегда было ярким направлением для генной инженерии».
- ^ Уэйд Н. (3 декабря 2015 г.). «Ученые вводят мораторий на изменения генома человека, которые могут передаваться по наследству» . Нью-Йорк Таймс . Проверено 3 декабря 2015 г.
- ^ Хаффакер С. (9 декабря 2015 г.). «Генетики голосуют за разрешение редактирования генов человеческих эмбрионов» . Новый учёный . Проверено 18 марта 2016 г.
- ^ Галлахер Дж. (1 февраля 2016 г.). «Ученые получили добро на «редактирование генов»» . Новости Би-би-си . Проверено 1 февраля 2016 года .
- ^ Ченг М. (1 февраля 2016 г.). «Британия одобряет спорную технику редактирования генов» . Ассошиэйтед Пресс . Архивировано из оригинала 1 февраля 2016 года . Проверено 1 февраля 2016 года .
- ^ «Исследование генного драйва в нечеловеческих организмах: рекомендации по ответственному поведению» . Национальные академии наук, техники и медицины . 8 июня 2016 г. Проверено 9 июня 2016 г.
- ^ Ноубл С., Адлам Б., генеральный директор Чёрча, Эсвелт К.М., Новак М.А. (июнь 2018 г.). «Современные системы генного драйва CRISPR, вероятно, будут очень инвазивными в диких популяциях» . электронная жизнь . 7 . дои : 10.7554/eLife.33423 . ПМК 6014726 . ПМИД 29916367 .
- ^ Эсвелт К.М., Джеммелл, штат Нью-Джерси (ноябрь 2017 г.). «Сохранение требует безопасного генного драйва» . ПЛОС Биология . 15 (11): e2003850. doi : 10.1371/journal.pbio.2003850 . ПМК 5689824 . ПМИД 29145398 .
- ^ Ён Э (11 июля 2017 г.). «План одного человека, направленный на то, чтобы редактирование генов не пошло наперекосяк» . theatlantic.com . Проверено 13 декабря 2017 г.
- ^ Циммер С (16 ноября 2017 г.). « Генные драйвы слишком опасны для полевых испытаний, говорят ученые» . Нью-Йорк Таймс . ISSN 0362-4331 . Проверено 22 апреля 2018 г.
- ^ Виндбихлер Н., Меничелли М., Папатанос П.А., Тимьян С.Б., Ли Х., Ульге Ю.И. и др. (май 2011 г.). «Система генного драйва на основе синтетической самонаводящейся эндонуклеазы у малярийного комара человека» . Природа . 473 (7346): 212–5. Бибкод : 2011Natur.473..212W . дои : 10.1038/nature09937 . ПМЦ 3093433 . ПМИД 21508956 .
- ^ Чан Ю.С., Науйокс Д.А., Хуэнь Д.С., Рассел С. (май 2011 г.). «Контроль популяции насекомых с помощью генного драйва, основанного на самонаводящейся эндонуклеазе: оценка у Drosophila melanogaster» . Генетика . 188 (1): 33–44. дои : 10.1534/genetics.111.127506 . ПМК 3120159 . ПМИД 21368273 .
- ^ Чан Ю.С., Хуэнь Д.С., Глауэрт Р., Уайтвей Э., Рассел С. (2013). «Оптимизация работы генного привода самонаводящейся эндонуклеазы у полурефрактерных видов: опыт Drosophila melanogaster» . ПЛОС ОДИН . 8 (1): e54130. Бибкод : 2013PLoSO...854130C . дои : 10.1371/journal.pone.0054130 . ПМЦ 3548849 . ПМИД 23349805 .
- ^ «ТДР | О нас» . Кто.int . Проверено 18 июля 2014 г.
- ^ «СПТБ | Новая система оценки генетически модифицированных комаров» . Кто.инт. 26 июня 2014 г. Проверено 18 июля 2014 г.
- ^ «EFSA – Руководство группы по ГМО: Руководящий документ по ERA ГМ-животных» . Журнал EFSA . 11 (5): 3200. 2013. doi : 10.2903/j.efsa.2013.3200 . hdl : 10044/1/40807 . Проверено 18 июля 2014 г.
- ^ Регаладо А. «Билл Гейтс удваивает свою ставку на уничтожение комаров с помощью редактирования генов» . Проверено 20 сентября 2016 г.
- ^ Неслен А (04.12.2017). «Военное агентство США инвестирует 100 миллионов долларов в технологии генетического вымирания» . Хранитель . ISSN 0261-3077 . Проверено 4 декабря 2017 г.
- ^ «Биологи создают новые генетические системы для нейтрализации генных драйвов» . физ.орг . Проверено 8 октября 2020 г.
- ^ Сюй, Сян-Ру Шеннон; Балджер, Эмили А.; Ганц, Валентино М.; Клансек, Карисса; Хеймлер, Стефани Р.; Аурадкар, Анкуш; Беннетт, Джаред Б.; Миллер, Лорен Эшли; Лихи, Сара; Жюсте, Сара Санс; Бухман, Анна; Акбари, Омар С.; Маршалл, Джон М.; Бир, Итан (18 сентября 2020 г.). «Активные генетические нейтрализующие элементы для остановки или удаления генных драйвов» . Молекулярная клетка . 80 (2): 246–262.e4. doi : 10.1016/j.molcel.2020.09.003 . ISSN 1097-2765 . ПМЦ 10962758 . ПМИД 32949493 . S2CID 221806864 .
- ^ Дхоле, Сумит; Ллойд, Алан Л.; Гулд, Фред (2 ноября 2020 г.). «Динамика генного драйва в естественных популяциях: важность зависимости от плотности, пространства и пола» . Ежегодный обзор экологии, эволюции и систематики . 51 (1). Годовые обзоры : 505–531. arXiv : 2005.01838 . doi : 10.1146/annurev-ecolsys-031120-101013 . ISSN 1543-592X . ПМЦ 8340601 . ПМИД 34366722 .
- ^ Пенниси Э (23 августа 2013 г.). «Увлечение CRISPR» . Наука . 341 (6148). Sciencemag.org: 833–6. Бибкод : 2013Sci...341..833P . дои : 10.1126/science.341.6148.833 . ПМИД 23970676 . Проверено 18 июля 2014 г.
- ^ Поллак А (11 мая 2015 г.). «Дженнифер Дудна, пионер, который помог упростить редактирование генома» . Нью-Йорк Таймс . Проверено 12 мая 2015 г.
- ^ Jump up to: а б ДиКарло Дж.Э., Чавес А., Дитц С.Л., Эсвелт К.М., Черч ГМ (2015). «Генные драйвы, управляемые РНК, могут эффективно и обратимо искажать наследование у диких дрожжей». биоRxiv 10.1101/013896 .
- ^ Ганц В.М., Бир Э. (апрель 2015 г.). «Редактирование генома. Мутагенная цепная реакция: метод преобразования гетерозиготных мутаций в гомозиготные» . Наука . 348 (6233): 442–4. дои : 10.1126/science.aaa5945 . ПМЦ 4687737 . ПМИД 25908821 .
- ^ Ганц В.М., Ясинскене Н., Татаренкова О., Фазекаш А., Масиас В.М., Бир Е., Джеймс А.А. (декабрь 2015 г.). «Высокоэффективный генный драйв, опосредованный Cas9, для модификации популяции комара-переносчика малярии Anopheles Stephensi» . Труды Национальной академии наук Соединенных Штатов Америки . 112 (49): E6736-43. Бибкод : 2015PNAS..112E6736G . дои : 10.1073/pnas.1521077112 . ПМК 4679060 . ПМИД 26598698 .
- ^ Jump up to: а б Хаммонд А., Гализи Р., Киру К., Симони А., Синискальчи С., Кацанос Д. и др. (январь 2016 г.). «Система генного драйва CRISPR-Cas9, направленная на воспроизводство самок у малярийных комаров-переносчиков Anopheles gambiae» . Природная биотехнология . 34 (1): 78–83. дои : 10.1038/nbt.3439 . ПМЦ 4913862 . ПМИД 26641531 .
- ^ Хаузер, Кристин (11 декабря 2022 г.). «Новая технология CRISPR позволяет уничтожить агрессивных мышей» . Свободомыслие . Проверено 14 декабря 2022 г.
- ^ ДиКарло Дж. Э., Чавес А., Дитц С. Л., Эсвелт К. М., генеральный директор Черча (декабрь 2015 г.). «Защита генных двигателей CRISPR-Cas9 у дрожжей» . Природная биотехнология . 33 (12): 1250–1255. дои : 10.1038/nbt.3412 . ПМЦ 4675690 . ПМИД 26571100 .
- ^ Бухталь, Джоанна; Эванс, Сэм Вайс; Лунсхоф, Жантина; Телфорд, Сэм Р.; Эсвелт, Кевин М. (13 мая 2019 г.). «Мыши против клещей: экспериментальная инициатива сообщества по предотвращению заболеваний, передающихся клещами, путем изменения окружающей среды» . Философские труды Королевского общества B: Биологические науки . 374 : 20180105.doi : (1772 ) 10.1098/rstb.2018.0105 . ПМК 6452264 . ПМИД 30905296 .
- ^ Кан Дж (2 июня 2016 г.). Редактирование генов теперь может изменить целый вид – навсегда . ТЕД.
- ^ Калмакофф Дж. (11 октября 2016 г.). «CRISPR для Новой Зеландии без вредителей» . Проверено 19 октября 2016 г.
- ^ «Информационный бюллетень GBIRd» (PDF) . 1 апреля 2018 года . Проверено 14 ноября 2018 г.
- ^ «Заявление о миссии и принципах» . 1 июля 2018 года . Проверено 14 ноября 2018 г.
- ^ « Генные драйвы могут уничтожить целые популяции вредителей одним махом» . РАЗГОВОР .
- ^ «Аргумент против генных стимулов к истреблению новозеландских млекопитающих: жизнь находит путь» . Плос блоги . 30 ноября 2017 г.
- ^ Кэмпбелл С. (17 октября 2016 г.). «Технологии генного драйва могут сопровождать риски» . Отаго Дейли Таймс . Проверено 19 октября 2016 г.
- ^ Стоктон Н. (27 июля 2016 г.). «Как Новая Зеландия планирует уничтожить своих (нечеловеческих) инвазивных млекопитающих» . ПРОВОДНОЙ .
- ^ Jump up to: а б «Predator Free NZ – вопросы и ответы экспертов» . Совок. 17 января 2017 года . Проверено 17 января 2017 г.
- ^ Регаладо А (10 февраля 2017 г.). «Первый генный драйв млекопитающих может помочь в обширном плане Новой Зеландии по искоренению вируса» . Технический обзор Массачусетского технологического института . Проверено 14 февраля 2017 г.
- ^ Виндинг М (01 августа 2018 г.). «Уменьшение крайних страданий животных, не являющихся людьми: улучшение или уменьшение будущих популяций?» . Между видами . 23 (1).
- ^ Эсвелт К (30 августа 2019 г.). «Когда мы обязаны редактировать диких существ?» . скачок маг . Проверено 3 мая 2020 г.
Дальнейшее чтение
[ редактировать ]- Эсвелт К.М., Джеммелл, штат Нью-Джерси (ноябрь 2017 г.). «Сохранение требует безопасного генного драйва» . ПЛОС Биология . 15 (11): e2003850. doi : 10.1371/journal.pbio.2003850 . ПМК 5689824 . ПМИД 29145398 .
- Ноубл С., Адлам Б., генеральный директор Чёрча, Эсвелт К.М., Новак М.А. (июнь 2018 г.). «Современные системы генного драйва CRISPR, вероятно, будут очень инвазивными в диких популяциях» . электронная жизнь . 7 : 219022. bioRxiv 10.1101/219022 . дои : 10.7554/eLife.33423.002 . ПМК 6014726 . ПМИД 29916367 . S2CID 196680955 .
- Де Чант Т. (17 июля 2014 г.). «Генная инженерия почти всего» . НОВА . Проверено 11 августа 2014 г.
- Джонсон С. (17 июля 2014 г.). «Ученые Гарварда хотят дебатов о генных манипуляциях» . Нэшнл Географик . Проверено 11 августа 2014 г.
- Лангин К. (17 июля 2014 г.). «Генная инженерия на помощь против инвазивных видов?» . Нэшнл Географик . Архивировано из оригинала 27 июля 2014 года . Проверено 11 августа 2014 г.
- Циммер С (17 июля 2014 г.). «Призыв бороться с малярией по одному комару путем изменения ДНК» . Нью-Йорк Таймс . Проверено 20 июля 2014 г.
- «Эпоха красного пера» . Экономист . 22 августа 2015. ISSN 0013-0613 . Проверено 25 августа 2015 г.
- «Самые эгоистичные гены» . Экономист . 22 августа 2015. ISSN 0013-0613 . Проверено 25 августа 2015 г.
- Эсвелт К. «Генные драйвы для изменения диких популяций» . Архивировано из оригинала 12 августа 2014 года . Проверено 11 августа 2014 г.