Секвенирование ДНК с помощью трансмиссионной электронной микроскопии
Секвенирование ДНК с помощью трансмиссионной электронной микроскопии одиночных молекул — это технология секвенирования , в которой используются трансмиссионной электронной микроскопии методы . Метод был задуман и разработан в 1960-70-х годах. [1] но потерял благосклонность, когда была признана степень повреждения образца. [2]
Чтобы ДНК можно было четко визуализировать под электронным микроскопом , ее необходимо пометить тяжелыми атомами. Кроме того, специализированные методы визуализации и оптика с коррекцией аберраций полезны для получения разрешения, необходимого для изображения меченой молекулы ДНК. Теоретически секвенирование ДНК с помощью трансмиссионной электронной микроскопии могло бы обеспечить чрезвычайно большую длину считывания, но проблема повреждения электронным лучом все еще может оставаться, и технология еще не получила коммерческого развития.
История
[ редактировать ]Всего через несколько лет после того, как Джеймс Уотсон и Фрэнсис Крик вывели структуру ДНК , и почти за два десятилетия до того, как Фредерик Сэнгер опубликовал первый метод быстрого секвенирования ДНК , Ричард Фейнман , американский физик, представил электронный микроскоп как инструмент, который однажды позволить биологам «увидеть порядок оснований в цепи ДНК ». [3] Фейнман считал, что если сделать электронный микроскоп достаточно мощным, то станет возможным визуализировать атомную структуру любых химических соединений, включая ДНК.
В 1970 году Альберт Крю под большим углом разработал метод визуализации в кольцевом темном поле (HAADF) в сканирующем просвечивающем электронном микроскопе . Используя эту технику, он визуализировал отдельные тяжелые атомы на тонких пленках аморфного углерода. [4] В 2010 году Криванек и его коллеги сообщили о нескольких технических улучшениях метода HAADF, включая комбинацию электронной оптики с коррекцией аберраций и низкого ускоряющего напряжения. Последнее имеет решающее значение для визуализации биологических объектов, поскольку позволяет уменьшить повреждения лучом и повысить контрастность изображения для легких атомов. В результате удалось визуализировать одноатомные замещения в монослое нитрида бора. [5]
Несмотря на изобретение множества технологий химического и флуоресцентного секвенирования, электронная микроскопия все еще исследуется как средство выполнения секвенирования одиночных молекул ДНК. Например, в 2012 году сотрудничество ученых из Гарвардского университета , Университета Нью-Гэмпшира и ZS Genetics продемонстрировало способность читать длинные последовательности ДНК с помощью этого метода. [6] однако технология секвенирования ДНК с помощью трансмиссионной электронной микроскопии все еще далека от коммерчески доступной. [7]
Принцип
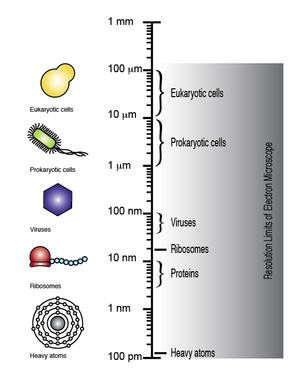
[ редактировать ]Электронный микроскоп способен обеспечить разрешение до 100 мкм, благодаря чему можно наблюдать микроскопические биомолекулы и структуры, такие как вирусы, рибосомы, белки, липиды, небольшие молекулы и даже отдельные атомы. [8]
Хотя ДНК видна при наблюдении в электронный микроскоп, разрешение полученного изображения недостаточно велико, чтобы можно было расшифровать последовательность отдельных оснований , то есть секвенировать ДНК . Однако при дифференциальном мечении оснований ДНК тяжелыми атомами или металлами можно как визуализировать, так и различать отдельные основания. Следовательно, электронная микроскопия в сочетании с дифференциальным мечением ДНК тяжелыми атомами может использоваться для прямого изображения ДНК и определения ее последовательности. [7] [9] [10] [11]
Рабочий процесс
[ редактировать ]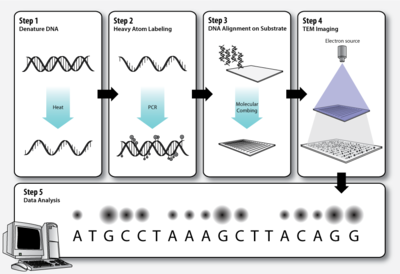
Шаг 1 – Денатурация ДНК
[ редактировать ]Как и в стандартной полимеразной цепной реакции (ПЦР) , молекулы двухцепочечной ДНК, подлежащие секвенированию, должны быть денатурированы , прежде чем вторая цепь сможет быть синтезирована с мечеными нуклеотидами.
Шаг 2 – Маркировка тяжелых атомов
[ редактировать ]Элементы, из которых состоят биологические молекулы ( C , H , N , O , P , S ), слишком легкие (низкий атомный номер Z ), чтобы их можно было четко визуализировать как отдельные атомы с помощью просвечивающей электронной микроскопии . ДНК Чтобы обойти эту проблему, основания можно пометить более тяжелыми атомами (с более высоким Z). Каждый нуклеотид помечен характерной тяжелой меткой, чтобы их можно было различить на трансмиссионной электронной микрофотографии.
- ZS Genetics предлагает использовать три тяжелые метки: бром (Z=35), йод (Z=53) и трихлорметан (общее Z=63). На микрофотографии они будут выглядеть как дифференциальные темные и светлые пятна, а четвертое основание ДНК останется немеченным.
- Halcyon Molecular в сотрудничестве с группой Toste предполагает, что пуриновые и пиримидиновые основания могут быть функционализированы диамином платины или бипиридином тетраоксида осмия соответственно. Атомы тяжелых металлов, таких как осмий (Z=76), иридий (Z=77), золото (Z=79) или уран (Z=92), затем могут образовывать связи металл-металл с этими функциональными группами, чтобы маркировать отдельные основания. [12]
Шаг 3 – Выравнивание ДНК на подложке
[ редактировать ]Молекулы ДНК необходимо растянуть на тонкой твердой подложке так, чтобы порядок расположения меченых оснований был четко виден на электронной микрофотографии. Молекулярное расчесывание — это метод, который использует силу удаляющейся границы раздела воздух-вода для удлинения молекул ДНК, оставляя их необратимо связанными с силановым слоем после высыхания. [13] [14] Это один из способов достижения выравнивания ДНК на твердой подложке.
Шаг 4 – ПЭМ-изображение
[ редактировать ]
Просвечивающая электронная микроскопия (ПЭМ) позволяет получать изображения с большим увеличением и высоким разрешением , пропуская луч электронов через очень тонкий образец. В то время как атомное разрешение было продемонстрировано с помощью обычной ПЭМ, дальнейшее улучшение пространственного разрешения требует коррекции сферических микроскопа и хроматических аберраций линз . Это стало возможным только в сканирующей просвечивающей электронной микроскопии , где изображение получается путем сканирования объекта тонко сфокусированным электронным лучом, аналогично электронно-лучевой трубке . Однако достигнутое улучшение разрешения сопровождается облучением исследуемого объекта пучком гораздо более высокой интенсивности, сопутствующим повреждением образца и соответствующими артефактами изображения. [15] В зависимости от того, содержит ли образец тяжелые или легкие атомы, применяются различные методы визуализации:
- Кольцевая визуализация в темном поле измеряет рассеяние электронов, когда они отклоняются от ядер атомов в образце, полученном для просвечивающей электронной микроскопии. [5] Это лучше всего подходит для образцов, содержащих тяжелые атомы, поскольку они вызывают большее рассеяние электронов. Эта техника использовалась для получения изображений таких легких атомов, как бор , азот и углерод ; [5] однако для таких легких атомов сигнал очень слаб. Если кольцевую темнопольную микроскопию использовать для секвенирования ДНК с помощью трансмиссионной электронной микроскопии, то, безусловно, необходимо будет пометить основания ДНК тяжелыми атомами, чтобы можно было обнаружить сильный сигнал.
- Кольцевая визуализация в светлом поле обнаруживает электроны, прошедшие непосредственно через образец, и измеряет интерференцию волн, возникающую в результате их взаимодействия с атомными ядрами. Этот метод может обнаруживать легкие атомы с большей чувствительностью, чем методы кольцевой визуализации в темном поле. На самом деле кислород , [16] азот , [16] литий , [17] и водород [18] в кристаллических твердых телах были получены с помощью кольцевой электронной микроскопии в светлом поле. Таким образом, теоретически возможно получить прямые изображения атомов цепи ДНК; однако структура ДНК гораздо менее геометрическая, чем у кристаллических твердых тел, поэтому прямая визуализация без предварительной маркировки может быть невозможна.
Шаг 5 – Анализ данных
[ редактировать ]Темные и светлые пятна на электронной микрофотографии, соответствующие дифференциально меченным основаниям ДНК, анализируются с помощью компьютерного программного обеспечения.
Приложения
[ редактировать ]Секвенирование ДНК с помощью трансмиссионной электронной микроскопии пока коммерчески недоступно, но большая длина считывания, которую однажды может обеспечить эта технология, сделает ее полезной в различных контекстах.
Опять сборка генома
[ редактировать ]При секвенировании генома его необходимо разбить на фрагменты, достаточно короткие, чтобы их можно было секвенировать за одно чтение. Затем эти чтения необходимо снова собрать вместе, как мозаику, выравнивая области, которые перекрываются между чтениями; этот процесс называется de novo сборкой генома . Чем больше длина считывания, которую обеспечивает платформа секвенирования, тем длиннее перекрывающиеся области и тем легче собрать геном. С вычислительной точки зрения микрофлюидное секвенирование по Сэнгеру по -прежнему остается наиболее эффективным способом секвенирования и сборки геномов, для которых не существует эталонной последовательности генома. Относительно большая длина считываний обеспечивает существенное перекрытие между отдельными считываниями секвенирования, что обеспечивает большую статистическую достоверность сборки. Кроме того, длинные чтения по Сэнгеру способны охватывать большинство областей повторяющейся последовательности ДНК , что в противном случае затрудняет сборку последовательности, вызывая ложное выравнивание. Однако сборка генома de novo с помощью секвенирования по Сэнгеру чрезвычайно дорога и требует много времени. Технологии секвенирования второго поколения , [19] хотя они и менее дороги, они, как правило, непригодны для сборки генома de novo из-за короткой длины чтения. В целом, технологии секвенирования третьего поколения, [11] включая секвенирование ДНК с помощью трансмиссионной электронной микроскопии, направлены на увеличение длины считывания при сохранении низкой стоимости секвенирования. Таким образом, по мере совершенствования технологий секвенирования третьего поколения быстрая и недорогая сборка генома de novo станет реальностью.
Полные гаплотипы
[ редактировать ]Гаплотип — это серия связанных аллелей , которые наследуются вместе на одной хромосоме. Секвенирование ДНК можно использовать для генотипирования всех однонуклеотидных полиморфизмов (SNP), составляющих гаплотип. Однако короткие чтения секвенирования ДНК часто не могут быть поэтапными; то есть гетерозиготные варианты не могут быть уверенно отнесены к правильному гаплотипу. Фактически, гаплотипирование с использованием данных секвенирования ДНК с коротким считыванием требует очень высокого покрытия (в среднем более 50-кратного покрытия каждого основания ДНК) для точной идентификации SNP, а также дополнительных данных о последовательностях от родителей, чтобы можно было использовать менделевскую передачу для оценки гаплотипов. [20] Технологии секвенирования, которые генерируют длинные чтения, включая секвенирование ДНК с помощью трансмиссионной электронной микроскопии, могут захватывать целые гаплоблоки за одно чтение. То есть гаплотипы не разбиваются на несколько прочтений, а генетически связанные аллели остаются вместе в данных секвенирования. Таким образом, длинные чтения делают гаплотипирование проще и точнее, что полезно для области популяционной генетики .
Копировать варианты номера
[ редактировать ]геноме человека гены обычно присутствуют в двух копиях В диплоидном ; Гены, которые отклоняются от этого стандартного числа копий, называются вариантами числа копий (CNV) . Вариации числа копий могут быть доброкачественными (обычно это распространенные варианты, называемые полиморфизмами числа копий) или патогенными. [21] CNV выявляются с помощью флуоресцентной гибридизации in situ (FISH) или сравнительной геномной гибридизации (CGH) . Чтобы обнаружить конкретные точки останова, в которых происходит делеция, или обнаружить геномные повреждения, вызванные событием дупликации или амплификации, CGH можно выполнить с использованием массива мозаики ( массив CGH ), или можно секвенировать вариантную область. Считывания длинного секвенирования особенно полезны для анализа дупликаций или амплификаций, поскольку можно проанализировать ориентацию амплифицированных сегментов, если они зафиксированы в одном считывании секвенирования.
Рак
[ редактировать ]Геномика рака, или онкогеномика , — это новая область, в которой высокопроизводительная технология секвенирования ДНК второго поколения применяется для секвенирования целых раковых геномов. Анализ этих данных секвенирования короткого считывания охватывает все проблемы, связанные со сборкой генома de novo с использованием данных короткого считывания. [22] Кроме того, геномы рака часто анеуплоидны . [23] Эти аберрации, которые по сути представляют собой крупномасштабные варианты количества копий, могут быть проанализированы с помощью технологий секвенирования второго поколения, использующих частоту считывания для оценки количества копий. [22] Однако более длинные чтения дадут более точную картину количества копий, ориентации амплифицированных областей и SNP, присутствующих в раковых геномах.
Секвенирование микробиома
[ редактировать ]понимается Под микробиомом общая совокупность микробов, присутствующих в микросреде, и их соответствующие геномы. Например, примерно 100 триллионов микробных клеток колонизируют организм человека в любой момент времени. [24] Микробиом человека представляет особый интерес, поскольку эти комменсальные бактерии важны для здоровья и иммунитета человека. Большинство бактериальных геномов Земли еще не секвенированы; реализация проекта секвенирования микробиома потребует обширной сборки генома de novo , а эта перспектива пугает с учетом технологий секвенирования ДНК с коротким считыванием. [25] Более длинные чтения значительно облегчили бы сборку новых микробных геномов.
Сильные и слабые стороны
[ редактировать ]По сравнению с другими технологиями секвенирования ДНК второго и третьего поколения, секвенирование ДНК с помощью трансмиссионной электронной микроскопии имеет ряд потенциальных ключевых сильных и слабых сторон, которые в конечном итоге определят его полезность и известность в качестве будущей технологии секвенирования ДНК.
Сильные стороны
[ редактировать ]- Более длинные длины чтения : ZS Genetics оценила потенциальную длину чтения секвенирования ДНК с помощью трансмиссионной электронной микроскопии в 10 000–20 000 пар оснований со скоростью 1,7 миллиарда пар оснований в день. [7] Такая большая длина чтения позволит упростить сборку генома de novo и прямое обнаружение гаплотипов, среди других приложений. [11]
- Более низкая стоимость : секвенирование ДНК с помощью трансмиссионной электронной микроскопии оценивается всего в 5000–10 000 долларов США за геном человека по сравнению с более дорогими альтернативами секвенирования ДНК второго поколения. [10]
- Отсутствие дефазировки . Дефазировка цепей ДНК из-за потери синхронности во время синтеза является серьезной проблемой технологий секвенирования второго поколения. Для секвенирования ДНК с помощью трансмиссионной электронной микроскопии и некоторых других технологий секвенирования третьего поколения синхронизация считываний не требуется, поскольку одновременно считывается только одна молекула. [7] [11]
- Сокращение времени обработки : возможность считывания нативных фрагментов ДНК делает сложную подготовку матрицы ненужным шагом в общем рабочем процессе секвенирования всего генома. Следовательно, возможны более короткие сроки выполнения работ. [11]
Слабые стороны
[ редактировать ]- Высокие капитальные затраты : трансмиссионный электронный микроскоп с достаточным разрешением, необходимым для секвенирования ДНК с помощью трансмиссионной электронной микроскопии, стоит примерно 1 000 000 долларов США, поэтому проведение секвенирования ДНК этим методом требует значительных инвестиций. [10]
- Технически сложная задача : селективное мечение тяжелыми атомами, а также прикрепление и выпрямление меченой ДНК к субстрату представляют собой серьезную техническую задачу. [10] Кроме того, образец ДНК должен быть устойчив к высокому вакууму электронного микроскопа и облучению сфокусированным пучком электронов высокой энергии.
- Потенциальная ПЦР систематическая ошибка и артефакты . Хотя ПЦР используется только в секвенировании ДНК с помощью трансмиссионной электронной микроскопии как средство маркировки цепи ДНК тяжелыми атомами или металлами, может существовать возможность внесения систематической ошибки в представление матрицы или ошибок во время однократной амплификации. [10]
Сравнение с другими технологиями секвенирования
[ редактировать ]Многие технологии секвенирования ДНК второго и третьего поколения, не принадлежащие Сэнгеру, были или в настоящее время разрабатываются с общей целью увеличения производительности и снижения затрат, чтобы можно было полностью реализовать персонализированную генетическую медицину.
в области геномики в размере 10 миллионов долларов США, Премия Archon X поддержанная Фондом X Prize (Санта-Моника, Калифорния, США), и грант в размере 70 миллионов долларов США, поддержанный Национальным институтом исследования генома человека Национальных институтов здравоохранения (NIH-NHGRI). ) способствуют быстрому всплеску исследовательской деятельности в области разработки новых технологий секвенирования ДНК. [7]
Поскольку каждую технологию секвенирования ДНК определяют разные подходы, методы и стратегии, каждая из них имеет свои сильные и слабые стороны. Сравнение важных параметров различных технологий секвенирования ДНК второго и третьего поколения представлено в таблице 1.
| Платформа | Поколение | Длина чтения (bp) | Точность | Стоимость генома человека (долл. США) | Стоимость инструмента (долл. США) | Время выполнения (ч/Гбит/с) [7] |
|---|---|---|---|---|---|---|
| Массивно-параллельное пиросеквенирование путем синтеза | Второй | 400–500 | Длина чтения Q20 40 оснований (99% при 400 основаниях и выше для предыдущих оснований) | 1,000,000 | 500,000 | 75 |
| Секвенирование путем синтеза | Второй | 2×75 | Базовый вызов с Q30 (>70%) | 60,000 | 450,000 | 56 |
| Секвенирование на основе массивного параллельного клонального лигирования | Второй | 100 | 99.94% | 60,000 | 591,000 | 42 |
| Массивно-параллельное секвенирование одиночных молекул путем синтеза | Третий | 30–35 | 99,995% при покрытии >20× (исходная частота ошибок: ≤ 5%) | 70,000 | 1,350,000 | ~12 |
| Секвенирование одной молекулы в реальном времени путем синтеза | Третий | 1000–1500 | 99,3% при 15-кратном покрытии (коэффициент ошибок одного чтения: 15–20%) | – | – | <1 |
| Нанопоровое секвенирование | Третий | Потенциально неограниченно? | -- | -- | -- | >20 |
| Секвенирование одиночных молекул с помощью трансмиссионной электронной микроскопии (ZS Genetics, Halcyon Molecular) | Третий | Потенциально неограниченно? | -- | ~10,000 | ~1,000,000 | ~14 |
Ссылки
[ редактировать ]- ^ [Майкл Бир и Ричард Зобель (1961) «Электронные пятна II: Электронно-микроскопические исследования видимости окрашенных молекул ДНК» J. Mol. Биол. Том 3, выпуск 6, декабрь 1961 г., страницы 717–726, IN3–IN5"]
- ^ [М. Коул и др. (1977) «Молекулярная микроскопия меченых полинуклеотидов: стабильность атомов осмия» J. Mol. Биол. Том 117, выпуск 2, 5 декабря 1977 г., страницы 387–400]
- ^ Фейнман Р. (1959) Внизу достаточно места . Лекция в Калифорнийском технологическом институте.
- ^ Крю, Альберт V; Уолл, Дж.; Лэнгмор, Дж. (1970). «Видимость одного атома». Наука . 168 (3937): 1338–1340. Бибкод : 1970Sci...168.1338C . дои : 10.1126/science.168.3937.1338 . ПМИД 17731040 . S2CID 31952480 .
- ^ Jump up to: а б с Криванек О.Л.; Чисхолм, Мэтью Ф.; Николози, Валерия ; Пенникук, Тимоти Дж.; Корбин, Джордж Дж.; Деллби, Никлас; Мерфитт, Мэтью Ф.; Собственный, Кристофер С.; Силадьи, Золтан С.; Оксли, Марк П.; Пантелидес, Сократ Т.; Пенникук, Стивен Дж.; и др. (2010). «Поатомный структурный и химический анализ методом кольцевой темнопольной электронной микроскопии» . Природа . 464 (7288): 571–4. Бибкод : 2010Natur.464..571K . дои : 10.1038/nature08879 . ПМИД 20336141 . S2CID 1331554 .
- ^ Белл Д., Томас В., Мурта К., Дионн С., Грэм А., Андерсон Дж., Гловер В. (2012). «Идентификация оснований ДНК методом электронной микроскопии». Микроскопия и микроанализ . 18 (5): 1049–1053. Бибкод : 2012MiMic..18.1049B . дои : 10.1017/S1431927612012615 . ПМИД 23046798 . S2CID 25713635 .
- ^ Jump up to: а б с д и ж Гупта ПК (2008). «Технологии секвенирования одномолекулярной ДНК для будущих исследований в области геномики». Тенденции в биотехнологии . 26 (11): 602–11. дои : 10.1016/j.tibtech.2008.07.003 . ПМИД 18722683 .
- ^ Кэмпбелл Н.А. и Рис Дж.Б. (2002) Биология (6-е изд.). Сан-Франциско: Бенджамин Каммингс. ISBN 0-8053-6624-5
- ^ Дорогой ПХ (2003). «Один за другим: одномолекулярные инструменты для геномики» . Брифинги по функциональной геномике и протеомике . 1 (4): 397–416. дои : 10.1093/bfgp/1.4.397 . ПМИД 15239886 .
- ^ Jump up to: а б с д и ж Сюй, М; Фудзита, Дайсуке; Ханагата, Нобутака; и др. (2009). «Перспективы и проблемы новых технологий секвенирования одномолекулярной ДНК». Маленький . 5 (23): 2638–49. дои : 10.1002/smll.200900976 . ПМИД 19904762 .
- ^ Jump up to: а б с д и Шадт Э.Э.; Тернер, С.; Касарскис А.; и др. (2010). «Окно в секвенирование третьего поколения» . Молекулярная генетика человека . 19 (Р2): Р227-40. дои : 10.1093/hmg/ddq416 . ПМИД 20858600 .
- ^ Награды за передовые технологии секвенирования 2010 . Genome.gov. Проверено 25 февраля 2011 г.
- ^ Бенсимон А; Саймон, А; Шиффодель, А; Крокет, В; Хесло, Ф; Бенсимон, Д; и др. (1994). «Выравнивание и чувствительное обнаружение ДНК с помощью движущегося интерфейса». Наука . 265 (5181): 2096–8. Бибкод : 1994Sci...265.2096B . дои : 10.1126/science.7522347 . ПМИД 7522347 .
- ^ Мишале X и др. (1997). «Динамическое молекулярное расчесывание: расширение всего генома человека для исследований с высоким разрешением». Наука . 277 (5331): 1518–23. дои : 10.1126/science.277.5331.1518 . ПМИД 9278517 . S2CID 22699914 .
- ^ Хайдер М; Улеманн, Стефан; Шван, Ойген; Роуз, Харальд; Кабиус, Бернд; Урбан, Кнут; и др. (1998). «Улучшение изображения электронной микроскопии». Природа . 392 (6678): 768. Бибкод : 1998Natur.392..768H . дои : 10.1038/33823 . S2CID 205002987 .
- ^ Jump up to: а б Окуниси Э; Исикава, И; Савада, Х; Хосокава, Ф; Хори, М; Кондо, Ю; и др. (2009). «Визуализация легких элементов со сверхвысоким разрешением с помощью кольцевой микроскопии светлого поля STEM». Микроскопия и микроанализ . 15 (С2): 164–165. Бибкод : 2009MiMic..15S.164O . дои : 10.1017/S1431927609093891 .
- ^ Осима Ю; Савада, Х.; Хосокава, Ф.; Окуниси, Э.; Канеяма, Т.; Кондо, Ю.; Ниитка, С.; Такаги, Х.; Танисиро, Ю.; Такаянаги, К.; и др. (2010). «Прямое изображение атомов лития в LiV 2 O 4 методом электронной микроскопии со сферической аберрацией» . Журнал электронной микроскопии . 59 (6): 457–61. doi : 10.1093/jmicro/dfq017 . ПМИД 20406731 .
- ^ Исикава Р; Окуниси, Эйдзи; Савада, Хидетака; Кондо, Юкихито; Хосокава, Фумио; Абэ, Эйдзи; и др. (2011). «Прямое изображение столбцов атомов водорода в кристалле с помощью кольцевой электронной микроскопии в светлом поле». Природные материалы . 10 (4): 278–281. Бибкод : 2011NatMa..10..278I . дои : 10.1038/nmat2957 . ПМИД 21317899 .
- ^ Шендуре Дж., Джи Х (2008). «Секвенирование ДНК нового поколения». Природная биотехнология . 26 (10): 1135–45. дои : 10.1038/nbt1486 . ПМИД 18846087 . S2CID 6384349 .
- ^ Дурбин, Ричард М.; Альтшулер, Дэвид Л.; Дурбин, Ричард М.; Абекасис, Гонсалу Р.; Бентли, Дэвид Р.; Чакраварти, Аравинда; Кларк, Эндрю Г.; Коллинз, Фрэнсис С.; и др. (2010). «Карта вариаций генома человека по результатам популяционного секвенирования» . Природа . 467 (7319): 1061–73. Бибкод : 2010Natur.467.1061T . дои : 10.1038/nature09534 . ПМК 3042601 . ПМИД 20981092 .
- ^ Родруигес-Ревенга Л.; Мила, Монтсеррат; Розенберг, Карла; Лэмб, Аллен; Ли, Чарльз; и др. (2007). «Структурные вариации генома человека: влияние вариантов числа копий на клинический диагноз». Генетика в медицине . 9 (9): 600–6. дои : 10.1097/GIM.0b013e318149e1e3 . ПМИД 17873648 .
- ^ Jump up to: а б Такер Т; Марра, Марко; Фридман, Ян М.; и др. (2009). «Массовое параллельное секвенирование: следующий большой шаг в генетической медицине» . Американский журнал генетики человека . 85 (2): 142–54. дои : 10.1016/j.ajhg.2009.06.022 . ПМЦ 2725244 . ПМИД 19679224 .
- ^ Торрес Э.М.; Уильямс, БР; Амон, А.; и др. (2008). «Анеуплоидия: клетки теряют баланс» . Генетика . 179 (2): 737–46. дои : 10.1534/genetics.108.090878 . ПМК 2429870 . ПМИД 18558649 .
- ^ Сэвидж, округ Колумбия (1977). «Микробная экология желудочно-кишечного тракта». Ежегодный обзор микробиологии . 31 : 107–33. дои : 10.1146/annurev.mi.31.100177.000543 . ПМИД 334036 .
- ^ Хамади М., Найт Р. (2009). «Профилирование микробного сообщества для проектов микробиома человека: инструменты, методы и проблемы» . Геномные исследования . 19 (7): 1141–52. дои : 10.1101/гр.085464.108 . ПМЦ 3776646 . ПМИД 19383763 .