Правила приоритета Кана – Ингольда – Прелога
Эта статья нуждается в дополнительных цитатах для проверки . ( февраль 2016 г. ) |
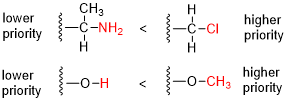
В органической химии Кана -Ингольда-Прелога ( CIP ) правила последовательности (также соглашение о приоритете CIP ; названо в честь Роберта Сидни Кана , Кристофера Келка Ингольда и Владимира Прелога ) являются стандартным процессом для полного и однозначного названия стереоизомера . молекулы . [1] [2] : 26 Целью системы CIP является присвоение R или S дескриптора каждому стереоцентру и E или Z дескриптора каждой двойной связи , чтобы конфигурацию всей молекулы можно было однозначно указать путем включения дескрипторов в ее систематическое название. Молекула может содержать любое количество стереоцентров и любое количество двойных связей, и каждая из них обычно дает два возможных изомера. Молекула с целым числом n, описывающим количество стереоцентров, обычно будет иметь 2 н стереоизомеры и 2 п -1 диастереомеры, каждый из которых имеет связанную пару энантиомеров . [3] [4] Правила последовательности CIP способствуют точному названию каждого стереоизомера каждой органической молекулы со всеми атомами лигирования менее 4 (но включая также лигацию 6, этот термин относится к «числу соседних атомов», связанных с центром). . [2] : 26f [4]
Основная статья, устанавливающая правила последовательности CIP, была опубликована в 1966 году. [5] и последовали дальнейшие усовершенствования, [6] до того, как он был включен в правила Международного союза теоретической и прикладной химии (IUPAC), официального органа, определяющего органическую номенклатуру , в 1974 году. [2] : 26 и далее С тех пор правила были пересмотрены, последний раз в 2013 году. [7] в составе книги ИЮПАК « Номенклатура органической химии» . Представление правил ИЮПАК представляет собой официальный формальный стандарт для их использования, и в нем отмечается, что «метод был разработан для охвата всех соединений с лигностью до 4… и… [распространен на случай] лигности 6… [а также] для всех конфигураций и конформаций таких соединений». [2] : 26 и далее Тем не менее, хотя документация ИЮПАК представляет собой подробное введение, она содержит предупреждение о том, что «необходимо изучить оригинальные статьи, особенно статью 1966 года, прежде чем использовать правило последовательности для других, кроме довольно простых случаев». [2] : 26f
В недавней статье приводятся доводы в пользу внесения изменений в некоторые правила (правила последовательности 1b и 2) для обращения к определенным молекулам, для которых правильные дескрипторы были неясны. [8] Однако остается другая проблема: в редких случаях два разных стереоизомера одной и той же молекулы могут иметь одинаковые дескрипторы CIP, поэтому система CIP может не иметь возможности однозначно назвать стереоизомер, и другие системы могут оказаться предпочтительными. [9] : 27
Шаги по присвоению имени
[ редактировать ]Этапы присвоения названий молекул с использованием системы CIP часто представляются следующим образом:
- Идентификация стереоцентров и двойных связей ;
- Назначение приоритетов группам, прикрепленным к каждому стереоцентру или атому с двойной связью; и
- Назначение дескрипторов R / S и E / Z .
Расстановка приоритетов
[ редактировать ]Дескрипторы R / S и E / Z назначаются с использованием системы ранжирования приоритета групп, прикрепленных к каждому стереоцентру. Эта процедура, часто известная как правила последовательности , является сердцем системы CIP. В обзоре этого раздела опущены некоторые правила, которые необходимы только в редких случаях.
- Сравните атомные номера ( Z ) атомов, непосредственно присоединенных к стереоцентру; группа, имеющая атом с более высоким атомным номером Z, получает более высокий приоритет (т.е. номер 1).
- Если есть связь, необходимо учитывать атомы, находящиеся на расстоянии 2 от стереоцентра: составляется список для каждой группы дальнейших атомов, связанных с атомом, непосредственно прикрепленным к стереоцентру. Каждый список располагается в порядке убывания атомного номера Z. Затем списки сравниваются атом за атомом; при самой ранней разнице группа, содержащая атом с более высоким атомным номером Z, получает более высокий приоритет.
- Если связь все еще существует, каждый атом в каждом из двух списков заменяется подсписком других атомов, связанных с ним (на расстоянии 3 от стереоцентра), подсписки располагаются в порядке убывания атомного номера Z, и вся структура снова сравнивается атом за атомом. Этот процесс повторяется рекурсивно, каждый раз с атомами на одну связь дальше от стереоцентра, пока связь не разорвется.
изотопы
[ редактировать ]Если две группы отличаются только изотопами большая атомная масса . , то для установления приоритета используется [10]
Двойные и тройные связи
[ редактировать ]
Если атом A имеет двойную связь с другим атомом, то атом A следует рассматривать так, как будто он «дважды соединен с одним и тем же атомом». [11] Атом с двойной связью имеет более высокий приоритет, чем атом с одинарной связью. [11] Имея дело с приоритетными группами с двойными связями, можно дважды посетить один и тот же атом, создавая дугу. [12]
Когда B заменяется списком присоединенных атомов, сам A, но не его «фантом», исключается в соответствии с общим принципом неповторения обратного хода по только что пройденной связи. Тройная связь обрабатывается таким же образом, за исключением того, что каждый из A и B соединен с двумя фантомными атомами другого. [2] : 28
Геометрические изомеры
[ редактировать ]Если два заместителя в атоме являются геометрическими изомерами друг друга, Z -изомер имеет более высокий приоритет, чем E -изомер. Стереоизомер, который содержит две группы с более высоким приоритетом на одной стороне двойной связи ( цис ), классифицируется как «Z». Стереоизомер с двумя более приоритетными группами на противоположных сторонах двойной связи углерод-углерод ( транс ) классифицируется как «Е». [13]
Циклические молекулы
[ редактировать ]Чтобы справиться с молекулой, содержащей один или несколько циклов , необходимо сначала разложить ее в дерево (называемое иерархическим орграфом ), пересекая связи по всем возможным путям, начиная со стереоцентра. Когда при обходе встречается атом, через который уже прошел текущий путь, генерируется фантомный атом, чтобы сохранить конечность дерева. Один атом исходной молекулы может появляться во многих местах дерева (некоторые в виде фантомов, некоторые нет). [14] : 572
Назначение дескрипторов
[ редактировать ]Стереоцентры: R / S
[ редактировать ]
Хиральный sp 3 гибридизованный изомер содержит четыре разных заместителя. Всем четырем заместителям присвоены прориты в зависимости от их атомных номеров. После того как заместителям стереоцентра . присвоены приоритеты, молекула ориентируется в пространстве так, чтобы группа с наименьшим приоритетом была направлена в сторону от наблюдателя Если заместители пронумерованы от 1 (высший приоритет) до 4 (низший приоритет), то направление вращения кривой, проходящей через 1, 2 и 3, отличает стереоизомеры . В конфигурационном изомере группа с самым низким приоритетом (чаще всего водородная) расположена за плоскостью или заштрихованной связью, идущей от считывателя. Группа с наивысшим приоритетом будет отмечена дугой, соединяющей остальные группы и заканчивающейся в группе третьего приоритета. Дуга, нарисованная по часовой стрелке, имеет назначение прямой мышцы ( R ). Дуга, нарисованная против часовой стрелки, имеет зловещее назначение ( S ). Названия происходят от латинского слова «правый» и «левый» соответственно. [15] [16] При названии органического изомера перед именем в круглых скобках ставится сокращение, обозначающее прямую мышцу или зловещее присвоение. Например, 3-метил-1-пентен с прямым отнесением имеет формат ( R )-3-метил-1-пентен. [12]

Практический метод определения того, является ли энантиомер R или S, заключается в использовании правила правой руки : молекулу оборачивают пальцами в направлении 1 → 2 → 3 . Если большой палец указывает в сторону четвертого заместителя, энантиомер представляет собой R ; это S. в противном случае
В редких случаях возможно, что два заместителя в атоме различаются только своей абсолютной конфигурацией ( R или S ). Если необходимо установить относительные приоритеты этих заместителей, имеет приоритет над S. R Когда это происходит, дескриптор стереоцентра представляет собой строчную букву ( r или s ) вместо обычно используемой прописной буквы. [17]
Двойные связи: E / Z
[ редактировать ]Для молекул с двойной связью соблюдаются правила приоритета Кана – Ингольда – Прелога (правила CIP) для определения приоритета заместителей двойной связи. Если обе группы с высоким приоритетом находятся по одну сторону двойной связи ( цис -конфигурация ), то стереоизомеру присваивается конфигурация Z ( zusammen, немецкое слово, означающее «вместе»). Если группы с высоким приоритетом находятся на противоположных сторонах двойной связи ( транс -конфигурация ), то стереоизомеру присваивается конфигурация E ( entgegen , немецкое слово, означающее «противоположный»). [18]
Координационные соединения
[ редактировать ]В некоторых случаях, когда образуются стереогенные центры, необходимо уточнить конфигурацию. Без присутствия нековалентного взаимодействия соединение является ахиральным . Некоторые специалисты предложили новое правило, объясняющее это. Это правило гласит, что «нековалентные взаимодействия имеют фиктивное число от 0 до 1» при назначении приоритета. [19] Соединения, в которых это происходит, называются координационными соединениями .
Спиросоединения
[ редактировать ]Спиро-структуры содержат хиральные молекулы без асимметричного центра. Кольца спироструктуры лежат под прямым углом друг к другу. Важно отметить, что зеркальные изображения спироструктур не накладываются друг на друга и являются энантиомерами. [12]
Примеры
[ редактировать ]Ниже приведены примеры применения номенклатуры. [20]
Задания R / S для нескольких соединений 
Гипотетическая молекула бромхлорфториодметана, показанная в ее ( R )-конфигурации, могла бы быть очень простым хиральным соединением. Приоритеты распределяются по атомному номеру ( Z ): йод ( Z = 53) > бром ( Z = 35) > хлор ( Z = 17) > фтор ( Z = 9). Разрешение фтору (самый низкий приоритет, номер 4) направлять от зрителя, вращение происходит по часовой стрелке, отсюда и R. назначение 
При присвоении L -серина наивысший приоритет (т.е. номер 1) отдается атому азота ( Z =7) в аминогруппе (NH 2 ). И гидроксиметильная группа (СН 2 ОН), и группа карбоновой кислоты (СООН) имеют атомы углерода ( Z = 6), но приоритет отдается последнему, поскольку атом углерода в группе СООН соединен со вторым кислородом ( Z = 8) . ), тогда как в группе CH 2 OH углерод связан с атомом водорода ( Z = 1). Наименьший приоритет (т.е. номер 4) отдается атому водорода, и поскольку этот атом направлен в сторону от зрителя, уменьшение приоритета против часовой стрелки по сравнению с тремя оставшимися заместителями завершает присвоение как S . 
Стереоцентр в ( S )-карвоне связан с одним атомом водорода (не показан, приоритет 4) и тремя атомами углерода. Изопропенильная группа имеет приоритет 1 (только атомы углерода), а для двух оставшихся атомов углерода приоритет определяется тем, что атомы углерода имеют две связи, удаленные от стереоцентра, одну часть кетогруппы ( O, O, C, номер приоритета 2). ) и одну часть алкена (C, C, H, номер приоритета 3). Результирующее вращение против часовой стрелки приводит к S .
Описание нескольких центров
[ редактировать ]Если соединение имеет более одного хирального стереоцентра, каждый центр обозначается либо , либо S. R Например, эфедрин существует в виде стереоизомеров (1R , 2S ) и ( 1S ,2R ) , которые представляют собой отдельные зеркальные формы друг друга, что делает их энантиомерами . Это соединение также существует в виде двух энантиомеров (1R , 2R ) и ( 1S ,2S ) , которые называются псевдоэфедрином, а не эфедрином. Все четыре из этих изомеров в систематической номенклатуре называются 2-метиламино-1-фенил-1-пропанолом. Однако эфедрин и псевдоэфедрин являются диастереомерами или стереоизомерами, которые не являются энантиомерами, поскольку не связаны зеркальными копиями. Псевдоэфедрин и эфедрин получили разные названия, поскольку, будучи диастереомерами, они имеют разные химические свойства, даже для рацемических смесей каждого из них.
В более общем смысле, для любой пары энантиомеров все дескрипторы противоположны: ( R , R ) и ( S , S ) являются энантиомерами, как и ( R , S ) и ( S , R ). Диастереомеры имеют по крайней мере один общий дескриптор; например ( R , S ) и ( R , R ) являются диастереомерами, как и ( S , R ) и ( S , S ). Это справедливо и для соединений, имеющих более двух стереоцентров: если два стереоизомера имеют хотя бы один общий дескриптор, они являются диастереомерами. Если все дескрипторы противоположны, они являются энантиомерами.
Мезосоединение представляет собой ахиральную молекулу, несмотря на наличие двух или более стереогенных центров . Мезосоединение «накладывается» на свое зеркальное изображение, поэтому оно уменьшает количество стереоизомеров, предсказанное 2 н правило. Это происходит потому, что молекула приобретает плоскость симметрии, которая заставляет молекулу вращаться вокруг центральной связи углерод-углерод. [12] Одним из примеров является мезовинная кислота , в которой ( R , S ) совпадает с формой ( S , R ). В мезосоединениях стереоцентры R и S встречаются симметрично расположенными парами. [21]
Относительная конфигурация
[ редактировать ]Относительная конфигурация двух стереоизомеров может быть обозначена дескрипторами R и S со звездочкой (*). ( R *, R *) означает два центра, имеющие одинаковую конфигурацию, ( R , R ) или ( S , S ); ( R *, S *) означает два центра, имеющие противоположные конфигурации, ( R , S ) или ( S , R ). Для начала стереогенному центру с наименьшим номером (согласно систематической нумерации ИЮПАК) присваивается дескриптор R *.
Для обозначения двух аномеров используются относительные стереодескрипторы альфа (α) и бета (β). В α-аномере аномерный атом углерода и атом сравнения имеют противоположные конфигурации ( R , S ) или ( S , R ), тогда как в β-аномере они одинаковы ( R , R ) или ( S , S ). [22]
Лица
[ редактировать ]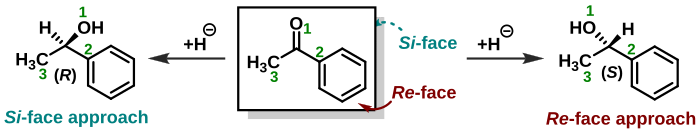
Стереохимия также играет роль в присвоении лиц тригональным молекулам, таким как кетоны . Нуклеофил нуклеофильном при присоединении может приближаться к карбонильной группе с двух противоположных сторон или граней. Когда ахиральный нуклеофил атакует ацетон , обе грани идентичны и образуется только один продукт реакции. Когда нуклеофил атакует бутанон , грани не идентичны ( энантиотопные ), и в результате образуется рацемический продукт . Когда нуклеофил представляет собой хиральную молекулу, диастереоизомеры образуются . Когда одна грань молекулы защищена заместителями или геометрическими ограничениями по сравнению с другой гранью, такие грани называются диастереотопными . Те же правила, которые определяют стереохимию стереоцентра ( R или S ), применяются и при назначении лица молекулярной группы. Лица тогда называются Re -face и Si -face . [23] [24] В примере, показанном справа, соединение ацетофенона видно с Re -грани. Присоединение гидрида, как и в процессе восстановления с этой стороны, образует ( S )-энантиомер, а атака с противоположной Si -грани дает ( R )-энантиомер. Однако следует отметить, что добавление химической группы к прохиральному центру со стороны Re -грани не всегда приводит к ( S )-стереоцентру, поскольку необходимо учитывать приоритет химической группы. То есть абсолютная стереохимия продукта определяется сама по себе, а не с учетом того, с какой стороны на него напали. В приведенном выше примере, если бы хлорид ( Z = 17) был добавлен к прохиральному центру со стороны Re -грани, это привело бы к ( R )-энантиомеру.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Марш, Джерри; Майкл Б., Смит (2007). Передовая органическая химия Марча: реакции, механизмы и структура (6-е изд.). Хобокен, Нью-Джерси: Wiley-Interscience. стр. 155–162. ISBN 978-0-471-72091-1 .
- ^ Перейти обратно: а б с д и ж Кросс, ЖК; Клайн, В. (1974). Правила номенклатуры органической химии: Раздел E: Стереохимия (Рекомендации 1974 г.) (PDF) . ISBN 978-0-08-021019-3 . Архивировано из оригинала (PDF) 7 апреля 2016 г.
- ^ Клейден, Джонатан; Гривз, Ник и Уоррен, Стюарт (2012). Органическая химия (2-е изд.). Оксфорд, Великобритания: Издательство Оксфордского университета. стр. 316ф. ISBN 978-0199270293 . Проверено 2 февраля 2016 г.
- ^ Перейти обратно: а б «Обычно» основано на том факте, что молекулы с хиральными центрами, тем не менее, могут иметь зеркальные плоскости симметрии, например, мезосоединения , что приводит к «вырождению» (идентичности) некоторых стереоизомеров, так что это математическое выражение завышает их число. См. Clayden, op. цит., с. 317.
- ^ Кан, RS ; Ингольд, СК ; Прелог, В. (1966). «Спецификация молекулярной хиральности». Angewandte Chemie, международное издание . 5 (4): 385–415. дои : 10.1002/anie.196603851 .
- ^ Прелог В. и Хельмхен Г. (1982). «Основные принципы системы CIP и предложения по пересмотру». Angewandte Chemie, международное издание . 21 (8): 567–58. дои : 10.1002/anie.198205671 .
- ^ Отдел химической номенклатуры и представления структуры ИЮПАК (2013). «П-9». В Фавре, Анри А.; Пауэлл, Уоррен Х. (ред.). Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 . ИЮПАК – РСК . ISBN 978-0-85404-182-4 .
- ^ Хэнсон, Роберт М.; Мэйфилд, Джон; Вайнио, Микко; Ерин, Андрей; Редькин Дмитрий Владимирович; Мусаккио, София (30 июля 2018 г.). «Алгоритмический анализ правил стереохимии Кана-Ингольда-Прелога: предложения по пересмотренным правилам и руководство по машинной реализации» . Журнал химической информации и моделирования . 58 (9): 1755–1765. doi : 10.1021/acs.jcim.8b00324 . ПМИД 30059222 . S2CID 51876996 .
- ^ Мэйфилд, Джон; Лоу, Дэниел; Сэйл, Роджер (2017). Сравнение реализаций CIP: необходимость открытого CIP . Тезисы докладов Американского химического общества. Том. 254 . Проверено 22 июля 2020 г. Аннотация на сайте издательства [ постоянная мертвая ссылка ]

- ^ Эшенхерст, Джеймс (17 января 2017 г.). «Назначение приоритетов Кана-Ингольда-Прелога (CIP) (2) — метод точек» . Магистр органической химии . Проверено 18 ноября 2022 г.
- ^ Перейти обратно: а б «3.6 Правила предварительного журнала Кана-Ингольда» . Химия LibreTexts . 05.08.2014 . Проверено 18 ноября 2022 г.
- ^ Перейти обратно: а б с д Патрик, Грэм (2004). Органическая химия Instant Notes (2-е изд.). Гирляндная наука. стр. 52–61. ISBN 0203427610 .
- ^ Окуяма, Тадаши; Маскилл, Ховард (2014). Органическая химия, механистический подход . Издательство Оксфордского университета. стр. 38–39. ISBN 9780199693276 .
- ^ Прелог, Владимир; Хельмхен, Гюнтер (август 1982 г.). «Основные принципы системы CIP и предложения по пересмотру». Angewandte Chemie International Edition на английском языке . 21 (8): 567–583. дои : 10.1002/anie.198205671 .
- ^ Кляйн, Дэвид Р. (31 декабря 2013 г.). Органическая химия (2-е изд.). Уайли. п. 203. ИСБН 978-1118454312 .
- ^ Кан, RS (март 1964 г.). «Введение в правило последовательности: система спецификации абсолютной конфигурации». Журнал химического образования . 41 (3): 116. Бибкод : 1964JChEd..41..116C . дои : 10.1021/ed041p116 .
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « Псевдоасимметричный атом углерода ». doi : 10.1351/goldbook.P04921
- ^ Международный союз теоретической и прикладной химии. Комиссия по номенклатуре органической химии (1993). Справочник по номенклатуре органических соединений ИЮПАК: рекомендации 1993 года . Роберт Панико, Уоррен Х. Пауэлл, Жан-Клод Рише. Оксфорд: Научные публикации Блэквелла. ISBN 0-632-03702-4 . ОСЛК 27431284 .
- ^ Эльгеро, Хосе (01 декабря 2016 г.). «Можно ли распространить правила приоритета Кана-Ингольда-Прелога на супрамолекулярные структуры и координационные соединения с использованием неподеленных пар?» . Chemistry International (на немецком языке). 38 (6): 30–31. дои : 10.1515/ci-2016-0633 . ISSN 1365-2192 . S2CID 99300397 .
- ^ Гарольд Харт; Кристофер М. Хадад; Лесли Э. Крейн; Дэвид Дж. Харт (1 января 2011 г.). Органическая химия: Краткий курс . Cengage Обучение. стр. 177–. ISBN 978-1-133-17283-3 .
- ^ Брюс, Паула Юрканис (2007). Органическая химия . Пирсон Прентис Холл. ISBN 978-0-13-199631-1 . OCLC 1046519135 .
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « Относительная конфигурация ». дои : 10.1351/goldbook.R05260
- ^ Мосс, врач общей практики (1996). «Основная терминология стереохимии (Рекомендации ИЮПАК 1996 г.)» . Чистая и прикладная химия . 68 (12): 2193–2222. дои : 10.1351/pac199668122193 . S2CID 98272391 .
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Ре, Си ». дои : 10.1351/goldbook.R05308


