Силикат

4
Силикат — это любой член семейства многоатомных анионов, состоящих из кремния и кислорода , обычно с общей формулой [SiO (4-2 х )−
4- х ]
n , где 0 ≤ x < 2 . Семейство включает ортосиликатные SiO 4− 4 ( x = 0 ), метасиликат SiO 2− 3 ( x = 1 ) и пиросиликат Si 2 O 6− 7 ( Икс знак равно 0,5 , n знак равно 2 ). Это название также используется для любой соли таких анионов, например метасиликата натрия ; или любой сложный эфир , содержащий соответствующую химическую группу , например тетраметилортосиликат . [1] Название «силикат» иногда распространяется на любые анионы, содержащие кремний, даже если они не соответствуют общей формуле или содержат другие атомы, кроме кислорода; например, гексафторсиликат [СиФ 6 ] 2− . Чаще всего силикаты встречаются как силикатные минералы .
Для разнообразных производственных, технологических и художественных нужд силикаты являются универсальными материалами, как природными (такими как гранит , гравий и гранат ), так и искусственными (такими как портландцемент , керамика , стекло и жидкое стекло ).
Структурные принципы
[ редактировать ]В большинстве силикатов атом кремния занимает центр идеализированного тетраэдра , углами которого являются четыре атома кислорода, связанные с ним одинарными ковалентными связями по правилу октетов . [1] Атомы кислорода, несущие отрицательный заряд, связываются с другими катионами (M п+ ). Эта связь Si-OMO-Si является прочной и жесткой, свойства которой проявляются в камнеподобных силикатах. Силикаты можно классифицировать по длине и сшиванию силикатных анионов.
Изолированные силикаты
[ редактировать ]Изолированные ортосиликатные анионы имеют формулу SiO. 4−
4 . Распространенным минералом этой группы является оливин ( (Mg,Fe 2SiO4 ) ) .
Два или более атома кремния могут по-разному разделять атомы кислорода, образуя более сложные анионы, такие как пиросиликат Si.
22О 6−
7 .
Цепи
[ редактировать ]
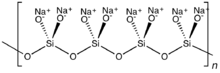
Если два общих оксида связаны с каждым кремнием, могут возникнуть циклические или полимерные структуры. Циклическое метасиликатное кольцо Si
6 Ох 12−
18 – гексамер SiO 3 2- . Полимерные силикатные анионы могут существовать и в виде длинных цепочек.
В одноцепочечных силикатах, которые представляют собой разновидность иносиликата , тетраэдры соединяются в цепь, разделяя по два атома кислорода каждый. Распространенным минералом этой группы является пироксен .

Двухцепочечные силикаты, другая категория иносиликатов, возникают, когда тетраэдры образуют двойную цепь (не всегда, но в большинстве случаев), разделяя по два или три атома кислорода каждый. Обычными минералами этой группы являются амфиболы .
Листы
[ редактировать ]
В этой группе, известной как слоистые силикаты , тетраэдры имеют по три атома кислорода каждый и, в свою очередь, соединяются, образуя двумерные листы. Эта структура действительно приводит к тому, что минералы этой группы имеют одну сильную плоскость спайности. Слюды попадают в эту группу. И мусковит , и биотит имеют очень слабые слои, которые можно отслаивать пластинами.
Рамки
[ редактировать ]В каркасном силикате, известном как тектосиликат , каждый тетраэдр разделяет все 4 атома кислорода со своими соседями, образуя трехмерную структуру. кварц и полевые шпаты К этой группе относятся .
Силикаты с нететраэдрическим кремнием
[ редактировать ]Хотя тетраэдр является обычной координационной геометрией для соединений кремния (IV), кремний также может встречаться с более высокими координационными числами. Например, в анионном гексафторосиликате SiF 2−
6 атом кремния окружен шестью атомами фтора в октаэдрическом расположении. Эта структура также наблюдается в гексагидроксисиликатном анионе Si (OH) 2−
6 , который встречается в таумаите , минерале, редко встречающемся в природе, но иногда наблюдаемом среди других гидратов силиката кальция, искусственно образованных в цементных и бетонных конструкциях, подвергающихся сильному сульфатному воздействию в глинистых грунтах, содержащих окисленный пирит . [2] [3] [4] [5] [6]
При очень высоком давлении, которое существует в большей части земной коры, даже SiO 2 принимает шестикоординированную октаэдрическую геометрию в минерале стишовите , плотной полиморфной модификации кремнезема, обнаруженной в нижней мантии Земли и также образовавшейся в результате ударной волны во время удары метеорита .
Химические свойства
[ редактировать ]Силикаты с катионами щелочных металлов и небольшими или цепочечными анионами, например натрия орто- и метасиликат , хорошо растворимы в воде. они образуют несколько твердых гидратов При кристаллизации из раствора . Растворимые силикаты натрия и их смеси, известные как жидкое стекло, являются важными промышленными и бытовыми химикатами. Силикаты нещелочных катионов или с пластинчатыми и трехмерными полимерными анионами обычно имеют незначительную растворимость в воде при нормальных условиях.
Реакции
[ редактировать ]| Часть серии, посвященной |
| Биоминерализация |
|---|
 |
Силикаты обычно химически инертны. Следовательно, они являются обычными минералами. Их устойчивость также позволяет использовать их в качестве строительных материалов.
При обработке оксидами кальция и водой силикатные минералы образуют портландцемент .
Равновесия, связанные с гидролизом силикатных минералов, трудно изучать. Основная проблема – очень низкая растворимость SiO 4. 4- и его различные протонированные формы. Такие равновесия имеют отношение к процессам, происходящим в геологических масштабах времени. [7] [8] Некоторые растения выделяют лиганды, которые растворяют силикаты, что является этапом биоминерализации .
Обнаружение
[ редактировать ]Силикат-анионы в растворе реагируют с молибдат- анионами с образованием желтых силикомолибдатных комплексов. Было обнаружено , что при типичном приготовлении мономерный ортосиликат полностью реагирует за 75 секунд; димерный пиросиликат за 10 минут; и высшие олигомеры за значительно более длительное время. В частности, реакция не наблюдается с суспензиями коллоидного кремнезема . [8]
Образование цеолита и полимеризация геополимеров
[ редактировать ]Природа растворимых силикатов важна для понимания биоминерализации и синтеза алюмосиликатов , таких как промышленно важные катализаторы, называемые цеолитами . [7] Наряду с алюминат -анионами важную роль в механизме полимеризации геополимеров играют растворимые силикат-анионы . Геополимеры — аморфные алюмосиликаты, для производства которых требуется меньше энергии, чем для производства обычного портландцемента . Таким образом, геополимерные цементы могут способствовать ограничению выбросов CO 2 Земли в атмосферу и глобального потепления, вызванного этим парниковым газом .
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Краммонд, Нью-Джерси; Холливелл, Массачусетс (1995). Таумаситовая форма сульфатной атаки в бетонах, содержащих источник карбонатных ионов. Обзор микроструктуры . Американский институт бетона. дои : 10.14359/963 . ISBN 978-0-87031-652-4 .
- ^ Краммонд, Нора (1 июня 2002 г.). «Присутствие таумазита в современном строительстве – обзор» . Цемент и бетонные композиты . 24 (3): 393–402. дои : 10.1016/S0958-9465(01)00092-0 . ISSN 0958-9465 .
- ^ Краммонд, Нью-Джерси (1 декабря 2003 г.). «Таумаситовая форма сульфатной атаки в Великобритании» . Цемент и бетонные композиты . Таумазит в цементных материалах. 25 (8): 809–818. дои : 10.1016/S0958-9465(03)00106-9 . ISSN 0958-9465 .
- ^ Лонгворт, Т.И. (1 декабря 2003 г.). «Вклад строительной деятельности в агрессивные грунтовые условия, вызывающие сульфатную атаку таумазита на бетон в пиритном грунте» . Цемент и бетонные композиты . Таумазит в цементных материалах. 25 (8): 1005–1013. дои : 10.1016/S0958-9465(03)00124-0 . ISSN 0958-9465 .
- ^ Симс, Ян; Хантли (урожденная Хартшорн), Сара А. (01 октября 2004 г.). «Таумаситовая форма сульфатной атаки нарушает правила» . Цемент и бетонные композиты . 26 (7): 837–844. doi : 10.1016/j.cemconcomp.2004.01.002 . ISSN 0958-9465 .
- ^ Jump up to: а б Найт, Кристофер Т.Г.; Балец, Раймонд Дж.; Кинраде, Стивен Д. (2007). «Строение силикат-анионов в водных щелочных растворах». Angewandte Chemie, международное издание . 46 (43): 8148–8152. дои : 10.1002/anie.200702986 . ПМИД 17886822 .
- ^ Jump up to: а б ГБ Александр (1953): «Реакция низкомолекулярных кремниевых кислот с молибденовой кислотой». Журнал Американского химического общества, том 75, выпуск 22, страницы 5655–5657. два : 10.1021/ja01118a054